skan0149 (2)

152 Roztwory i równowagi fazowe
Entalpię nadmiarową IiE można obliczyć z równania
I • (4-43)
p
= GE + TSe = -RT2 I Xj
Na nadmiarową entalpię swobodną składają się dwa czynniki - energetyczny oraz entropowy (GE = - TSE). Roztwory, w których odstępstwo od dosko
nałości spowodowane jest przez ten pierwszy (HE * 0), nazywamy regularnymi. Odstępstwo to wynika z różnicy między energią oddziaływania cząsteczek tego samego rodzaju w czystych cieczach a energią oddziaływania cząsteczek różnego rodzaju w roztworze.
Różnice w rozmiarach i geometrii cząsteczek prowadzą do różnych liczb możliwych konfiguracji i lokalnych struktur (SE * 0). Roztwory, w których czynnik entropowy powoduje odstępstwo od doskonałości, nazywamy atermalnymi.
Przykład 4.11. Rurką z zaworem połączono dwa zbiorniki gazu. Obydwa były termostatowane w 25°C. Pierwszy zawierał 3 mole argonu pod ciśnieniem 4 barów, drugi mieścił 6 moli neonu pod ciśnieniem 2 barów. Po otwarciu zaworu oba gazy wymieszały się. Obliczyć AG i AS tego procesu, przy założeniu, że gazy są doskonałe.
Rozwi ązan i e. Ciśnienia początkowe/; - obu gazów różnią się od ciśnienia standardowego (p° = 1 bar). Jest to więc przypadek bardziej ogólny niż opisany wyrażeniem (4.36), gdyż entalpia swobodna każdego z nich przed zmieszaniem (stan początkowy) wynosi
p±
p°
G* = niU° + RT\n
Przy założeniu, że mieszanina jest doskonała {p,■ = jc,-pc), entalpia swobodna z-tego składnika po zmieszaniu (stan końcowy) dana jest wyrażeniem
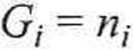
|/7° + RT ln.Y, + RT ln
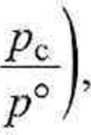
gdzie ciśnienie całkowite
Pc = -J-TT- RT = ~
I («,//?') 3/4 + 6/2
= 2,4 bara.
AG procesu mieszania, zgodnie z (4.30), wynosi G,^1 = XG, -X G*, a w kon sekwencji
Gfd = RT
X / lnXj - X ln + (X 77,-) ln ^
P P J
lub, po prostym przekształceniu,
Wyszukiwarka
Podobne podstrony:
65435 skan0153 (2) 156 Roztwory i równowagi fazowe gdzie wyrażenie w pierwszym nawiasie jest entalpi
skan0137 140 Roztwory i równowagi fazowe Równanie (4.24) jest nazywane prawem Van’t Hoffa. Dla roztw
skan0155 158 Roztwory i równowagi fazowe Po podstawieniu odpowiednich wartości z tab. 4.9 dostaniemy
skan0167 170 Roztwory i równowagi fazowe Rys. 4.20. Równowaga w układzie dwuskładnikowym, ciało stał
skan0171 (2) 174 Roztwory i równowagi fazowe Przykład 4.16. W tab. 4.12 zestawiono dla ciśnienia 760
skan0195 198 Roztwory i równowagi fazowe Temperatury wrzenia benzenu i toluenu pod ciśnieniem 400 mm
12851 skan0127 130 Roztwory i równowagi fazowe wego w wodzie c i ksylenie c" wynosiły odpowiedn
skan0125 128 Roztwory i równowagi fazowe Zatem 0,343 0,343 + 5,11 0,0629; x} = 1 -x2 = 0,937. c) Stę
skan0133 136 Roztwory i równowagi fazowe Temperatura krzepnięcia roztworu Tk, zawierającego nielotną
skan0135 138 Roztwory i równowagi fazowe Rozwiązanie. Do obliczeń y2 wykorzystamy wzór (4.20) 0- 1 m
skan0139 142 Roztwory i równowagi fazoweym = Y n + n2 - X] Yy + x2Y2. (4.28) Różniczkując (4.27) otr
skan0177 180 Roztwory i równowagi fazowe Hz0 (0) % wagowe N
skan0181 184 Roztwory i równowagi fazowe 4c:l. W 25°C prężność pary wodnej wynosi 23,76 mm Hg. Oblic
skan0183 186 Roztwory i równowagi fazowe 4d:3. Obliczyć stężenie roztworu glukozy izotonicznego z ro
więcej podobnych podstron