75992 skan0150

Roztwory i równowagi fazowe 153
Roztwory i równowagi fazowe 153
Gjj = RT
X\P° x~>p° p
;?! In ~ + w2ln ~ + (wi + w?)ln ~Z
P i Pi P
Po podstawieniu wartości liczbowych otrzymamy
(1/3)
= -15,29 kJ,
G>} = 8.314 -298,15 3 In
„ , (2/3) -1 A , 2,4 + 6 • ln----ł- 9 • ln —
cM — ^id--
^ld
51,27 J -K"1.
Gdyby ciśnienia początkowe obu gazów były takie same, czylip{= p2 =pc, wówczas
Gjd1 = RT(Z n,hix,) = -14,20 kJ
oraz = 47,63 J • K_1. Potwierdza to znaną z doświadczenia obserwację, że łatwiej jest zmieszać składniki przy różnych ciśnieniach początkowych. ■
W cząstkowych molowych funkcjach mieszania, Y™ = Y-, - Y*, mierząc objętość, możemy jednoznacznie określić wszystkie wielkości. Nieco inaczej jest w przypadku pomiaru entalpii powstawania roztworu. Rozróżnia się tu dwa efekty cieplne (zob. schemat 4.2) - całkowite (integralne) ciepło rozpuszczania AH-ml i całkowite ciepło rozcieńczania <Pr, każde z nich w przeliczeniu na 1 mol substancji rozpuszczonej.
+
h = nxHx + n2H2
n2AHm
7',/;=const
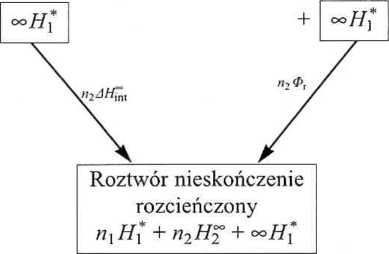
Schemat 4.2. Ciepło rozpuszczania i ciepło rozcieńczania
Pierwszy z nich dotyczy procesu rozpuszczania w warunkach izotermiczno--izobarycznych n2 moli substancji (2) w /?, molach rozpuszczalnika (1). Drugi efekt występuje wtedy, gdy gotowy już roztwór o stężeniu n2 : nx rozcieńczymy i dla T, p = const) nieskończenie dużą ilością rozpuszczalnika.
Wyszukiwarka
Podobne podstrony:
skan0130 (2) Roztwory i równowagi fazowe 133 Dla roztworu o jc2 = 0,6 Gf1 = -3272,5 J • mol-1, G™ =
skan0144 (2) Roztwory i równowagi fazowe 147 Zależność przedstawiona na rys. 4.9,
skan0164 (2) Roztwory i równowagi fazowe 167 wykreślić diagram destylacyjny mieszaniny benzenu i tol
skan0166 Roztwory i równowagi fazowe 169 x2 - dx2 = x2n —y2dn n - dn Zaniedbując iloczyn dx2dn ~ 0,
skan0170 (2) Roztwory i równowagi fazowe 173 mamy MC* AH° = AH°opni + (T- 7t więc otrzymane wyrażeni
skan0178 Roztwory i równowagi fazowe 181 v - 0 x-0 8-0 10-0=*y = 0,8 • *. Linia Sb przechodzi przez
skan0123 4. Roztwory i równowagi fazowe Roztworem nazywamy homogeniczną mieszaninę dwu lub więcej su
skan0134 Roztwory i równowagi fazowe 137 Rozwiązanie. Entalpia topnienia w zadaniu dotyczy 1 grama b
skan0136 Roztwory i równowagi fazowe 139 Rys. 4.5. Wyznaczanie współczynnika aktywności metodą krios
więcej podobnych podstron