78276 S0013 (2)
1. Selektywne tworzenie wiązań węgiel węgiel
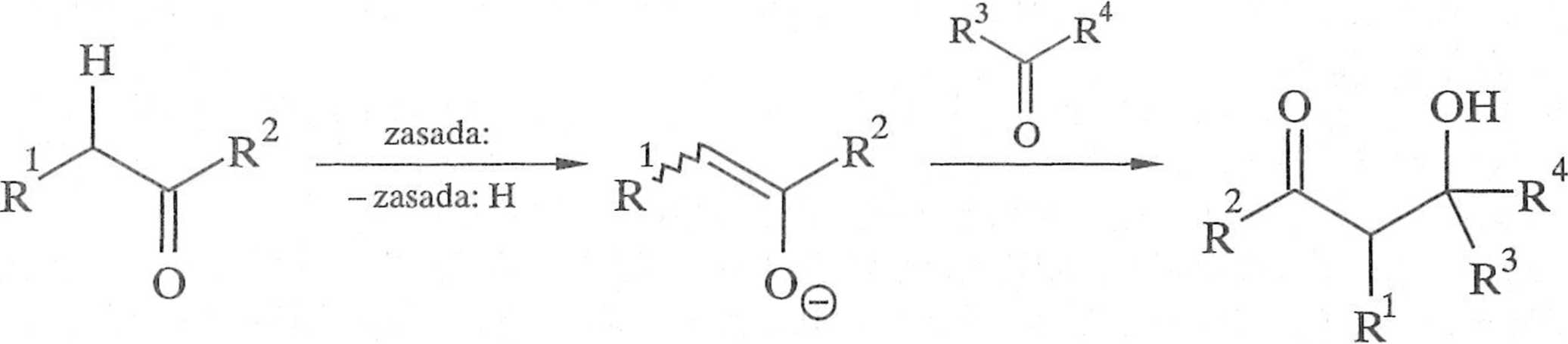
reakcja
bezpośrednia
H


2
reakcja
pośrednia
O OH
Schemat 1.2.2
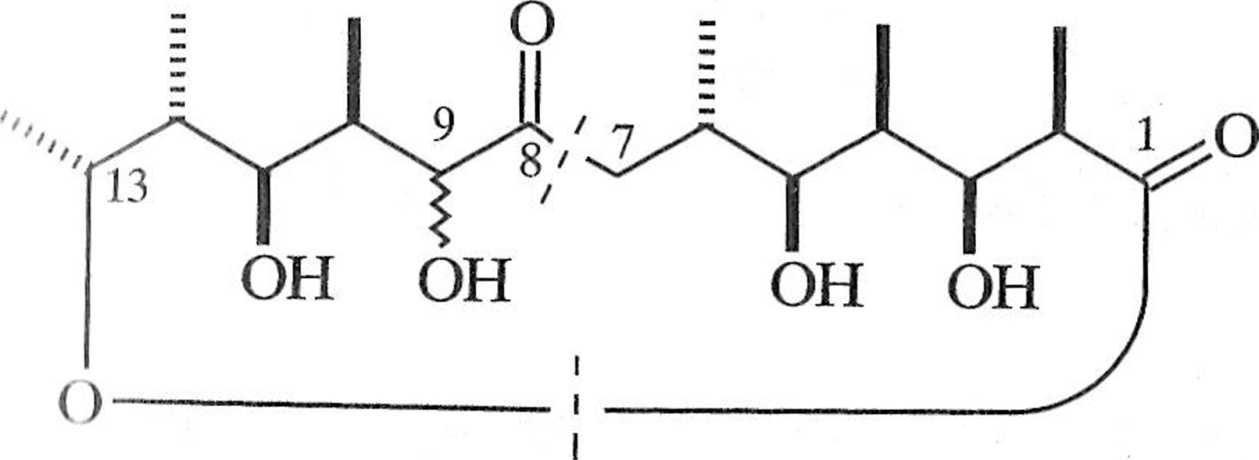
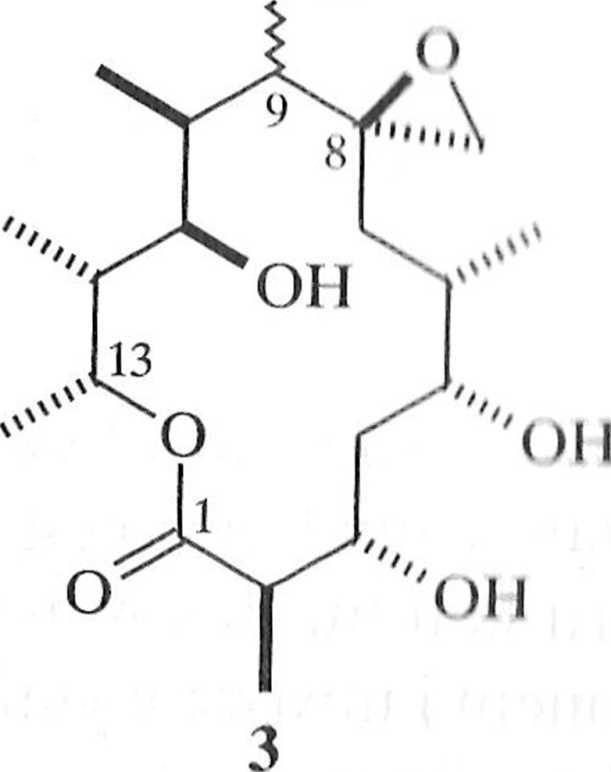
Poglądowym przykładem efektywnego wykorzystania reakcji aldolowej może być synteza oleandomycyny (1) — makrocyklicznego antybiotyku o szerokim zastosowaniu klinicznym. Synteza oleandomycyny stanowiła wyzwanie dla chemików z co najmniej trzech powodów:
- selektywnej syntezy 14-członowego laktonu;
- stereoselektywnej konstrukcji 10 centrów stereogenicznych;
- chemoselektywnej glikozydacji oleandolidu (2).
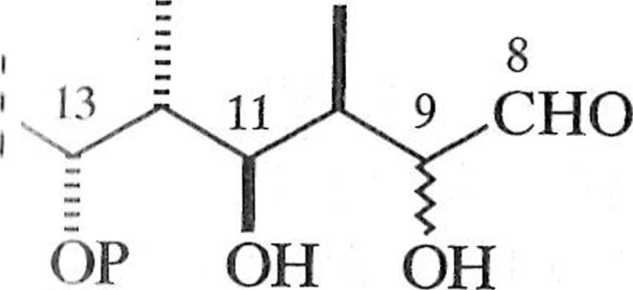
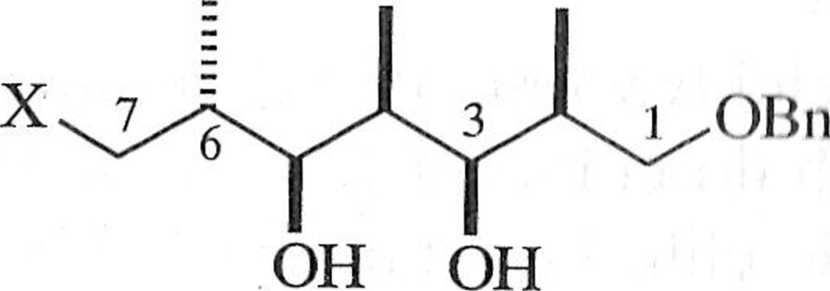
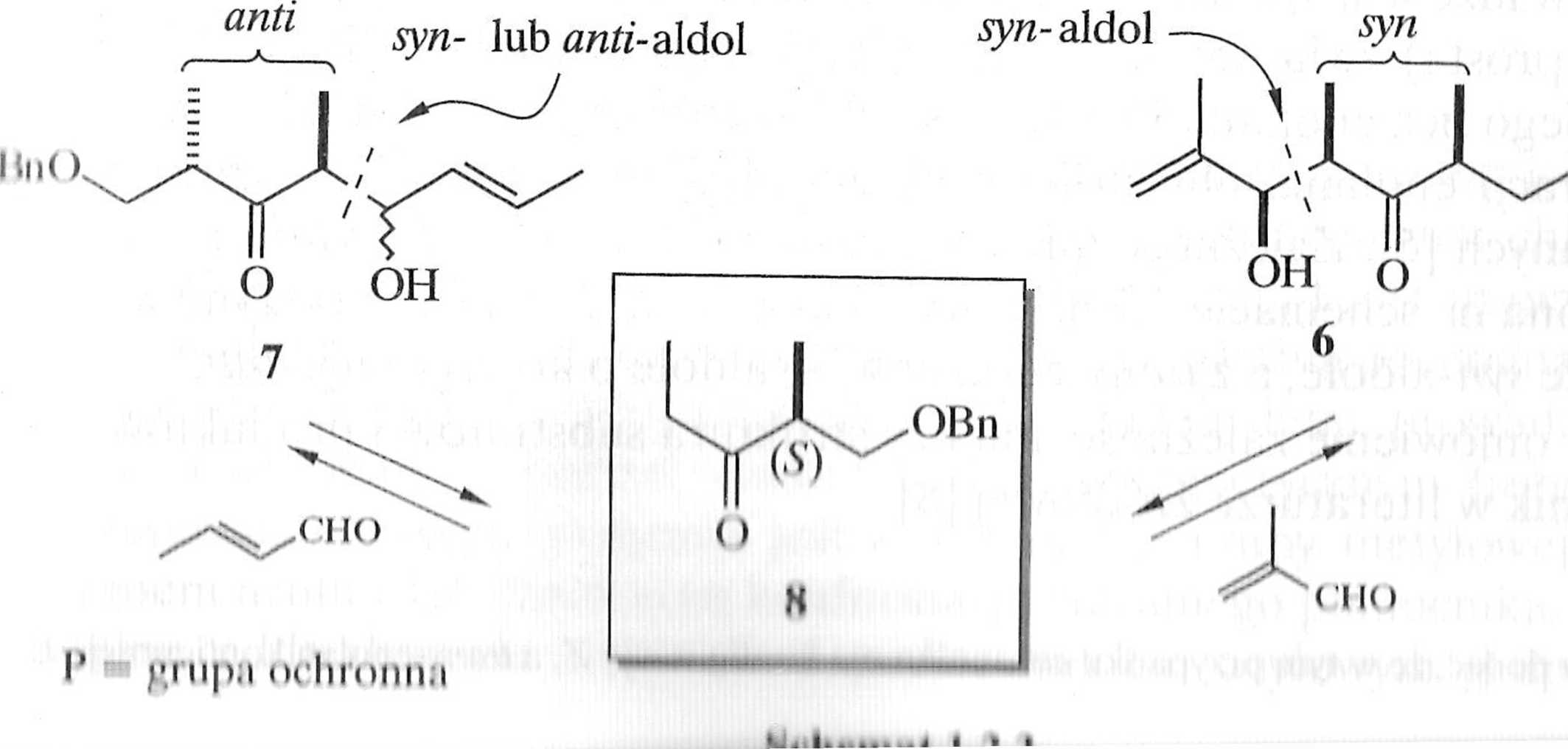
Zaproponowana przez Patersona i współpracowników synteza 1, przedstawiona w postaci drzewa retrosyntetycznego (schemat 1.2.3), wykorzystywała asymetryczną reakcję aldolową na etapie tworzenia yyn-aldolu 6 i syn- lub aldo-lu 7. Substratem wyjściowym wykorzystanym przez Patersona był relatywnie prosty związek (S)-l-benzyloksy-2-metylopentan-3-on (8) [4].
Obecnie znanych i stosowanych jest bardzo wiele rodzajów i modyfikacji krzyżowej reakcji aldolowej, które można dzielić wedle różnych kryteriów [5]. Jednym z nich może być sposób generowania enolanu, co jest istotne zwłaszcza w przypadku niesymetrycznych związków karbonylowych, na przykład 2-metylocy-kloheksanonu (schemat 1.2.4) [6].
Enolan powstający w warunkach kontroli kinetycznej (keton dodawany jest w niskiej temperaturze do nadmiaru silnej zasady) jest produktem dcprolonowa-nia od strony mniej osłoniętej ([!). Aby ograniczyć możliwość i/onniy/acji, laki

()

oleandolid
OH
?
OBn
Wyszukiwarka
Podobne podstrony:
S0035 (2) 1. Selektywne tworzenie wiązań węgiel-węgiel («-Bu4NC1) kieruje reakcję w stronę termodyna
57325 S0008 (2) I. Selektywne tworzenie wiązań węgiel-węgiel lun;) cechą reakcji Dielsa-Aldera jest
S0041 (2) I. Selektywne tworzenie wiązań węgiel-węgiol u) [Mo] + + ■Ht, tłialkenowy proces
S0023 (2) I Selektywna tworzenie wiązań węgiel węgiel (4) 2 ( ) + Ph Nil, A />-TsOH Me toluen,
S0042 (2) I Selektywne tworzenie wiązań węgiel-węgiel ii) RCM CH CH PhH, 24 h 22 °C wyd. 90% e.e. 95
S0046 (2) I Selektywne tworzenie wiązań węgiel węgio! jącego 2-3 mg BHT. Roztwór ten wkrapla się prz
42209 S0044 (2) 1. Selektywne tworzenie wiązań węgiel-węgiul związek cykliczny i eten lub inny lotny
S0023 (2) I Selektywna tworzenie wiązań węgiel węgiel (4) 2 ( ) + Ph Nil, A />-TsOH Me toluen,
83227 S0046 (2) I Selektywne tworzenie wiązań węgiel węgio! jącego 2-3 mg BHT. Roztwór ten wkrapla s
więcej podobnych podstron