79600 skanuj0021 (68)
462
14. Leki przeciwbakteryj ne
462
l J Miejsca, które można zmieniać
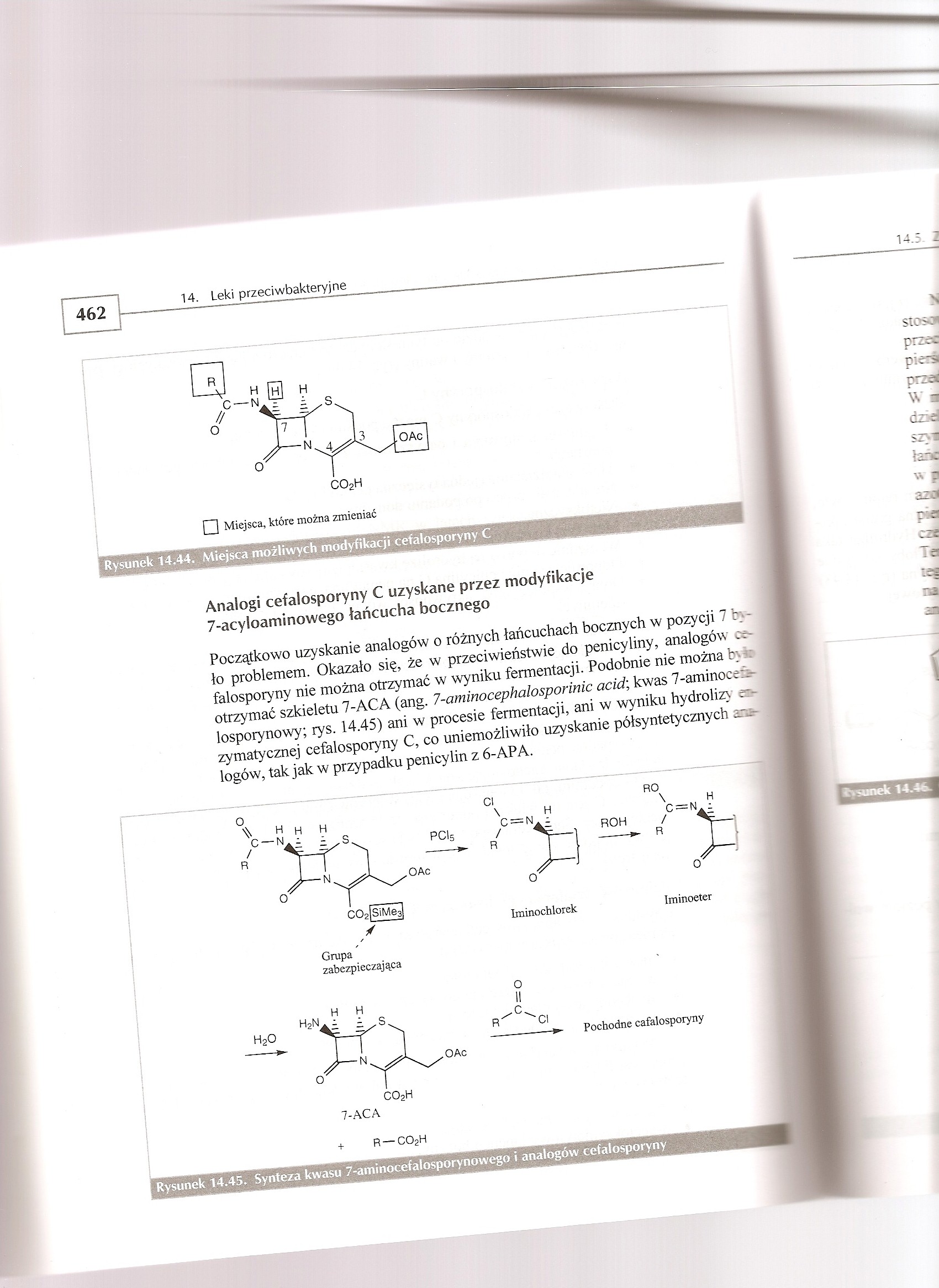
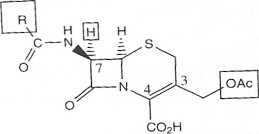
Rysunek 14.44. Miejsca możliwych modyfikacji cefalosporyny C
Analogi cefalosporyny C uzyskane przez modyfikacje 7-acyloaminowego łańcucha bocznego
Początkowo uzyskanie analogów o różnych łańcuchach bocznych w pozycji 7 b>-ło problemem. Okazało się, że w przeciwieństwie do penicyliny, analogów cefalosporyny nie można otrzymać w wyniku fermentacji. Podobnie nie można był* otrzymać szkieletu 7-ACA (ang. 7-aminocephalosporinic acid\ kwas 7-aminocef*-lospoiynowy; rys. 14.45) ani w procesie fermentacji, ani w wyniku hydrolizy e»-i zymatycznej cefalosporyny C, co uniemożliwiło uzyskanie półsyntetycznych analogów, tak jak w przypadku penicylin z 6-APA.

zabezpieczająca
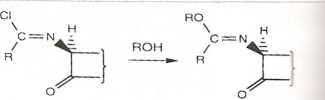
Iminochlorek
Iminoeter

Wyszukiwarka
Podobne podstrony:
62149 skanuj0304 Dla przekładni stożkowej o osiach przecinających się pod kątem Z = 90 można również
skanuj0017 (89) 458 14. Leki przeciwbakteryjne H polamości Rysunek 14.39. „Wydłużony" polarny e
skanuj0027 (53) 468 14. Leki przeciwbakteryjne • Wywołuje ból podczas iniekcji, dl
skanuj0033 (35) 474 14. Leki przeciwbakteryjne N - AGHFi LOGV.JYSLOZ.AMIN A. KWAS
skanuj0037 (30) 478 14, Leki przedwbakteryjne14.6. Związki przeciwbakteryjne działające na strukturę
skanuj0043 (23) 484 14. Leki przeciwbakteryjne wodu pokarmowego, która wytwarza witaminę K potrzebną
76202 skanuj0025 (55) 466 14. Leki przeciwbakteryjne C02Me
13537 skanuj0035 (32) 476 14. Leki przeciwbakteryjne układem cyklicznym, więc cząsteczka nie może si
65280 skanuj0005 (231) 446 14. Leki przeciwbakteryjne ch2-co2h + PENICYLINA G C02H h2n, Rysunek 14.2
więcej podobnych podstron