69086 S0033 (2)




I Soloktywno twoi zenie wiqzań węgiel węgiel

Mechanizm reakcji Hecka jest generalnie dość skomplikowany, wieloetapowy i zależny od typu katalizatora i warunków reakcji. Poniżej zostanie omówiony mechanizm reakcji katalizowanej tetrakis(trifenylofosfino)palladem(0) — mechanizm „podręcznikowy”, ale jednocześnie bardzo poglądowy i — historycznie pierwszy zaproponowany. Poznanie tego mechanizmu jest kluczem do zrozu mienia również innych typów reakcji katalizowanych kompleksami metali przej ściowych [10,11].
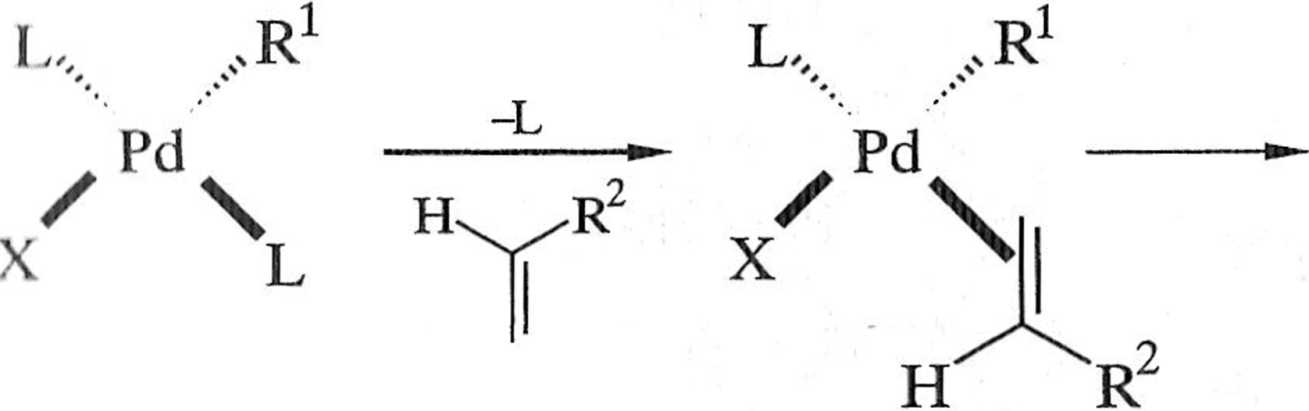
lYzy użyciu tego katalizatora najpierw następuje eliminacja dwóch grup trife-nylofosfinowych z utworzeniem nuldeofilowego i bogatego w elektrony, koordy nacyjnie nienasyconego bis(trifenylofosfino)palladu(0), który jest właściwym ka-lalizatorem reakcji. W pierwszym etapie cyklu katalitycznego (A, schemat 1.6.2) halogenek arylu lub alkenu R'X przyłącza się do katalizatora, z równoczesnym utlenieniem palladu(O) do palladu(II) (addycja utleniająca), dając kompleks typu
0 (ci-alkenylo lub oarylopallad(II) [R1-Pd(PPh3)2X]) 4 o konfiguracji trans.
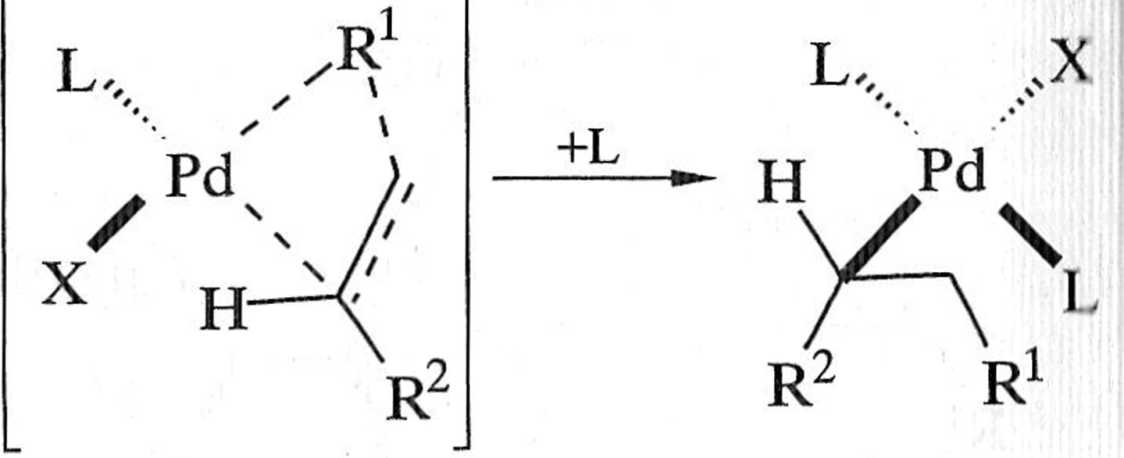
Na następny krok cyklu katalitycznego reakcji Hecka składa się kilka procesów, których mechanizmy nie zostały jeszcze dokładnie poznane. Wiadomo, że w wyniku substytucji jeden z ligandów L w kompleksie 4 zostaje zastąpiony alkenem, tworząc ^-kompleks 4'. W kompleksie 4' zarówno alken 1, jak i grupa R1 mają względem siebie konfigurację cis.Jest to warunek konieczny do insercji al kenu do wiązania n-alkenylowego lub cr-arylowego-C-Pd (schemat 1.6.3). Osta-
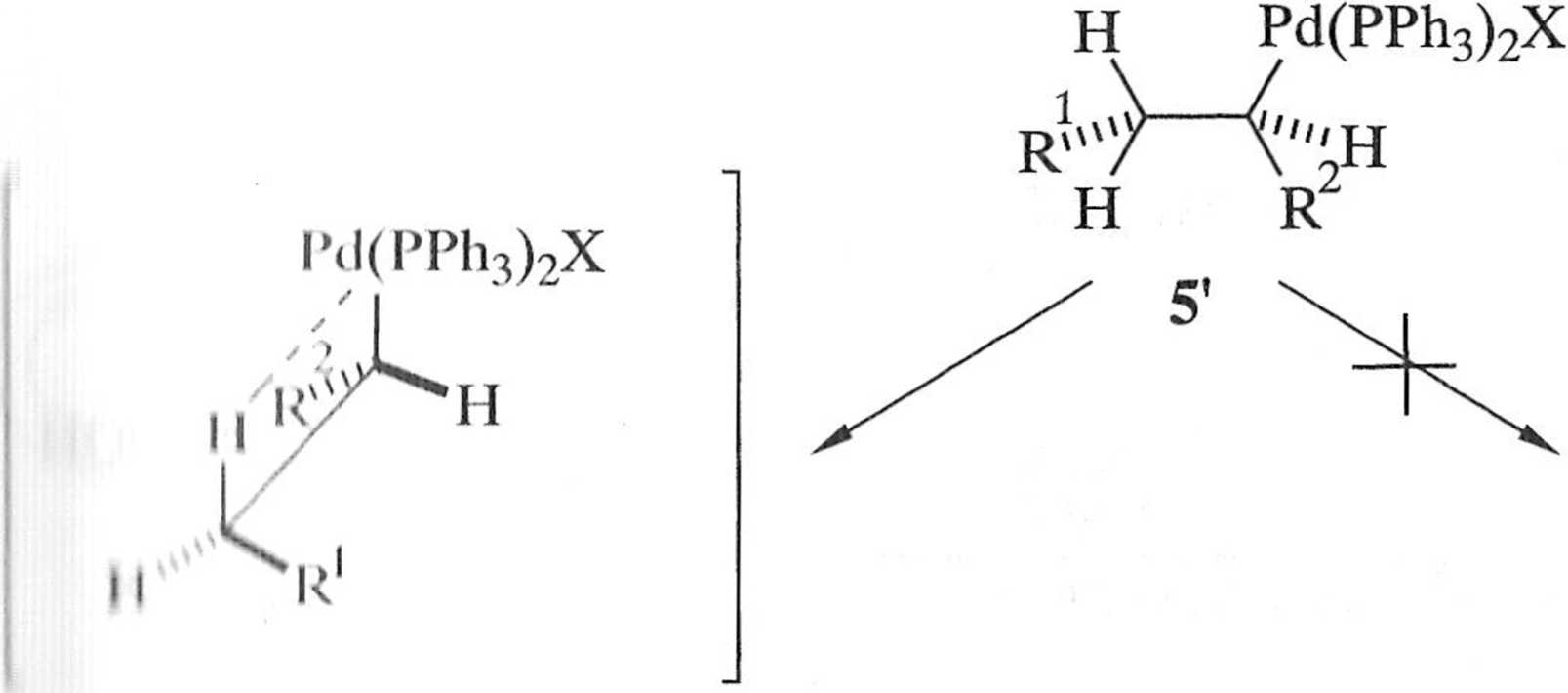
1 ocznie — alken włączony zostaje w wiązanie <7-alkenyIowy lub <j-aiylowy-węgiel-pallad, dając w efekcie nowy niestabilny kompleks cr-alkilopalladowy 5 (etap B — schemat 1.6.2). Po rotacji wokół wiązania węgiel-węgiel, w wyniku której pallad i atom wodoru przy węglu fi stają się .syn-koplanarne (5'j (C, schemat 1.6.2), następuje redukcyjna eliminacja atomu wodoru (D, schemat 1.6.2), której efektem jest alken 3 i katalitycznie nieaktywny [HPd(PPh3)2X], z którego pod wpływem zasady odtwarzany jest [Pd(PPh3)2], po czym cały cykl rozpoczyna się od nowa.
Regioselektywność insercji alkenu jest determinowana przez czynniki ste-i-yczne — kompleks 4 przyłącza się do mniej zatłoczonego atomu węgla alkenu 2.
trans-4
K1 = aryl, winyl

L - WU i
»'
Schemat 1.6.3
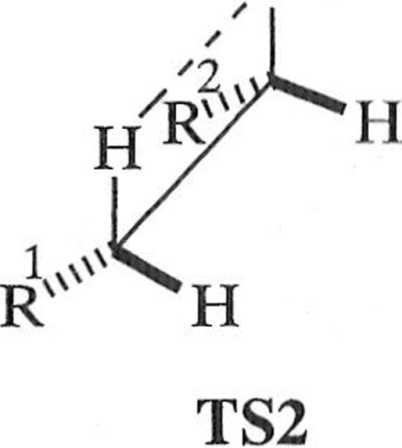
i hiiumi.isl o slereoselektywności reakcji I let ka decyduje etap ^//-eliminacji. .Sio mit l izomerów Ei Z związku 3 odzwierciedla relatywne energie odpowiednich
.....iw przejściowych TS1 i TS2 (schemat 1.6.4), co jest zgodne z zasadą Curli
liii ll.immclta.
TS1
Pd(PPh3)2X

*
Schemat 1.6.4
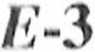
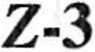
* uh, i i upa R2 jest grupą małą, reakcja jest wysoce stereoselektywna, gdyż w ml u otrzymuje się wyłącznie izomery o konfiguracji [10].
( hociaż generalnie do prowadzenia reakcji Hecka wymagane są warunki
li
l»"i
Im'
. h |
t . ulne, to jednak niektóre reakcje przebiegają z zadowalającymi wydajnością i lodowisku wodnym, przy użyciu węglanów sodu lub potasu albo czwailo 4-iwych soli amoniowych jako zasad [12]. Następuje wówczas zmiana warun i i• akcji z ciało stałe-ciecz (dla rozpuszczalników organicznych i warunków i nudnych) na ciecz-ciecz. Nie jest wymagany wtedy udział Uganda fosfinowe hlory w tym przypadku jest zastępowany ligandem utworzonym z jonu hy I .ylowcgo (6, schemat 1.6.5). Taki kompleks jest bardziej labilny, co w efek u iwoduje przyspieszenie reakcji [2, 11]. Reakcja w tej wersji znalazła zastoso .......nędzy innymi w syntezie pochodnych kwasu cynamonowego (schemat
i fi) 11()|.
leżeli reakcja jest prowadzona w temperaturze powyżej 120°C (niereaktywne i ...ml i lub chlorki arylowe), lo zc względu na nietrwałość termiczną kompleksy
Wyszukiwarka
Podobne podstrony:
S0033 (2) I Soloktywno twoi zenie wiqzań węgiel węgiel Mechanizm reakcji Hecka jest generalnie dość
S0038 (2) I Selektywne tworzenie wiqzań węgiel węgiel Zastosowanie sekwencji reakcji: tworzenie estr
64377 S0038 (2) I Selektywne tworzenie wiqzań węgiel węgiel Zastosowanie sekwencji reakcji: tworzeni
64377 S0038 (2) I Selektywne tworzenie wiqzań węgiel węgiel Zastosowanie sekwencji reakcji: tworzeni
Pomiary poziomu w zasobnikach węgla i biomasy Węgiel dostarczany transportem kolejowym jest
DSC00811 (10) /.€ potomność przeczyta za umi/cz 1!.; k bohaterów, nie mogą cl u- uć ;twOi*zenie
Zadanie 12 Węgiel określonej klasy podawany jest przenośnikiem na zsuwnie, gdzie może być kierowany
Węgielnica pryzmatyczna podwójna zbudowana jest z dwóch pryzmatów ustawionych względem siebie pod ką
Faza debiutowa jest kamieniem węgielnym każdej partii w szachach i jest ściśle związana z grą środko
S0036 (2) I Soloktywne tworzenie wiązań węgiel-węgiel talo)-bis[o-(di-otolilofosfino)benzylo]dipalla
67497 S0045 (2) I. Soloktywne tworzenie wiązań węgiel węyiol o 3a c.h2ci2 Schemat 1.8.12 ( I + 3a lu
S0036 (2) I Soloktywne tworzenie wiązań węgiel-węgiel talo)-bis[o-(di-otolilofosfino)benzylo]dipalla
S0036 (2) I Soloktywne tworzenie wiązań węgiel-węgiel talo)-bis[o-(di-otolilofosfino)benzylo]dipalla
więcej podobnych podstron