313 [1024x768]

ELEKTROCHEMIA
Podstawową właściwością stałej dysocjacji, jako stałej równowagi chemicznej, jest jej niezależność do stężenia c. Tymczasem, stałe dysocjacji obliczane dla mocnych elektrolitów według równania (5.9) zależą od stężenia, co dowodzi, że w roztworach mocnych elektrolitów nie istnieją równowagi dysocjacyjne, jak zakładał Arrhenius.
Stała dysocjacji obliczona według równania Ostwalda okazała się stałą równowagi niezależną od stężenia jedynie w przypadku słabych elektrolitów, takich jak CHjCOOH, HCN itp.
Przykład
Obliczyć stopień dysocjacji CH,COOH w roztworze o stężeniu 0,01 M. Stała dysocjacji kwasu octowego wynosi /Cc » 1,85-10"*.
Zgodnie z równaniem Ostwalda:
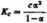
czyli po przekształceniu e-^+ICca-Kc - 0
-JŁ+ yx;+4cK< -1.85- l0-* + »,60- 10'*
“ To/H
X - 0,042
Warto zauważyć, że jeżeli stopień dysocjacji jest niezbyt wielki (tzn. gdy K* < 10"*), to można równięż korzystać z uproszczonego równania:
X<£ca*
skąd
«S|/i -0,043
Można stwierdzić, te teoria czuciowej dysocjacji Jest słuszna jedynie w przypadku słabych elektrolitów. Naletalo przyjąć, te elektrolity mocne są całkowicie zdysocjowane na jony (« — 1).
Pogląd ten umocnił się zwłaszcza, gdy w roku 1912 Bragg oznaczył strukturę krystaliczną NaCl i stwierdził, te w węzłach sieci krystalicznej znajdują się jony Na* i Cl" a nie cząsteczki NaCl.
W swojej teorii dysocjacji elektrolitycznej Arrhenius zaniedbał wpływ wody jako rozpuszczalnika. W przypadku takich związków jak NaCl, zbudowanych jut w stanie krystalicznym z jonów, trudno byłoby zrozumieć, w jaki sposób
Wyszukiwarka
Podobne podstrony:
DSC04490 (2) Do podstawowych właściwości skóry futrzarskie} Jako całości należy: ❖
14466 P1040136 RlnK Wyznaczanie funkcji termodynamicznych reakcji na podstawie pomiarów stałej równo
Strona00012 - 12 - Dioda - element półprzewodnikowy z dwoma elektrodami, którego podstawową właściwo
1tom326 13. ELEKTROTERM1A 654 Tablica 13.4. Podstawowe właściwości niektórych stopów austenitycznych
1tom327 13. ELEKTROTERMIA 656 Tablica 13.7. Podstawowe właściwości materiałów
432 3 11. ELEKTROWNIE JĄDROWE jądrowymi. W reaktorach jądrowych jako paliwo mogą być stosowane trzy
(elektryczny), pole elektryczne i magnetyczne [SP]. Prawa Maxwella jako podstawowe prawa e-m, znane
ScannedImage 42 logii kontekstualnej, która traktuje doświadczenia współczesne jako podstawę właściw
Obraz (1072) 428 HNOj, H2S04 nitrowanie kwasu benzoesowego jako przykład elektrofilowego podstawieni
403 [1024x768] 412 ELEKTROCHEMIA Podstawą spektrofotomctrycznego wyznaczania pH jest stosowalność pr
405 [1024x768] ELEKTROCHEMIA przy dodatku niewielkiej ilości mocnego kwasu lub zasady. Właściwość ta
253 [1024x768] 260 PODSTAWY TERMODYNAMIKI CHEMICZNEJ Energię poziomów elektronowych tlenu przeliczam
2tom175 Poradnik inżyniera elektryka tom 2 Tablica 5.64. Podstawowe właściwości silników prądu
więcej podobnych podstron