253 [1024x768]

260 PODSTAWY TERMODYNAMIKI CHEMICZNEJ
Energię poziomów elektronowych tlenu przeliczamy na ergi, według równania:
et — hvt = h • c • = 19,86- 10-I7rj.
Sumy stanów dla odpowiednich temperatur obliczamy z definicji (3.214):
*<mok> - 5-exp(-0/*r)+3-exp(-3.l25- I0—/*D +
+ 1 -exp(-4,490- lO~lĄ/kT)+ ... =
= 5 + 3 -0.470+1-0,339 - 6,749
Analogicznie dla temperatur 1000 i 2000 K:
ioook) - 5 + 3-0,802+1-0,718 » 8,124 «Mjoook> - 5 + 3-0,895+1-0,852 - 8,537
Jak wynika z obliczeń, ostatnie dwa poziomy energetyczne nie wnoszą praktycznie żadnego wkładu do sumy stanów nawet w temperaturze 2000 K.
5. Wspólny zerowy poziom energii. Rozważając poszczególne sumy stanów, przyjmowaliśmy w każdej z nich pewne dowolne zero energii; zwykle był nim stan o najniższej liczbie kwantowej (np. v = 0, J = 0 itp). Jest rzeczą oczywistą, że dla wszystkich sum stanów należy przyjąć pewien wspólny zerowy poziom energii. Zagadnienie to możemy rozwiązać następująco: wg równania (3.163) mamy <ł' = ^g,'c ",kT
gdzie przez q' oznaczamy sumę stanów nie odniesioną jeszcze do wspólnego poziomu zerowego energii. Wstawiając w miejsce energii «4 wartość (f, + z0). otrzymujemy:
i
/
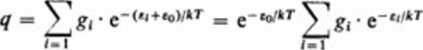
Zatem suma stanów określona względem wspólnego, zerowego poziomu energetycznego e0, ma postać
(3.215)
q = e”*^łr • c(
gdzie q" jest określone równaniem
? " <7tr»n*i ’ ?ć| ‘ ?oic ’ ^rot
Znaki „prim" oznaczają sumy stanów określone równaniami (3.189), (3.200) lub (3.206).
Przesunięcie umownego poziomu zerowego energii cząstki o wartość e0 spowodowało więc zmianę wyrażenia na sumę stanów (wyrażającą się w jej
Wyszukiwarka
Podobne podstrony:
243 [1024x768] 250 PODSTAWY TERMODYNAMIKI CHEMICZNEJ oraz wyrażeniem na energię wewnętrzną (3.170) I
221 [1024x768] 228 PODSTAWY TERMODYNAMIKI CHEMICZNEJWspółczynnik aktywności. Stany standardowe Warto
223 [1024x768] 230 PODSTAWY TERMODYNAMIKI CHEMICZNEJ 230 PODSTAWY TERMODYNAMIKI CHEMICZNEJ Stany STA
225 [1024x768] 232 PODSTAWY TERMODYNAMIK! CHEMICZNEJ Jeżeli dla reakcji zachodzącej w układach rzecz
229 [1024x768] 236 PODSTAWY TERMODYNAMIKI CHEMICZNEJ znać wartości cząstkowych molowych funkcji term
231 [1024x768] 238 PODSTAWY TERMODYNAMIKI CHEMICZNEJ które po uwzględnieniu (3.112) przyjmie
233 [1024x768] 240 PODSTAWY TERMODYNAMIKI CHEMICZNEJ Termin „roztwory pospolite” wyraża tutaj jedyni
239 [1024x768] 246 PODSTAWY TERMODYNAMIKI CHEMICZNEJ 246 PODSTAWY TERMODYNAMIKI
241 [1024x768] 248 PODSTAWY TERMODYNAMIKI CHEMICZNEJEntropia a prawdopodobieństwo termodynamiczne Ja
245 [1024x768] 252 PODSTAWY TERMODYNAMIKI CHEMICZNEJ 1. Traaslacyjna suma stanów. Aby obliczyć sumę
247 [1024x768] 254 PODSTAWY TERMODYNAMIKI CHEMICZNEJ wówczas: 254 PODSTAWY TERMODYNAMIKI CHEMICZNEJ
251 [1024x768] 258 PODSTAWY TERMODYNAMIKI CHEMICZNEJa stąd: R -in" ‘ i(3.212)Występujące w ty
255 [1024x768] 262 PODSTAWY TERMODYNAMIKI CHEMICZNEJ 262 PODSTAWY TERMODYNAMIKI CHEMICZNEJ Tak
257 [1024x768] 264 PODSTAWY TERMODYNAMIKI CHEMICZNEJ obliczyć standardową zmianę entalpii reakcji CH
249 [1024x768] PODSTAWY TERMODYNAMIKI CHEMICZNEJ Skąd InGrot = MnT+const Wstawiając tę wartość do ró
PODSTAWY TERMODYNAMIKI CHEMICZNEJ skrypt do wykładów Maria Bełtowska-Brzezinska Wydział Chemii U
491 [1024x768] FOTOCHEMIA 501 przejściu cząsteczki z zerowego poziomu oscylacyjnego stanu wzbudzoneg
P3073592 Promieniowanie polega na przenoszeniu energii pop elektromagnetyczne. Fala padając na ośrod
2. Wynik egzaminu zdanego na poziomie dwujęzycznym jest przeliczany na wynik egzaminu na poziomie ro
więcej podobnych podstron