249 [1024x768]

PODSTAWY TERMODYNAMIKI CHEMICZNEJ
Skąd
InGrot = MnT+const
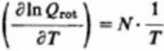
Wstawiając tę wartość do równania na energię wewnętrzną (3.202), otrzymujemy:
Ura 1,987 -298,15 - 592,4 cal • mol(2480• MPJ-kmoT1)
Rotacyjny udział w cieple molowym Cy obliczymy z pochodnej:
Ck(«k) - ) - * = 1.987cal -mol-'• dcg-‘(8.315 • 10JJ-kmo|-* deg-')
Wartość rotacyjnego udziału w entropii molowej otrzymujemy z równania (3.204)
(3.204)
Sr* - -S^+klnt?**
Z równania (3.203) mamy: 8»ra IkT
ln(?rot = Mn-p—
stąd
RT ... Sn2 IkT SroX = +^1° yjj
Wstawiając wartości stałych:
R - 1,987 cal - mol-1-deg"‘
* - 3,14
/= 2,70- lO'40 g • cm* k - 1.38- 10-1* erg -deg-‘ h - 6,62- lO"*7 erg -1
otrzymujemy = 7,241 cal • deg"‘(30,31 J-deg-1)
3. Oscylacyjna suma stanów. Dla znalezienia oscylacyjnej sumy stanów cząsteczki przyjmiemy upraszczające założenie, że energię oscylacji cząsteczk przedstawia równanie oscylatora harmonicznego:

W wyższych temperaturach należy jednakże uwzględnić anharmoniczność drgań. Sumę stanów można niekiedy obliczyć z doświadczalnych wartości energii poziomów oscylacyjnych. Ogólnie:
Wyszukiwarka
Podobne podstrony:
DSC03849 Z równania pierwszego Ir, = ccPn, - IR, Podstawiając tę wartość do równania drugiego otrzy
475 § 2. Prosta styczna i płaszczyzna styczna Podstawiając te wartości p i q do równania (10)
DSC03849 Z równania pierwszego Ir, = ccPn, - IR, Podstawiając tę wartość do równania drugiego otrzy
236 [1024x768] gdyż KLASYFIKACJA Wsławiając tc wartości do równania na entalpię swobodną mieszania,
221 [1024x768] 228 PODSTAWY TERMODYNAMIKI CHEMICZNEJWspółczynnik aktywności. Stany standardowe Warto
223 [1024x768] 230 PODSTAWY TERMODYNAMIKI CHEMICZNEJ 230 PODSTAWY TERMODYNAMIKI CHEMICZNEJ Stany STA
225 [1024x768] 232 PODSTAWY TERMODYNAMIK! CHEMICZNEJ Jeżeli dla reakcji zachodzącej w układach rzecz
229 [1024x768] 236 PODSTAWY TERMODYNAMIKI CHEMICZNEJ znać wartości cząstkowych molowych funkcji term
231 [1024x768] 238 PODSTAWY TERMODYNAMIKI CHEMICZNEJ które po uwzględnieniu (3.112) przyjmie
233 [1024x768] 240 PODSTAWY TERMODYNAMIKI CHEMICZNEJ Termin „roztwory pospolite” wyraża tutaj jedyni
239 [1024x768] 246 PODSTAWY TERMODYNAMIKI CHEMICZNEJ 246 PODSTAWY TERMODYNAMIKI
241 [1024x768] 248 PODSTAWY TERMODYNAMIKI CHEMICZNEJEntropia a prawdopodobieństwo termodynamiczne Ja
243 [1024x768] 250 PODSTAWY TERMODYNAMIKI CHEMICZNEJ oraz wyrażeniem na energię wewnętrzną (3.170) I
245 [1024x768] 252 PODSTAWY TERMODYNAMIKI CHEMICZNEJ 1. Traaslacyjna suma stanów. Aby obliczyć sumę
247 [1024x768] 254 PODSTAWY TERMODYNAMIKI CHEMICZNEJ wówczas: 254 PODSTAWY TERMODYNAMIKI CHEMICZNEJ
251 [1024x768] 258 PODSTAWY TERMODYNAMIKI CHEMICZNEJa stąd: R -in" ‘ i(3.212)Występujące w ty
253 [1024x768] 260 PODSTAWY TERMODYNAMIKI CHEMICZNEJ Energię poziomów elektronowych tlenu przeliczam
więcej podobnych podstron