243 [1024x768]

250 PODSTAWY TERMODYNAMIKI CHEMICZNEJ
oraz wyrażeniem na energię wewnętrzną (3.170)
III ZASADA TERMODYNAMIKI
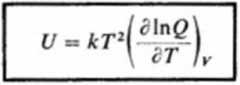
otrzymujemy:
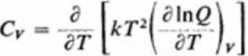
Bardziej szczegółową postać równania (3.179) otrzymamy przy omawianiu sum stanów dla poszczególnych rodzajów energii.
Obliczenie entropii molowej S. Entropia molowa S związana jest z ciepłem molowym za pomocą równości
T
s-s0 = [-?- ar
0
Po wstawieniu w to równanie wyrażenia na Cv (3.179), należy przeprowadzić całkowanie przez części:
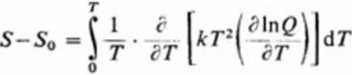
Ł/
7*
+&ln(2-fcln@<rf,o)
Ponieważ dla jednego mola czystej substancji w 0 K. wielka suma stanów wynosi zgodnie z równaniem (3.172)
/
(?(T.Oł- Xg| C'ł,,/łT mgo m 1 m
zatem
S0 = k\nQ = k ln£0 = 0 i ostatecznie
5-y+Arłn0
(3.180)
(3.181)
Równanie (3.180) jest w istocie statystycznym uzasadnieniem tzw. trzeciej zasady termodynamiki, wg której entropia wszystkich czystych substancji krystalicznych w temperaturze 0 K jest równa zeru.
Energię swobodną rozważanego układu otrzymamy z. zależności (3.37)
F — U—TS
Wyszukiwarka
Podobne podstrony:
221 [1024x768] 228 PODSTAWY TERMODYNAMIKI CHEMICZNEJWspółczynnik aktywności. Stany standardowe Warto
223 [1024x768] 230 PODSTAWY TERMODYNAMIKI CHEMICZNEJ 230 PODSTAWY TERMODYNAMIKI CHEMICZNEJ Stany STA
225 [1024x768] 232 PODSTAWY TERMODYNAMIK! CHEMICZNEJ Jeżeli dla reakcji zachodzącej w układach rzecz
229 [1024x768] 236 PODSTAWY TERMODYNAMIKI CHEMICZNEJ znać wartości cząstkowych molowych funkcji term
231 [1024x768] 238 PODSTAWY TERMODYNAMIKI CHEMICZNEJ które po uwzględnieniu (3.112) przyjmie
233 [1024x768] 240 PODSTAWY TERMODYNAMIKI CHEMICZNEJ Termin „roztwory pospolite” wyraża tutaj jedyni
239 [1024x768] 246 PODSTAWY TERMODYNAMIKI CHEMICZNEJ 246 PODSTAWY TERMODYNAMIKI
241 [1024x768] 248 PODSTAWY TERMODYNAMIKI CHEMICZNEJEntropia a prawdopodobieństwo termodynamiczne Ja
245 [1024x768] 252 PODSTAWY TERMODYNAMIKI CHEMICZNEJ 1. Traaslacyjna suma stanów. Aby obliczyć sumę
247 [1024x768] 254 PODSTAWY TERMODYNAMIKI CHEMICZNEJ wówczas: 254 PODSTAWY TERMODYNAMIKI CHEMICZNEJ
251 [1024x768] 258 PODSTAWY TERMODYNAMIKI CHEMICZNEJa stąd: R -in" ‘ i(3.212)Występujące w ty
253 [1024x768] 260 PODSTAWY TERMODYNAMIKI CHEMICZNEJ Energię poziomów elektronowych tlenu przeliczam
255 [1024x768] 262 PODSTAWY TERMODYNAMIKI CHEMICZNEJ 262 PODSTAWY TERMODYNAMIKI CHEMICZNEJ Tak
257 [1024x768] 264 PODSTAWY TERMODYNAMIKI CHEMICZNEJ obliczyć standardową zmianę entalpii reakcji CH
249 [1024x768] PODSTAWY TERMODYNAMIKI CHEMICZNEJ Skąd InGrot = MnT+const Wstawiając tę wartość do ró
PODSTAWY TERMODYNAMIKI CHEMICZNEJ skrypt do wykładów Maria Bełtowska-Brzezinska Wydział Chemii U
45069 skan0121 124 Termodynamika chemiczna NaCl(s) + i H2(g) ^ Na(s) + HCl(g), c) prężność parcjalną
skan0121 124 Termodynamika chemiczna NaCl(s) + i H2(g) ^ Na(s) + HCl(g), c) prężność parcjalną HCl w
skan0121 124 Termodynamika chemiczna NaCl(s) + i H2(g) ^ Na(s) + HCl(g), c) prężność parcjalną HCl w
więcej podobnych podstron