251 [1024x768]

258
PODSTAWY TERMODYNAMIKI CHEMICZNEJ
a stąd:
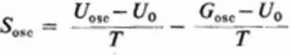
R
-in"''‘''i
Występujące w tym równaniu funkcje można znaleźć w tablicach.
Przykład
Obliczyć ciepło molowe acetylenu, w temp. 300 i 1000 K. w stałym ciśnieniu, na podstawie następujących częstości oscylacyjnych:
* (cm'1] wagi statystyczne 612 2
Dla każdej cząsteczki chemicznej, traktowanej jak gaz doskonały, mamy
Cp = Cy + R
Ciepło molowe Cy jest oczywiście sumą udziałów: translacyjncgo. rotacyjnego i oscylacyjnego. Z przeprowadzonych poprzednio obliczeń wynika, żc:
3
CV(lr> = — R
oraz
CV< roO = R
Pozostaje nam obliczenie udziału oscylacyjnego (równanie 3.210):
CV(o*c)
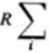
Xt t*< xf
(e*<-l)ł
Tabda 3.4
Wyniki obliczeń udziału oscylacyjnego w cieple molowym acetylenu
|
Xl |
: ! |
300 K |
1000 K | ||
|
r(cm ') |
X |
CV( MC) , |
X |
Ck(o.c) | |
|
2 |
612 |
2.93 |
2.03 |
0.88 |
3.72 |
|
> |
729 |
3.49 |
1.57 |
1.04 |
3.63 |
|
1 |
1973 |
9.46 |
0.01 |
2.83 |
1.06 |
|
1 |
3287 |
15.76 |
0.00 |
4.72 |
0.40 |
|
1 |
3372 |
16.17 |
0,00 |
4,85 |
0.37 |
Wyszukiwarka
Podobne podstrony:
221 [1024x768] 228 PODSTAWY TERMODYNAMIKI CHEMICZNEJWspółczynnik aktywności. Stany standardowe Warto
223 [1024x768] 230 PODSTAWY TERMODYNAMIKI CHEMICZNEJ 230 PODSTAWY TERMODYNAMIKI CHEMICZNEJ Stany STA
225 [1024x768] 232 PODSTAWY TERMODYNAMIK! CHEMICZNEJ Jeżeli dla reakcji zachodzącej w układach rzecz
229 [1024x768] 236 PODSTAWY TERMODYNAMIKI CHEMICZNEJ znać wartości cząstkowych molowych funkcji term
231 [1024x768] 238 PODSTAWY TERMODYNAMIKI CHEMICZNEJ które po uwzględnieniu (3.112) przyjmie
233 [1024x768] 240 PODSTAWY TERMODYNAMIKI CHEMICZNEJ Termin „roztwory pospolite” wyraża tutaj jedyni
239 [1024x768] 246 PODSTAWY TERMODYNAMIKI CHEMICZNEJ 246 PODSTAWY TERMODYNAMIKI
241 [1024x768] 248 PODSTAWY TERMODYNAMIKI CHEMICZNEJEntropia a prawdopodobieństwo termodynamiczne Ja
243 [1024x768] 250 PODSTAWY TERMODYNAMIKI CHEMICZNEJ oraz wyrażeniem na energię wewnętrzną (3.170) I
245 [1024x768] 252 PODSTAWY TERMODYNAMIKI CHEMICZNEJ 1. Traaslacyjna suma stanów. Aby obliczyć sumę
247 [1024x768] 254 PODSTAWY TERMODYNAMIKI CHEMICZNEJ wówczas: 254 PODSTAWY TERMODYNAMIKI CHEMICZNEJ
253 [1024x768] 260 PODSTAWY TERMODYNAMIKI CHEMICZNEJ Energię poziomów elektronowych tlenu przeliczam
255 [1024x768] 262 PODSTAWY TERMODYNAMIKI CHEMICZNEJ 262 PODSTAWY TERMODYNAMIKI CHEMICZNEJ Tak
257 [1024x768] 264 PODSTAWY TERMODYNAMIKI CHEMICZNEJ obliczyć standardową zmianę entalpii reakcji CH
242 [1024x768] I ELEMENTY TERMODYNAMIKI STATYSTYCZNEJ Stąd In W N{
249 [1024x768] PODSTAWY TERMODYNAMIKI CHEMICZNEJ Skąd InGrot = MnT+const Wstawiając tę wartość do ró
PODSTAWY TERMODYNAMIKI CHEMICZNEJ skrypt do wykładów Maria Bełtowska-Brzezinska Wydział Chemii U
417 [1024x768] 426 ELEKTROCHEMIA — IogA,). Występujące w tym równaniu stężenia wynoszą:
skan0099 102 Termodynamika chemiczna na podstawie standardowych entalpii tworzenia
więcej podobnych podstron