CIMG4094

oraz w małym stopniu są podatne na działanie nieswoistych inhibitorów replikacji, a to powinno być uwzględnione w technice pomiarów.
2. Drugą charakterystyczną cechę wirusów stanowi ich zdolność do zachowania w sprzyjających warunkach, przez dłuższy okres, żywotności poza organizmem gospodarza, np. w środowisku surowicy, pełnej krwi, płynów ustrojowych. A to właśnie wskazuje na niezbędność interwencji z pomocą dezynfektantów.
Prowadzone badania, ujawniające istotny wpływ środowiska na przeżywal-ność wirusów, wykazały m.in., że: wirus poliomyelitis w temp. 25°C zachowuje żywotność przez 6 tygodni, podobnie wirus krowianki. Wirusy Coxsackie w wodzie zanieczyszczonej odpadkami domowymi były aktywne przez 6 tygodni, w wodzie destylowanej przez 41 dni.
Zróżnicowanie we wrażliwości różnych wirusów na działanie dezynfektantów stawia konieczność doboru szczepów reprezentatywnych, których inak-tywacja w określonym czasie przez określony preparat dawałaby pewność skuteczności również w odniesieniu do innych wirusów, które w dezynfekowanym materiale mogą się znajdować. A więc dobór modelu wirusowego powinien być właściwy, uwzględniający elementy strukturalne wirusów, które mogą mieć krytyczne znaczenie w odniesieniu do wrażliwości lub oporności na preparaty dezynfekcyjne. Wiadomo, że u wirusów osłonkowych zawartość lipidów w osłonce ma istotny wpływ na ich wrażliwość na działanie związków chemicznych. Jest to spowodowane ich lipofilnością, czyli wrażliwością na rozpuszczalniki tłuszczowe. Z tego powodu wirusy osłonkowe zaliczono do grupy wirusów lipofilnych. W przeciwieństwie do nich, wirusy nie mające osłonki nazwano wirusami hydrofilnymi. Biorąc pod uwagę wspomniane cechy, rodziny wirusów podzielono na 4 grupy, w zależności od ich właściwości lipofilnych lub hydrofil-nych (ryc. 13).
Szczepy wirusowe stosowane w tych oznaczeniach powinny również spełniać następujące wymagania:
1) nie powinny stanowić dużego zagrożenia dla personelu laboratoryjnego,
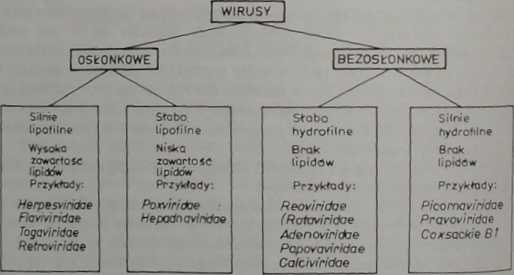
Ryc. 13. Podział wirusów z uwagi na ich właściwości lipofilne względnie hydrofilne (wg: B. Lii*1 ska, A. Biesi ad ecka, 1993).
2) powinny należeć do dobrze poznanej i zdefiniowanej rodziny wirusów,
3) powinny być stabilne i osiągać wysokie miana infekcyjne w hodowli komórkowej.
Podstawową zasadą określania aktywności wirusobójczej preparatów dezynfekcyjnych jest inkubacja wirusa z badanym preparatem, a następnie oznaczenie miana zakaźnego w hodowli komórkowej i porównanie z mianem wirusa kontrolnego. Właściwe badanie musi być jednak poprzedzone określeniem cytotoksyczności preparatu dezynfekcyjnego dla hodowli tkankowej.
Z uwagi na fakt, że obecność białka znacznie obniża skuteczność preparatów dezynfekcyjnych, badania ich aktywności wirusobójczej muszą być przeprowadzone z zastosowaniem obciążenia białkowego.
Metoda badania oraz kryterium (przyjęte przez Zakład Wirusologii PZH), jako wskaźnik wirusobójczej aktywności preparatów dezynfekcyjnych, zostały w dużej mierze oparte na zaleceniach Europejskiego Komitetu do Spraw Standaryzacji. Przyjęto następujące postępowanie:
Szczepy wirusowe
W oznaczeniach aktywności wirusobójczej preparatów dezynfekcyjnych stosowane są następujące wirusy i szczepy wirusowe:
- wirus poliomyelitis typu 1, szczep Lsc2ab (jest to szczep atenuowany, co jest istotne również ze względów bezpieczeństwa),
- adenowirus typu 2 lub 6,
- wirus Herpes simplex typu 1 (HSV-1), szczep Mclntyre (szczep powszechnie akceptowany jako standard laboratoryjny).
Miano zakaźne wirusa powinno wynosić ok. 108,0 TCID^ml lub więcej. Jeżeli miano wirusa jest zbyt niskie, należy go zagęścić przez wirowanie zawiesiny w ultrawirówce przez co najmniej 30 min przy 70 000 x g w temp. +4°C. Po odwirowaniu osad należy zawiesić w podłożu utrzymującym w objętości 10-krotnie niższej od objętości wyjściowej.
Wirus poliomyelitis i adenowirus namnażane są w hodowli Hep-2, natomiast HSV-1 w hodowli CV-1.
Hodowle komórkowe
- linia ciągła CV-1, wyprowadzona z nerki małpiej,
- linia ciągła Hep-2, wyprowadzona z ludzkich komórek nowotworowych raka krtani.
Podłoża hodowlane
- płyn wzrostowy: podłoże Eagle’a z dodatkiem 10% płodowej surowicy cielęcej, 3% L-glutaminy w ilości 5 ml/500 ml płynu oraz antybiotyków (penicylina - 48 000 j., streptomycyna - 40 mg na 500 ml płynu),
1 płyn utrzymujący: podłoże Eagle’a z dodatkiem antybiotyków w ilości jak wyżej.
Z uwagi na fakt, że badania aktywności wirusobójczej preparatów dezynfekcyjnych wykonywane są w hodowlach komórkowych, należy przed przystąpieniem do właściwych oznaczeń określić toksyczność badanego preparatu dla komórek. Celem tego oznaczenia jest wyeliminowanie toksycznego działania dezynfektanta od jego aktywności wirusobójczej.
61
Wyszukiwarka
Podobne podstrony:
W leczeniu szczególną uwagę zwraca się na rozwój psychoruchowy i mchowy. Pobudzanie to powinno być b
Zakład Biotechnologii i Inżynierii Genetycznej SUM, 2015/16 Wina są podatne na rozwój chorób wywołan
• Atomy i cząsteczki są wystawione na działanie promieniowania słonecznego o pełnym
Zmiana koloru Ulęgają karolenoidy i chlorofile, które są podatne na zmiany oksydacyjne. Na stabilnoś
nr4 (3) i u dzieci w wieku przedszkolnym, powodują, że przedszkolaki są podatne na uczenie się
• szacunki wyniku oraz skutki finansowe są dokonywane na drodze osądu
Informacje o loterii oraz regulamin dostępne są w internecie na stronach serwisu
Skorzystaj z rabatu:-1000 zł na studia E oraz II stopnia; - 500 zł na studia podyplomowe--10% rabatu
70460 nr4 (3) i u dzieci w wieku przedszkolnym, powodują, że przedszkolaki są podatne na uczenie się
Praca ta ma na celu zbadanie, jakie grupy społeczne najczęściej są podatne na tego rodzaju nowopowst
• Autobiograficzne zeznania są wyraźnie nietrwale. Te nietrwalości są podatne na
PUNKT oddzielając od nich dajmony, aby były mniej podatne na działanie Pyłu. Zazwyczaj taka operacja
Spoiny są odporne na działanie wysokiej temperatury i jej zmiany, nie szkodzi im duża wilgotność wzg
PICT0008 (5) 61. Cefalosporyny II generacji: A- są wrażliwe na działanie p-Iaktama
DSCN5647 (2) Rośliny wykazujące tolerancję, oczywiście są podatne na patogena, jednak nie są przez n
DSCF8318 ■ Pozostałe przychody operacyjne są osiągane na działalności o charakterze innym niż
nr4 (3) i u dzieci w wieku przedszkolnym, powodują, że przedszkolaki są podatne na uczenie się
więcej podobnych podstron