DSCN6185 (Kopiowanie)
OlOlOgia - n/ieiyn
Ale dlaczego w takim razie oba procesy w przyrodzie nie zachodzą zupełnie spontanicznie) Sproszkowana glukoza przecież całymi latami może leżeć w otwartej cukiernicy i nie rozpadnie^ na H,0 i CO,. Szklanka wody sodowej (przesyconej C02) wystawiona nawet na kilkadziesiąt godzin naświetlania promieniami słonecznymi nie stanie się źródłem glukozy (o ile nie rozwiną się w niej rośliny). Żeby to zrozumieć, musimy zatrzymać się na chwilą nad pojęciem energii aktywaęjj.
Zgodnie z naszymi dzisiejszymi wyobrażeniami wszystkie cząsteczki są w ruchu, a więc posiadają pewną energię kinetyczną. Ruch olbrzymiej liczby cząsteczek w określonej przestrzeni powoduje ich ciągłe wzajemne zderzanie się. Cząstki o małej energii kinetycznej odbijają się od siebie jak piłki; Jednak silne zderzenie cząstek o bardzo dużej energii może spowodować swego rodzaju „katastrofę”, może sprawić, że siły spajające dotąd cząsteczki zostaną rozerwane i tym samym powstaną warunki do wytworzenia nowego układu sił. Reagujące cząstki muszą jednak posiadać dużą energię kinetyczną.
Najmniejszą ilość energii kinetycznej, jaką cząstka musi posiadać, aby jej zderzenie z inną cząstką spowodowało powstanie nowego układu, nazywamy energią aktywacji
Czasem o możliwości powstania nowego układu decyduje sposób zderzenia cząstek. Jak to pokazano na ryc. 5-6, dwie cząsteczki o przeciętnej energii kinetycznej mogą w wyniku zderzenia wytworzyć nowy związek, jeżeli zderzą się odpowiednimi „miejscami”.


ZHI —►2H+2I
Ryc. 5-6. Reakcja rozpadu jodowodoru według podanego zapisu zachodzi dość łatwo, gdy cząsteczki jodowodoru zderzą się w takim ustawieniu, jak na rys. a. Natomiast molekuły o takiej samej energii kinetycznej, zderzające się inaczej (np. tak jak na rys. b) nie powodują reakcji chemicznej. Dla efektywnego zderzenia w ten sposób, jak na rys. b cząsteczki musiałyby mieć wielokrotnie większą energię kinetyczną.
We wciąż omawianej przez nas reakcji:
CH„0+60, |=ł 6CO- + 6H.O
zachodzą procesy redukcji i utleniania. Redukcja to przyłączenie elektronu przez atom lub cząsteczkę utlenianiem nazywamy proces oddania elektronu. W przyrodzie oba te procesy są sprzężone, tzn. zawsze zachodzą razem (jeden składnik się utlenia, drugi redukuje). W przytoczonym równaniu tlen jest utlaniaczem - utlenia węglowodan do dwutlenku węgla, sam zaś redukuje się do cząsteczek wody. Aby odebrać elektrony tlen musi zatem „zaatakować” glukozę, czyli włożyć pewną energię (właśnie energię aktywacji) w rozbicie jej struktury. Jeżeli zderzenie jest efektywne, to układ ulega przegrupowaniu, co z kolei powoduje wyzwolenie energii. Przebieg tego procesu w czasie przedstawia wykres na ryc. 5-7.
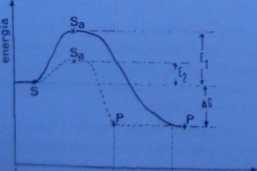
czas
Ryc. 5-7. Przebieg reakcji chemicznej bez katalizatora (lida ciągła) i w obecności katalizatora (linia przerywana1 S - substrat; S_ - substrat aktywowany: P - produkt: E, - energia aktywacji bez katalizatora; E, - energia aktyw*!1 w obecności katalizatora; ACi - przyrost energii swobodno układu; T,- T0 - czas przebiegu reakcji boz katalizatora
Wyszukiwarka
Podobne podstrony:
DSCN6185 (Kopiowanie) Biologia - uum* nu unUiwmif mnfyrtą. Ale dlaczego w takim ra
473916238fb6936b 4» zdrowie MASZ 20-30 LAT? W TAKIM RAZIE OSTEOPOROZA NAJPEWNIEJ CIĘ NIE DOTYCZ
Photo0025 ale bez... ale bez... ale bes... (w takim razie) poproszę to (v tom pfipade) si dam toto (
FizykaII498�01 494 ZN i NZ stają się w takim razie w miarę tęgo coraz słabszemi i przy zupełnej równ
DSCN0579 W takim razie dlaczego las tropikalny jest tak bujny i bogaty w gatunki?
DSCN6104 (Kopiowanie) Biologia - repetytorium dla kandydatów na akademie Oba tc stwierdzenia porusza
P1170385 70 UTOPIA IRZYKOWSKIEGO biciem obecnej rzeczywistości, w takim razie nie wynika z tego, że
DSCN0579 W takim razie dlaczego las tropikalny jest tak bujny i bogaty w gatunki?
W takim razie bierzemy pie-od babci, ale tak mała ilość może nie wystarczyć. Pro żebyśmy wzięli
img063 (38) ba ta by ta przypadkowa, gdyż w takim razie krzemień pękłby przez catą szerokość, a nie
więcej podobnych podstron