41965

Strukturo warstwy adsorpcyjnej
cenią powierzchni cząsteczkami znajdującymi się w pobliżu granicy faz. Te procesy wysycenia, którym towarzyszy gromadzenie się substancji, nazywamy ogólnie sorpcją. Sorpcję powierzchniową określa się jako adsorpcję.
Najprostszy i najlepiej poznany jest proces adsorpcji na powierzchni swobodnej cieczy, przede wszystkim na powierzchni wody. Dodatek substancji obcych do wody powoduje większe lub mniejsze zmiany napięcia powierzchniowego. Substancje znacznie zmieniające napięcie po-wierzclmiowe już w minimalnych stężeniach nazywamy powierzchniowo czynnymi.
Bardzo ważnym równaniem dotyczącym adsorpcji jest równanie izotermy adsorpcji Gibbsa.
p___c do mol "I
RT dc [ m2 \
gdzie: r - powierzchniowe stężenie składnika zaadsorbowanego c - stężenie składnika a - napięcie powierzchniowe R - uniwersalna stała gazowa T - temperatura
Równanie Gibbsa wiąże nadmiar powierzchniowy roztworu r ze zmianą napięcia powierzchniowego <xprzy zmianie stężenia c substancji rozpuszczonej. Z równania tego można wyciągnąć następujące wnioski:
1. Jeżeli substancja rozpuszczona ze wzrostem jej stężenia obniża napięcie powierzchniowe roztworu (substancja powierzchniowo czynna), to:
da \
— <0 i r>o
dc
Substancja powierzchniowo czynna gromadzi się w fazie powierzchniowej - mamy do czynienia z adsorpcją dodatnią.
2. Jeżeli substancja rozpuszczona ze wzrostem jej stężenia podwyższa napięcie powierzcliniowe roztworu, to:
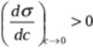
r<o
Substancja ta unika fazy powierzclmiowej - mamy w tym przypadku do czynienia z adsorpcją ujemną.
3. Jeżeli substancja rozpuszczona nie zmienia napięcia powierzchniowego roztworu, to:

Stężenie fazy powierzchniowej jest wówczas takie samo jak reszty roztworu - brak adsorpcji.
2. Obliczenia
Obliczam napięcie powierzchniowe korzystając z równania:
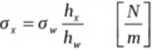
2
Wyszukiwarka
Podobne podstrony:
19413 Zdjęcie0272 (5) W warstwie powierzchniowej nabłonku znajdują się duże komórki (o średnicy ok.
Jest on zbudowany z ceramicznego nośnika (typu monolit), na powierzchni którego znajduje się warstwa
stosunkowo małej cząsteczce znajdują się aż cztery grupy funkcyjne oraz dwa węgle stereogeniczne, te
25 (72) Rys.3.11. Struktura sumatora szeregowego » rejestrach R1 I R2 znajdują się dwie liczby, któ
Ciała stałe .tałe - atomy (lub cząsteczki) znajdują się w ustalonych pozycjach względem
DSC00056 (31) Napisz wzorami strukturalnymi (zaznacz ewentualny udział koenzymów): )C nukleotyd znaj
1. WPROWADZENIE Cząsteczki znajdujące się w głębi cieczy podlegają, symetrycznie z
Budowa stawu W sldad każdego stawu wchodzą; 1. powierzchnie stawowe - znajdują się na kościach w mie
CB i rad 063 63 IV. PODSTAWY RADIOKOMUNIKACJI Na wysokości 100 km nad powierzchnią Ziemi znajduje s
CCF20091019�000 (2) 72 ► Rys. 7. Zasada pomiaru udarności z krabem wg Izoda Górna powierzchnia szczę
2 (503) 2012-03-06 Polimery to związki wielkocząsteczkowe (w cząsteczce znajduje się przynajmniej 20
prawo archimedesaa 1 jpeg 5. Prawo Archimedesa Pod powierzchnią cieczy znajduje się ciało w kształci
Zdjecie0384 W zbiorniku o głębokości napełnienia 10 [dm], ponad powierzchnią wody znajduje się sztyw
jest obecność warstwy wody na powierzchni, która wykazuje się wysokim tłumieniem oraz zakłóca pomiar
Image0046 Obecność tego czerwonego granitu dowodzi, że pod powierzchnią płaskowyżu znajduj
11 d. Zestawienie powierzchni lasów znajdujących się w zasięgu terytorialnym Nadleśnictwa z
12 Wzór Nr 7. Zestawienie powierzchni lasów znajdujących się w terytorialnym zasięgu
więcej podobnych podstron