105727
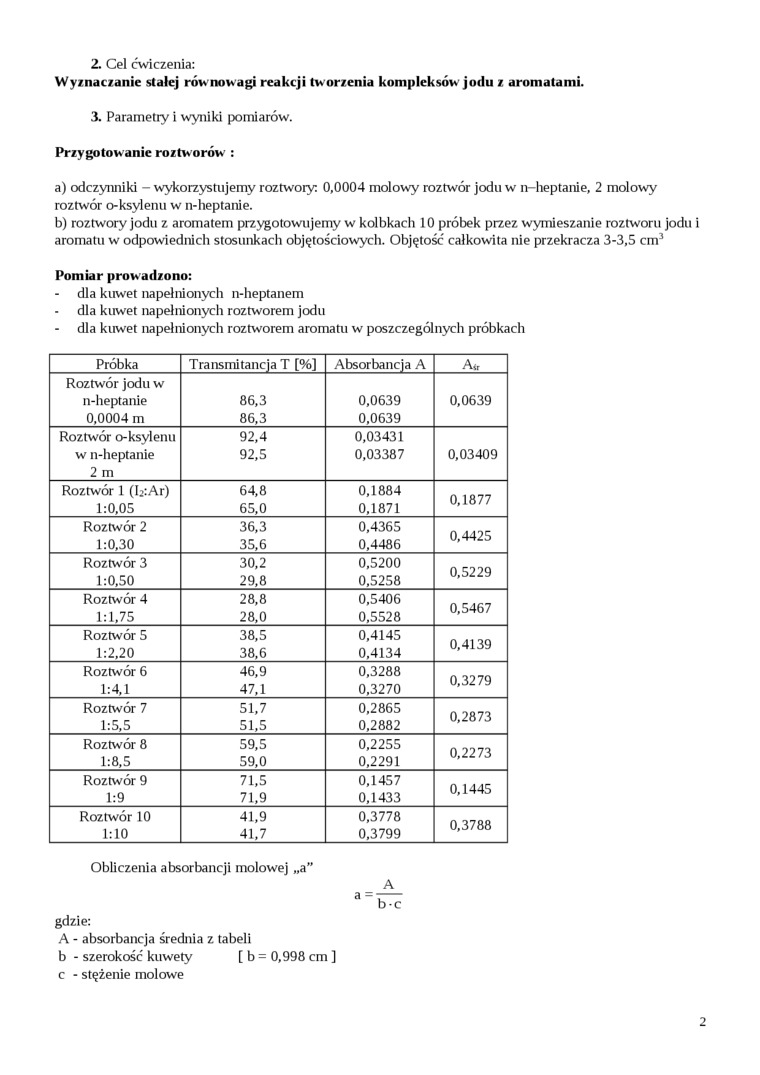
2. Cel ćwiczenia:
Wyznaczanie stałej równowagi reakcji tw orzenia kompleksów jodu z aromatami.
3. Parametiy i wyniki pomiarów.
Przygotowanie roztworów :
a) odczynniki - wykorzystujemy roztwory: 0,0004 molowy roztwór jodu w n-heptanie, 2 molowy roztwór o-ksylenu w n-heptanie.
b) roztwory jodu z aromatem przygotowujemy w kolbkach 10 próbek przez wymieszanie roztworu jodu i aromatu w odpowiednich stosunkach objętościowych. Objętość całkowita nie przekracza 3-3,5 cm3
Pomiar prowadzono:
- dla kuwet napełnionych n-heptanem dla kuwet napełnionych roztworem jodu
- dla kuwet napełnionych roztworem aromatu w poszczególnych próbkach
|
Próbka |
Transmitancja T [%] |
Absorbancja A |
Air |
|
Roztwór jodu w | |||
|
n-heptanie |
86,3 |
0,0639 |
0,0639 |
|
0,0004 m |
86,3 |
0,0639 | |
|
Roztwór o-ksylenu |
92,4 |
0,03431 | |
|
w n-heptanie |
92,5 |
0,03387 |
0,03409 |
|
2 m | |||
|
Roztwór 1 (b:Ar) |
64,8 |
0,1884 |
0,1877 |
|
1:0,05 |
65,0 |
0,1871 | |
|
Roztwór 2 |
36,3 |
0,4365 |
0,4425 |
|
1:0,30 |
35,6 |
0,4486 | |
|
Roztwór 3 |
30,2 |
0,5200 |
0,5229 |
|
1:0,50 |
29,8 |
0,5258 | |
|
Roztwór 4 |
28,8 |
0,5406 |
0,5467 |
|
1:1,75 |
28,0 |
0,5528 | |
|
Roztwór 5 |
38,5 |
0,4145 |
0,4139 |
|
1:2,20 |
38,6 |
0,4134 | |
|
Roztwór 6 |
46,9 |
0,3288 |
0,3279 |
|
1:4,1 |
47,1 |
0,3270 | |
|
Roztwór 7 |
51,7 |
0,2865 |
0,2873 |
|
1:5,5 |
51,5 |
0,2882 | |
|
Roztwór 8 |
59,5 |
0,2255 |
0,2273 |
|
1:8,5 |
59,0 |
0,2291 | |
|
Roztwór 9 |
71,5 |
0,1457 |
0,1445 |
|
1:9 |
71,9 |
0,1433 | |
|
Roztwór 10 |
41,9 |
0,3778 |
0,3788 |
|
1:10 |
41,7 |
0,3799 |
A
a"b-c
Obliczenia absorbancji molowej „a”
gdzie:
A - absorbancja średnia z tabeli b - szerokość kuwety [ b = 0,998 cm ]
c - stężenie molowe
2
Wyszukiwarka
Podobne podstrony:
2. Cel ćwiczenia Celem ćwiczenia jest wyznaczenie stałej równowagi reakcji I2 + / =/j w roztworze wo
Wyznaczanie stałej równowagi reakcji I2 +l~ = /3 metodą podziału K aCr,C», Cr , zatem Ko=Kr. Jeżeli
CCF20131104�006 2. CZĘŚĆ DOŚWIADCZALNA Celem ćwiczenia jest wyznaczenie stałej szybkości reakcji inw
Sprawozdanie z ćwiczenia: Wyznaczanie stałej reakcji h +l~
Wyznaczani* stahj równowagi reakcji /2 + / = /, metoda podziału Jeżeli faza wodna, w której ustala
- 7 - 3.10. Wyznaozenie stałej równowagi reakcji chemicznej w fazie ciekłej .................. 384 3
terma2kolos grupa A 1 !k /yć, iłokrotnic zmieni się wartość ciśnieniowej stałej równowagi reakcji
SPRAWOZDANIE Z LABORATORIUM FIZYKI 3.1 Numer ćwiczenia 48 Temat ćwiczenia Wyznaczanie stałej
DSC00602 Sprawozdanie ćw. 6-1:Wyznaczanie stałej szybkości reakcji pierwszego rzędu. Wyznaczanie sta
DSC00607 Graficzne wyznaczenie stałej szybkości reakcji K X
Laboratorium biochemiiKinetyka enzymatyczna I (ćw. A)1. Cel ćwiczenia S Wyznaczeni
DSC06053 1. Cel ćwiczenia Wyznaczenie momentu dipolowego substacji w stanie wzbudzonym metodą
52532 skan0227 230 Kinetyka chemiczna Stężenie rodnika [CH3] wynika ze stałej równowagi reakcji (a)
więcej podobnych podstron