89824

Reakcje E2 zachodzą pod wpływem silnej zasady. Odrywa ona proton z atomu węgla w pozycji P, czyli z atomu sąsiadującego z atomem C, do którego przyłączona jest grupa odchodząca:
*-
EtO
/C=C\
/u
— —rC—C— —
P | • o
Śr 8*
stan przejściowy reakcji K2
W stanie przejściowym. który' zaistniał w wyniku ataku zasady (EtO ) na atom wodoru związany z Cp następuje rozluźnienie wiązania pomiędzy H-Cp i C«-Br oraz utworzenie częściowo podwójnego wiązania pomiędzy C0-Cp.
Warto zwrócić uwagę, że proton jest odrywany z pozycji trans w stosunku do grupy odchodzącej.
Energia stanu przejściowego decyduje o produkcie eliminacji i racjonalnie tłumaczy regułę Zajcewa. W reakcji 2-bromo-2-metylobutanu z etanolanem sodu jest możliwość utworzenia dwóch struktur stanu przejściowego, w wyniku ataku zasady na proton przy CI lub C3:
EtO'
H,C H^-OEt
I I
ch3ch2c—ch2
A B
|
8' | ||
|
EtO—y (pH3 |
H3C H -OEt | |
|
h3c—c^c—ch3 3 13 : 2 1 J |
I CHaCHjC—CH2 | |
|
H Br g |
6- Br |
ch3ch2N h3c// 2
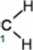
Rys. I. Schemat reakcji eliminacji typu E2. Preferowane jest tworzenie się alkenu bardziej rozgałęzionego, zgodnie z regułą Zajcewa. ponieważ stan przejściowy A jest stabilizowany przez 3 grupy alkilowe, a B tylko przez dwie
Osiągnięcie stanu przejściowego B wymaga większej energii aktywacji, jest więc mniej prawdopodobne.
Wyszukiwarka
Podobne podstrony:
6 (1375) Literatura 179 Podobna reakcja zachodzi pod wpływem tlenku propylenu. Powstałe substancje c
MATERIAŁY PROMIENIOCZULE Fotochemia - dział chemii zajmujący się reakcjami zachodzącymi pod wpływem
Slajd80 SZKODLIWY WPŁYW ULTRADZIĘKÓW Tkanka nerwowa ulega nieodwracalnemu uszkodzeniu pod wpływem si
22727 PICT0094 (9) wyboczenla Wachy, zachodzącego pod wpływem ściskających naprężeń obwodowych wówca
IMAG0067 (6) UWODNIENIE 4. Uwodnienie / hydroliza! Rozpad minerałów zachodzi pod w
CCF20081202�044 Mikrobiologiczny rozkład tłuszczów zachodzi pod wpływem rn zymów zwanych lipazami wy
9 (570) Smog fotochemiczny (kaiifomiigkgy utleniający) powstaje w wyniku reakcji chemicznych zachodz
lab7 3 Niektóre niezbędne wzory i użyteczne stałe Ruch harmoniczny zachodzi pod wpływem siły F propo
RSCN5911 Rozkład tłuszczów Mikrobiologiczny rozkład tłuszczów zachodzi pod wpływem enzymów zwanych
Procgsy chemiczne zachodzą pod wpływem czynników fizykochemicznych tien atmosferyczny,
domi11 7Reakcje wstępne: 1. reakcje pod wpływem 2mol/l HC1 lub lmol/1 H2S04 - kwasy nie utleniające
Fotostarzenie To zmiany mikro* i makroskopowe skóry, które zachodzą pod wpływem promieniowania U V I
larsen0097 5. Opioidy 97 nic do wielkości główki od szpilki, które jednak pod wpływem silnej hipoksj
więcej podobnych podstron