2150625899
Ćwiczenie nr 3
Wyznaczenie ciepła spalania
Wyznaczanie ciepła spalania związków ciekłych i stałych w warunkach stałej objętości przeprowadza się metodą kalorymetryczną, w tzw. bombie kalorymetrycznej. Pomiaru efektu cieplnego dokonuje się w przyrządzie zwanym kalorymetrem.
Bomba kalorymetryczna jest jednym z najbardziej precyzyjnych przyrządów używanych do pomiarów fizykochemicznych. Stosowana jest od 1881 r., w którym M. Berthelot zaproponował używanie szczelnie zamkniętego cylindra, napełnionego tlenem pod ciśnieniem około 1 bar do mierzenia ciepła spalania substancji organicznych. Bomba kalorymetryczna umożliwia wyznaczanie ciepła spalania substancji zawierających pierwiastki: C, H, O, N z dokładnością do 0,03%. Spalając substancje zakłada się, że jedynymi produktami spalania są: CO2, H2O i N2. Na powstający w niewielkich ilościach kwas azotowy wprowadza się poprawkę - z tym, że po jej wprowadzeniu otrzymane ciepło spalania odpowiada takiemu schematowi spalania, jak podano, tzn. że produktem spalania jest wolny N2.
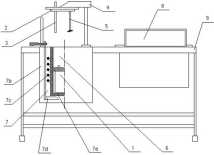
1 bomba kalorymetryczna
2 pokrywa kalorymetru
3 czujnik temperatury
4 uchwyt pokrywy z napędem mieszadła mechanicznego
5 mieszadło mechaniczne
6 naczynie kalorymetryczne
7 płaszcz kalorymetru składający się z:
7a ścianki wewnętrznej 7b ścianki zewnętrznej 7c wężownicy 7d mieszadła ręcznego
8 pulpit sterujący kalorymetru
9 stół kalorymetru z płyta czołowa zawierająca gniazda przyłączeniowe i wyjście czujnika temperatury
Rys. 13. Budowa kalorymetru
Każdy pomiar kalorymetryczny można podzielić na trzy okresy czasowe. Właściwy pomiar temperatury podczas wyznaczania ciepła spalania dzieli się na trzy okresy, w których dokonuje się regularnych (zwykle co minutę lub co pół minuty) odczytów temperatury wody w kalorymetrze:
1) okres początkowy (P), w którym dokonuje się kontroli wymiany ciepła między naczyniem kalorymetrycznym a płaszczem wodnym i otoczeniem przed spaleniem próbki (k+1 odczytów).
W okresie tym obserwuje się w przybliżeniu liniowy wzrost lub spadek temperatury (w zależności od tego, czy początkowa temperatura wody w naczyniu jest mniejsza lub większa od temperatury płaszcza wodnego).
2) okres główny (G), w którym następuje spalenie próbki, wydzielenie się ciepła i przekazanie go do układu kalorymetrycznego oraz wyrównanie temperatur (n odczytów). Należy pamiętać, że w okresie głównym nie ustaje wymiana ciepła z otoczeniem.
3) okres końcowy (K), spełniający ten sam cel co początkowy, ale w warunkach zakończenia pomiaru
(m odczytów). Aby móc wyodrębnić okres główny, w okresie końcowym powinno obserwować się w przybliżeniu liniowy spadek temperatury - czyli temperatura wody w płaszczu powinna być mniejsza niż pierwsza temperatura w okresie końcowym.
16
Wyszukiwarka
Podobne podstrony:
skanuj0000 (16) WYTRZYMAŁOŚĆ MATERIAŁÓW ĆWICZENIA LABORATORYJNE ĆWICZENIE NR 2 WYZNACZANIE WIODUŁU
Ćwiczenie nr 5 WYZNACZANIE CIĘŻARU CZĄSTECZKOWEGO MAKROCZĄSTECZEK Z POMIARU LEPKOŚCI ROZTWORU
PC200011 ĆWICZENIE Nr Wyznaczanie krzywej umocnienia 1. Cel ćwiczenia Celem ćwicze
Ćwiczenie nr 1 1. Wyznaczyć rzuty (poziomy i pionowy) budynku przedstawionego w rz
MECHANIKA PŁYNÓW LABORATORIUM Ćwiczenie nr 6 Wyznaczanie współczynnika wydatku przelewu Celem
(18) Ćwiczenie nr 7 Wyznaczanie przyspieszenia ziemskiego za pomocą wahadła matemahn 1. Wiadomości o
26014 zadaania lapka Wymiana Ciepła I, ćwiczenia nr 2 (przewodzenie ciepła, pręty, żebra) W stanie u
10647246D1468812674129s07840358064871734 n TMM EGZAMIN 1 wersja 1 azwisko studenta Grupa ćwiczeniowa
SPIS TREŚCI Ćwiczenie nr 1.1. Wyznaczanie stężeń roztworów za pomocą refraktometru i
ZAGADNIENIA DO ĆWICZEŃ Z OPTYKI Ćwiczenie nr 1.1. Wyznaczanie stężeń roztworów za pomocą refraktomet
S6301909 2 Ćwiczenie nr 4 WYZNACZANIE ROZMIARÓW CZĄSTECZKI KWASU TŁUSZCZOWEGO METODĄ ^NOWARSIWY ?
12872 skanuj0001 (331) WYTRZYMAŁOŚĆ MATERIAŁÓW ĆWICZENIA LABORATORYJNE" ĆWICZENIE NR 2 WYZNACZA
więcej podobnych podstron