2906542518
[3] PARAMETRY KINETYCZNE REAKCJI 121
produkt wytwarza się w drugim etapie reakcji określonym przez stałą szybkości k+2, a szybkość reakcji wyrażona zużyciem substratu w czasie określona jest wzorem:
(I.l) v = ^£^!=kł![EA],
Chwilowe stężenie kompleksu EA determinujące szybkość reakcji przebiegającej wedle schematu 1 wyraża się różnicą szybkości jego tworzenia i rozkładu. Mając na względzie równanie zachowania masy,
(1.2) ([E]0-[EA]) + [EA] = [E]0
szybkość zmian stężenia kompleksu EA przedstawić można równaniem,
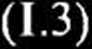
[[ĘĄ]
dt
= k+1 ([Ejo - [EA]) [A]-k_x [EA] - k+2 [EA],
skąd otrzymujemy, że:
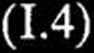

k+1 [E]o[A] — d[EA]/dt k+i[A] + k_! + k+2
W pierwszej, prestacjonarnej fazie reakcji stężenie kompleksu EA w mieszaninie inkubacyjnej szybko wzrasta, stąd wzór określający jego stężenie, otrzymany po scałkowaniu równania (1.3.) ma następującą postać:
fi 51
fEAl = -
k+1[E]0[A] {1 -exp[-(k+![A] + k., + k+2)t]}
k+i [A] + k_i + k+2
Po podstawieniu powyższego do zależności 1.1. otrzymujemy równanie szybkości enzymatycznej w fazie prestacjonarnej:
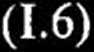
V[A] (1 — exp[ — (k+1[A] + k_Ł -f k+2)t]}
k + k ■>
gdzie Km = ---- określa tzw. stałą Michaelisa, a V = k+2[E]0 szybkość
k+i
maksymalną reakcji.
Zgodnie z założeniami Briggsa i IIaldane’a po krótkim czasie odpowiadającym fazie prestacjonarnej w mieszaninie inkubacyjnej dochodzi do ustalenia się tzw. stanu równowagi dynamicznej (steady State). W stanie równowagi dynamicznej chwilowe zmiany stężenia kompleksu enzym— substrat są tak niewielkie, że wobec dużej szybkości tworzenia tego kompleksu uznać je można za nieistotne (k+1[E]„[A] >>d[EA]/dt) i popełniając niewielki błąd przyjąć za stałe, tzn. d[EA]/dt = 0. W tej sytuacji wyrażenie w liczniku we wzorze (1.4.) upraszcza się a równanie szybkości reakcji enzymatycznej w fazie stacjonarnej przyjmie postać:

v
k+ik+2[E]o[A]
k+i [A] + k_i + k+2
V[A]
Km + [A]
Wyszukiwarka
Podobne podstrony:
[3] PARAMETRY KINETYCZNE REAKCJI 121 produkt wytwarza się w drugim etapie reakcji określonym pr
113] PARAMETRY KINETYCZNE REAKCJI 131 w którym zakładamy, że wytworzony w czasie reakcji produk
[5] PARAMETRY KINETYCZNE REAKCJI 123 badaniu zwykłych, niekatalizowanych reakcji chemicznych na
7] PARAMETRY KINETYCZNE REAKCJI 125 t Ryc. 3. Wyznaczanie stałej Michaelisa (Km) i szybkości
[9] PARAMETRY KINETYCZNE REAKCJI 127 mi podali Klesow i Berezin (12). Jeżeli D jest dowolnym,
PARAMETRY KINETYCZNE REAKCJI 129 Tabela 1 Porównanie dokładności obliczeń wartości stałej
[151 PARAMETRY KINETYCZNE REAKCJI 133 kreślonych dla różnych wartości [A]0, spełniające warunek
[19] PARAMETRY KINETYCZNE REAKCJI 137 im równania szybkości reakcji bardzo często mają postać
[21] PARAMETRY KINETYCZNE REAKCJI 139 5. Balcolm J. K., Fitch W. M., (1970),
Post. Biochem., 25. 119—139 (1979) KRYSTIAN KALETHA 1>Wyznaczanie parametrów kinetycznych reakcji
[5] PARAMETRY KINETYCZNE REAKCJI 123 badaniu zwykłych, niekatalizowanych reakcji chemicznych na
więcej podobnych podstron