3855990602
194."
CHIMIE ORGANigUE


CłlENDOBPBR O. et Ofenheimer E. %Sit-zungsberichle Akad. Wiss. Witn (II 6), i942, 151, 83-93). — En condensant la benzolne 8vec le bromo-6*hydroxy-2-naphtalćne dans SO«H, k "3 0/0 ć 160®-170°, on oblient la brono -4'- diphinyl-2.3 • bento -4.S- coumarone (I), F. 150°. II se formę cormne produit secondaire une petite quantitć d’un composć CMHi.O,Br, F. 280°, qui rćsultc de la con-densation d’une molćcule de bromo-6-hy-droxy-2-naphtalćne avec 2 molćcules de benzi.ine. L’oxydation de I par CrO, donnę le broma-6-benzoyloxy-2-benzoyl-l-naphtaline F. 141°. La saponiflcalion de ce composć donnę le bromo-o-hydroxy-2-benzoyl-1 -na ph-talćne. En traitant I en solutłon dans (XI* par Br,, on obtient la dibromo-6.4‘-di phiny l-2.3-benz/>-4.5-coumarone, V. 194°,5 qui oxydće par CrO, donnę le dibromo-4.6-benzoylozy-2-oenzoyl-l-naphialine, F. 145°,5. La saponifl-cation de ce demier composć donnę le dibromo-4.6-hydroxy -2- benzoyl-1- naphtalene, F. 191° [diriui acilyli, F. 123®,5). En traitant I en solution acćtique par NO,H concentrć, on obtient la bromo-4-nilra-6-diphinyl-2.3-benzo-4 5-coumarone, F. 185°,5 uui oxydće par CrO* donnę le bromo-$-nilro-4-bentoyloxy-2-benzoyl-l-naphlaline F. I77®,5. La saponi-fication de ce composć donnę le bromo-6-nilro-4-oxy-2-benzoyl-l-naphlaline F. 217° avec dćcomposition (diriui acilyli F. 203°,5). En condensant la benzolne avec lc bromo-3-hydroxy-2-naphtalćne, on obtient le bromo-7-diphenyl-2.3-benzo-4.5-coumarone F. 144°.
M. MARQUIS.
Sur les dśrives de l’aldol et de l’al-dehyde crotonigae; Spath E., Lorenz R. et Freund E. {Der. dlsch. chem. Ges., 1944, 76. 1196-1208). —* I/aldćhyde propionique, agitć 4 heures avcc unc solution sałurće de CO.K,, a 8°, est Iransformće en aldoxane corrcspondant ou ozy-6-milhyl-5-diilhyl-2.4-dioxanc-1.3 1), Eb,„ = 89°-90°, diriui acilyli, Ebj,* = 85®-85®,5; la rćaction de la phćnylhydrazine sur (I) donnę les phćnyl-
O— CH.CH..CH, v CH.CH,
nO—CHOH (I)
hydrazones de 1’aldćhyde propionique et du propionaldol; par distillation en prćsence d’une petile quanlitć d’acide adlpiaue (I) donnę le propionaldol, p-nilro phiny Ihydra-zone, F. i31®-1320, Ieauel est lui-mćrae dćpolymćrisć en aldćhyde propionique nar chauffage k 215®. On a transformć de memc Faldóhyde n-bulyrique en oxy-6-ilhyl-5-di-n-propyl-2.4-dloxane-1.3, diriui acilyli, Eb, = I05°-I06°, de proprićtćs anafogues k celles de ;i). Avec 1'aldćhyde isobutyriąue
diriui acilyli, Eb„ = 133®-134®, dćdoublć comme ci-dessus en aldćhvde isobutyrique et isobutyraldol, Eb„ = 87°,5-88®,5, p-nitro-phinylhydraione, F. 115®-115®,5, diniłro-phćnylhydrazone, F. 108®-109®; diriui acilyli, Eb, =* 69°-72°, p-nitro-phiny Ihy drążone de ce dernier, F. 145®, dinilrophinylhydrazone, F* 151®. p. CAJłKŚ.
'hydrogśnation de quelquea com-posćs du soufre; Cawley C.-M. et Hall C.-C. iJ. Soc. chem. Ind. Lond., 1943, 62, 116-119). — Essais sur le phćnylmercaptan, le sulfure de carbone et le thiophćnc (classćs dans 1’ordre de difficultć d’hydrogćnation croissante). A une t de 300°-350° et une p de 20 atm., ces composćs rćagissent avec H, pour donner H.S et respectivement du ben-zene, du mćthane et du butane. Composćs intermćdiaires dans les deux derniers cas. Intćrćt pour le raffinage (dćsulfuration) des huilcs lubrifiantcs ci du benzol.
Sur la ohimie du thlonaphtćne et du dibenzothiophćne; Buu Hoi Ph. et Ca-gniant P. (Der. dlsch. chem. Ges., 1944, 76, 1269-1274). — L’acćt yl-3-thionaphtćne, Eb,, — I77M78®, a ćtć rćduit par Zn amalgamć -f C1H en łlhyl-3-lhionaphtine, Eb„ — 180®, picrate, F. 78°, condensć avec le chlorure d’acćtyle, par Cl,Al. en ilhyl-3-acilyl-2-lhionaphtine, F. 60«-60®,5, ne formant pas de semicarbazone. Le thionaphtćne est condensć avec 1'anhydride succiniaue, par Cl,Al, dans Vacide b-thionaphlinoyl-propio-niąue (I) F. 133®, rćduit en acide y-lhiona-
CO. (CH,>,.00,11
(U
phlinylbulyrique, F. 115®, le chlorure d acide de ce dernier, F. 130°-131®, est cyclisć par Cl,Al dans la cilone (II), F. 109°, Eb, = 212®-215®, oxime, F. 170®, semicarbazone, F. 263® (dćc.), rćduite en tilrahydro-1.2.3.4-dibenzo-Ihiophine, huile, Eb,(, = 180°, dćshydrogćnć sur Se k 300o-310®, en dibenzolhiophine, F. 95®-96®, lequel est oxydć par CrO, en une sulfone F. 230°. Le ‘dibenzothiophene est condensć avt*c 1’anhydride succinique en un acide cćtonique F. 155°, rćduit dans Vacide bulyriąue correspondant, F. 127°, Eb„, = 270®, amide, F. 139®, cyclisć par rinterrnćdiaire de son chlorure d’acide dans la cilone (III), F. 175®, Eb, = 267® ozime,
(IR) S
F. 212®-213° (dćc.), semicarbazone, F. 280®-282® (dćc.), rćduite en lelr amelhy linę-2.3-dibenzolhiophent, Eb, = 220°-230®. dćshydrogćnć en benzo-2.3-thiophinanlhrene, F. 163® oxydć par CrO, en quinone correspondanle, F. 208®-209°. La condensntion de 1'acide (I) avec 1’isatine, en prćsence de HOK, fourrnt 1 'acide thionaphlinyl-3’-carboxgmćlhyl-3 cin-choninique (IV) iuf. 320®.
HO,C
CO.ILC
//
(IV)
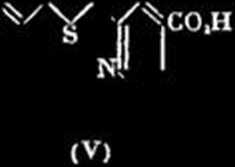
P; 1’acide cćtonique, F. 155° (ayant donnć | et 1’isatine donnent de mćme, 1 'acide dibenzolhiinyl - 3‘ - carboxyn\plhyl -3 - cinchoni-nique, inf. 325®, insolublc solvants usuels. La condensation de Fisatine avec (II) et-avec (III) donnę respectivement, Vacide thionaphlino-( 2'.3\ 1.2)-dihydro-3.4-acridinne-carboniąue-10 (V), inf. 320°, perdant faci-lement CO, par 1’action de la chaleur pour donner la lhionaphlino-[2\3’.1.2)-dihydro-3.4-acridine, F. 202®-203°, Eb, = 250°, picrate, dćc. ^> 250®, dćshydrogćnće sur PbO, k 320°, en thionaphtinoacridine, F. 172°, picrate, dćc.
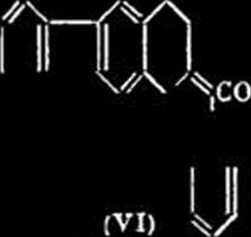
k 213°-215°; et 1 'acide dibenzolhiophino-( 2'.3’. 1.2) - dihydro-3.4-acridine-carbonique-10 (VI), inf. 325°. L’oxime de (111) n'a pu Ćtre condensće avec 1’isatine. p. carhć:.
D6riv6s dialcoylćs-2.2' du dlcóto-3.3'-d/-indoIinyle-2.2'; Van Alfhen J. {Dec. Trau. Chim. Pays-Bas, 1942, 61, 888-891). — Les composćs dimćthyl-2.2' et dićthyl-2.2'-dicćto-3.Ś'-diindolinyle-2.2' ont ćtć prćparćs. Ils peuvent Stre considćrćs comme dćrivant de 1’indigo par addition de deux groupe-ments CH, ou C,H, 5 la double liaison entre les deux radicaux indol. Ces composćs res-semblent k 1’indigo mais sont jaunes. En cbauffant 1’acide anthranilique, 1’acide chlo-ro-l-propionique et HONa, on obtient 1 'acide carboxy-2'-phinyl-l-aminopropionique F. 216® qui traitć par CH,CO,Na anhydre et CH,CO,H donnę le diacilyl-1.3-mithyl-2-indozyle F. 137®. Ce produit oxydć par Fair donnę lc dimtlhyl-2.2'-dicilo-3.3‘-diindo-linyle-2.2' qui se dćcompose k 174° et quł, chouffć a sec, donnc de Findigo. On a prć-parćdela mćme faęon Vacide carboxy-2‘ phi-nyiyi-aminobulyrique F. 215® (dćcomposi-tion), le diacityl-1.3-ilhyl-2-indoxyle F. 128° et le dUlhyl-2.2'-dicilo-3.3,-diindolinyle-2.2, F. 170® (dćc.). On a prćparć aussi Vacide carbozy - 2'- phinylamino) - phiriylacilique F. 222® ct le diacily 1-1.3 phinyl-2-indoxyle F. 126°, mais k partir de ce dernier composć ii a ćtć impossible d’obtenir le diphćnyl-2.2'-dicćio-3.5'-diindolinyIe-2.2\
(Anglais.) m. marquis.
Essais de prśparation du N.N'-ćthćne-indigo; van Alphen J. (Dec. Trau. Chim. Pays-Bas, 1942, 61, 481-492). — Des essais ont ćtć faits pour obtenir le N.N'-ćthćne indigo, le dćrivć du cis-indigo dans leąuel les atomes de N sont rćunis par une liaison ćthćne. On a obtenu un composć dont. la formule probable est celle du N.N'-ćthćne-indigo avec une molćcule d’eau fixće sur la double liaison entre les 2 noyaux indol. II a ćtć impossible d’enlever l’eau k ce composć sans le dćcomposer. Pour obtenir ce composć, on a effectuć la sćrie suivante de rćactions: en condensant 1 molćcule de dibromo-1.2-mćthane avcc 4 molćcules d'acidc onthra-nilique on obtient Yesler dimilhyliaue du di-(2'-carboxy phiny lamino)- 1.2-ithane F. 122°. Cet ester saponiflć donnę le di-(2'-carbozy-phiny lamino- 1.2-ilhane se dćcompose k 233®. En chauffant ce composć avec un mćlange de C.H.OH et de HCIIO k 33 0./0, on obtient le di- I (6'-oxo-4,.5,-benzo-mHhoxazine-dihy-drure)-3' I -1.2-ilhane F. 162® qui traitć par CNK donnę le dicarbonilrilo-1.6 di-(2‘-carboxyphintjl-2.5)-diaza-2.5-hexane se dćcompose k 203°. Ce nitrile traitć par C1H concen-trć donnę le dicarbamido-l.6-di-(2'-carbnxy-phinyl)2.5-di-aza-2.5-hexane se dćcompose k 245°. Pour saponifier le nitrile, il faut le traiter par un gros cxcćs dc SO*H. (3 volumes SO«H, -f- 2 volumes H,0). On obtient alors le dicarbozy-1.6-( 2'-carbozyphinyl\-2.5-di-aza-2.6-hexane se dćcompose ć 292®. En chauffant cet acide avec CH,CO,Na et (CH.COJ.O, on obtient le di-{3'-acetylindoxyl-l‘-) 1.2-ilhane F. 123®. En saponiflant ce composć par NH„ on obtient le di-(indoxyl-l') 1.2-ilhane qui oxydć par O, atmosphćriaue donnę 1 'ilhine-l.l,-hydroxy-2-dicelo-3.3,-diindolinyle-2. 2' se dćcompose a 220° et a la constitution la ou 15. Poudre jaune verdćtrc, insoluble solvants
(I a)
organiques. Par ćbullition avec C1H concen-trć, ce composć donnę le (hydroxy-2 -elhyl)-l-indigo bleu se dćcomposanl k 230° environ. En dissolvant le dćrivć diindolinyliaue dans H,0 avec quelques gouttes de HONa et en
Wyszukiwarka
Podobne podstrony:
34 CHIMIE ANALYTIQUE 194: timótrio; Kocsis E. A., Zador G. et Kal-l6s J. F. [Z. (mai. Chem., 1943, 1
8 CHIMIE ORGANIQUE 1945 C.H. C.H, CH laissant la solution plusieurs jours 5 1 air, on obtient en
1945 CHIMIE ORGANIQUE R.‘ nr Lir1. rc o1 H,C CH, (I) so, CH,C=CC1 le nitrile), F. 233°, le
2 CHIMIE OHGANigUE 1945 CHIMIE ORGANIQUE G£NeRALIT£S * Role des rayons «
4 CHIMIE ORGANIQUE1945 acide laurique — chlorure de lauroyle (par le chlorure de Ihionyle) —>- ac
1045 CHIMIE ORGANIQUE en position a. Les composćs d’addition se forment seulement par r action de
ORGANIZATION ME ET OOR TEAMa ił i MEET OOR TEAM S€0 ANALYSISG ©F U O SCO CHANNELSO o « o
194 Yang, Y., M. Chen, T. J. Loux et C. M. Harmon (2007). Regulation of FAT/CD36 mRNA gene expressio
Department of Organie Chemistry / Section de chimie organiąae : 5 De Dreijen, Wageningen : 6111
25 (359) 194 Problemy organizacji administracji centralnej Jeszcze przed opracowan
page0225 commenęaaregner, et son regne ne tlura qu’un an. II ne fit rien de ce qui pomrą i t plaire
str1 (3) Zaliczenie pisemne - Caput et collum; Wydział Lekarski r. akad. 2002/03 (01.04.2003--wtorek
strona001 Zaliczenie pisemne - Caput et collum; Wydział Lekarski r. akad. 2007/08 Wydział Lekarski 2
strona001 Zaliczenie pisemne - Csiput et colltim; Wydział Lekarski r akad. 2008-09 (02 04.2009 r. ~
strona001 (4) M 55 —-Zaliczenie pisemne — Abdomen et petcis; Wydział Lekarski r. a
Untitled 1 (3) / Caput et collum; Wydział Lekarski r. akad. 2006/07 (16.03.2007 - piątek, godz. 800)
więcej podobnych podstron