3855990600
1045
CHIMIE ORGANIQUE
en position a. Les composćs d’addition se forment seulement par r action de Tacćtate cuivrique sur les hydroxyanthraquinones digórćes dans 1'alcool et dans lcsquel!es un groupement bydroxyle en fl est prćpondć-rant. ’ m. marquis.
Sur 1'acćtylation du naphtalene; Lock G. (Sitiungsberichle Akad. Wtis. Wien (II 6),
Composśs dćrivant de la cyclohexylni-traminę et de 1'acide cyclohexyloxamique;
de Vries K. A. (Rec. Trau. Chim. Pays-Bas, 1942, 61, 223-243). — La cyclohexylnitramine a ćtć obtenue en faisant rćagir 2 molćculcs de cyclohexylamine avec 1 molćcule de 11ester dićthylique de 1’acide oxaliquc, en nitrant la N.N -dicyclohexyloxamide formće et en sapnnifiant la N.N'-dinitro-N.N’-dicyclo-hexyloxamidc avcc NH, F. 16°, D„ = 1,134, n)/ — 1,5038. Les sels de Na K, NH,, Ca, Ba, Zn, Ni, Ag, Cu et Hg1+ oni ćtć prćparćs. En faisant rćagir 1 molćcule de cyclohexylamine avec 1 molćcule de dimćthyloxalate ou de dićthyloxalate on a obtenu respectivement les esters mćthylique F. 73° et ślhyliaue F. 60° de Yacide cyclo-hexyloxamique. On a fait rćagir ces esters avec diverses amines et on a obtenu les composćs suivants: N-cyclohexyloxamide F, 234°, N-cyclohexyl-N'-mćthyloxamide F. 212°-N-cyclohexyl-N‘-ćlhyloxamide F. 184°, N-cyclohexyl-N'-n-propyloxamide F. 179°, N-cyclohexyl-N‘-n-butyloxamide F. 180°, N-cyclohexyl-N,-n-amyloxamide F. 156°, N-cyclohextjl-N'-isopropyloxamide F. 196°, 7V cyclohexyl-N'-isobutyloxamide F. 192°, N~ cyclohexyl-N'-isoamyloxamide F. 185°, N~ cyclohexyl-N'-i$ohexyloxamide F. 165°, Nm cyclohexyl-N'-phinyloxamide F. 209°, N~ cyclohexyl-N'-(2-nitroph6nyl)-oxamide F. 155°, N-cyclohexyl-N'-[3-nitrophźnyl) - oxamide F. 205°, N-cyclohexyl-N'-[ 4-nitrophćnyl)-oxamide F. 228°, N-cyclohtxyl-N'-(2-mćlhylphinyl)-0X0 mi de F. 195°, N-cycluhexyl-N'-[3-mćlhyl-phinyl)-oxamide F. 162°, N-cyclohexyl-N'-(4-mćlhylphtnyl)-oxamide F. 208° et iV-cyclohexyl-N‘-benzyloxamide F. 182®. Tous ces composćs sont incolores, Ićgćrement solubles H.O et l’óther de pćtrole, solubles alcool, ćther, C,H„ acćtone et CHC1,. La nitration de la N-cyclohexyl-N'-phćmjloxa-mide ct de plusieurs autres N-cyclohexyl-N'-alcoyloxamides a ćlć effectuće soit par NO»H anhydre, soit par un mćlange b parlies ćgales de NO,H anhydre et de SO1H, concentrć. Les composćs suivants ont ćtć obtenus : 7V - cyclohexylnilro-N'-mćthylnitro-
ozamide F. 72°; N-cyclohexylni!ro-N'-6lhyl‘ nitro-oxamidc F. 43®. Dans la nitration de la N-cyclohexyl-N'-phćnyloxamide par NO,H [d = 1,46) on obtient la N-cyclohezyl-N'-(4-niirophćnyrroxamide F. 228° et la N - cyclohexyl-N'-( 2-nitrophtnyl)-oxamide F. 147°. Si la nitration est faite avec NO,H anhydre, on obtient. la N-cyclohexyl-N'-(2.4-dinilrophinyl)-oxamide F. 176°. Avec un mćlange de SÓ4H, et de NO,H anhydre, il se formę la A'-cyclohexyl-N‘-(2.4.6-lrini-lrophćnyl)-oxamide F. 276®. Dans la nitration de la N-cyclohexyl-N'-benzyloxamide, il se formę la N-cyclohexyl-N'-(2.4-dinilrobenzyiy 1942, 151, 11-18). — Dans 1’acćtylation du naphtalfene avec le chlorure d’acćtyle et Cl.Al en prćsence de CS„ on obtient toujours un mćlange des acćlyl-1- et 2-naphtalfenes avec un rendement qui est au plus de 75 0/0 du rendement thćorique. Le mćlange ren-ferme 50-60 0/0 d’acćtyl-l-naphtalene. Les produits commerciaux. dćsignćs sous le nom de « oc-naphtylmćthyl-cćtone », renferment
COMPOSĆS ALICYCLIQUES
oxamide F. ]97®. En nitrant plusieurs fois dc suitę 1’acide ćthylćne-1.2-dioxomique-dicyclohexylamide, on obtient Yacide N.N’~ N#.N'"-/ć/ranf/ro - ithylłne-1.2-dioxamique-di-cyclohezylamide F. 161®. En traitant Tester ćlhylique de 1’acide cyclohexyloxamique par le sulfate d’hydrazinc, on obtient la 5-cyclohexylsemioxamazide F. 238° (dłriuć acćtylż F. 207°; dćriuć bcnzoyU F. 225°). Des semioxamazones ont ćtć obtenues en condensant la 5-cyclohexylsemioxamazide avcc les aldćhydes et les cćtones suivants: aldćhyde formique F. 225°; aldćhyde acćlique F. 213°; furfural F. 263°; melhy 1-5-furfural F. 231°; hydroxy-5-mćthylfurfural F. 226°; henzaldćhyde F. 255°; mćlhoxy-4-benzaldćhyde F. 266°; milhoxy-3-hydroxy-4-benzaldćhyde F. 248°; dioxymćlhylłne-3.4-benzaldćhyde F. 265°; acćtone F. 188®; actlophtnone F. 210°. Les 5-cyclohexylsemioxamazides substitućes suivantes ont ćtć prćparćes: 1-phćnyl-
F. 219°, l-(4-nilrophćnyl) F. 237®, 1-asym-diphćnyl- F. 246®, l-(2-mćlhylphćnyl) F. 207°, l-[3-milhylphinyl) F. 228°, l-(4-mślhylphć-nyl) F. 219° et l-(4-bromophćnyl)-b-cyclo-hcxylsemioxamazides F. 232°.
(Anglais.) m. marquis.
Contribution a l’6tude de 1’w-nitro-camphene; Lipp P. ct Mf.ttegang H. (Ber. dlsch. chem. Ges.y 1944, 76, 1275-12781. — L’w-nitrocamphćne rćagit avec NaCN dans Talcool bouillant pour donner un cyanure de nilroisocamphyle, dont les pro-prićlćs sont le mieux reprćsentćes par la formule (I) F. 165®-166®, Eb0„ = 170°-180®,
CHj—CH—C(CH1)i CH,
CHr-CH—C(CN) CH,NO, (I)
CHr-CH—C(CH,),
CH,
CII, -d:H— C(CN>-CHINHI (II)
sublimablc, a2 « -f 25®, sel de Na : CnH.^NtNa
aiguilles. Traitć par HOK, (I) fournit de la camphćnilone, semicarbazone F. 223®, et de Y isocamphtnt lanarnide C.oHnON, F. 169®-170°. La reduction dc (1) par H sous 79 atm, sur PI, & 50®, donnę Yaminonitrile (II), chlor hydrole dćc. & 238®-265®, chloro plalinale, crisL, phinylurće, F. 178®-179®.
* Contribution a 1’ćtude des acides
rśsiniques; Lombard R. (Thćse Sci. phys. Paris, 1943). — Constitution chimique des
COMPOSĆS HĆTĆROCYCLigUES
de 1’acrolćine, un produit non phćnolique, saturć, rćsultant de la cyclisation de la chalne acrolćinique sur un des 2 noyaux en un dćrivć du coumarane, F. 89°.
Le furfural et ses dórivós; Waguet P. (Bev. Prod. chim., 1943, 46. 113-117). — Traitement des dśchets agricoles et du bois
de mćme de 56 A 62 0/0 d’acćtyl-l-naphta-lćne. La tempćraturc ó laquelle est faite la rćaction et les ąuanlitćs de Cl,Al employćes n’ont qu’une action peu importante sur le rapport des quantitćs des cetones isomćres formćes. L’acćtyl-l-naphtalćnc fond ć 10®,5 environ. m. marquis.
acides rćsiniques tirćs des gemmes de pin maritime et de pin d’Alep.
Sur la dćcomposition tbermiąue des produits d’addition dieniąues des acideB du type abićtiąue; Sandermann W. et HOhn R. (Ber. dlsch. Chem. Ge,s., 1944, 76, 1257-1261). — Le produit d’addition de 1’acćtylćne-dicarbonate de rnćthyle b 1’acide lćvopimarique, C,4H«0„ F. 170®, est stable ć la chaleur, il ne donnę pas de distillat a 280®-300® sous 4 mm; sa dćshydrogćnatien sur Pd b 310°-320® ne donnę pas dc rćtóne, ces faits sont en accord avec la constitution (I) de 1’acide lćvopimarique. Le produit
H.C CO.H
ixn
H,C
(I)
d’addition de 1’anhydride malćiąuc b 1’acide lćvopimarique, F. 227®, ester mćthylique F. 214°, abandonne son anhydride malćiąue b 300®-310®. p. CAnnE.
Sur 1’acide i«oabietique, un nouvel acide resinique; Sandermann W. (Ber. dlsch. chem. Ges., 1944, 76, 1261-1268). — Uacide isoabićlique (I), F. 172®, an = + 29°, est obtenu par action de HOK alcooliąue
H,C CO.H
X./x
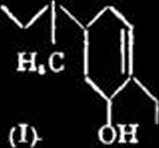
sur le dibromhydrate de 1’acide abićtique; dibromhydrate de (I), F. 163®-165®, dichlo-rhydrole, F. 190®, produits d'addition avec Yacide acćlylłnedicarboniyue, F. 169®-170°, et avec Yanhydride maliique, F. 225°-227°, ester mćlhylique, F. 214°); il peut Ćtre nitrć en un dłriui nilrć, F. 183°; esler mtłhylique, F. 188®, tandis que 1’acide abićtique ne se nitre pas. L’oxydation de (I) par MnO.K, donnę une rćsine dont l’oxydation par CrO, donnę de 1’acćtone; (I) peut fttre oxydć par Mn04K alcalin avec formatior. d’acide i8obutyrique. Les cristaux d’acide isoabiś-tique diffćrent des crislaux d’acide abićtique; le spectre prćsente un maximum d’absorption b 238-239 mu. p. carrć.
pour 1’obtention des pentosanes servant ó prćparer le furfural; applications du furfural par des matićrcs plastiques, cormne carbu1 rant- et dans 1’industrie du caoutchouc synthćtique.
Sur la connaissance de la diph6nvl-2.
3-benzo-coumarone-4.5-brom6e; Dis1
Sur la condenaation des phćnols avec les aldehydes non saturós en a.3; Adler
E. et Tingstam S. (Ark. Kemi Min. Geol., 1943. 16, n® 5, 1-7). — La condensation du dimćthy!-2.4-phćnol (2 mol.) avec 1’acrolćine (1 mol.) en solulion acćtique, en prćsence de 1ICI, fournit, b froid, vraiscmblablemcnt par 1’intermćdiaire de racótal, diphćnylique
Wyszukiwarka
Podobne podstrony:
II. "Administrations nationales et organisations in-ternationałes - Les problfcmes administrati
55 * Les interets canadiens en Arctiąue se trouvent influences par ceux de la / Russie et des Etats-
8 CHIMIE ORGANIQUE 1945 C.H. C.H, CH laissant la solution plusieurs jours 5 1 air, on obtient en
1945 CHIMIE BIOLOGIQUE Chien la teneur du sang en NH,. Les symp-tAmcs observAs chcz 1’Homme A la sui
17 En hiver, les mćsanges vivent en groupes de 3 k 15 individus (Desrochers et dl., 1988; Odum, 1942
271 CHAP. II : PROSE. 21 Partie pPEOSE CHINOISE COMPOSEE EN COREE. Les ouyrages corśens indiqu£s
50 etrangere en protegeant sa propre culture organisationnelle169. Cette position de retranchement l
17 En hiver, les mćsanges vivent en groupes de 3 k 15 individus (Desrochers et dl., 1988; Odum, 1942
77 LES PREUYES INDIRECTES dabord se rappeler la position prise a propos des preceptes de bienfaisanc
cTćtonnant si on se souvient de ce qui a ete dit de la prćdilection du latin tardif pour les compose
Fleurs en perles? rocaille,B redimensionner Rangs 12 et 13 (en manę tanpsj De chaquc cótt. en serran
Fleurs en perles? rocaille,f redimensionner HIBISCUS Pistil ęnfilagc en volumcHibiSCUS Les Jleurs d’
22 etudiants ont la chance de profiter de cette mobilite (en generał, les plus aises), alors que Pen
42 en 16 , par Anne-Marie Martel, decedee en 1673. Les Re-ligieuses de 1’Enfant-Jesus sont etablies
49 Damę cle Pouille, en France, en 1205. Les Dominicaines Contemplatives ont ouvert leur premiere ma
Activitćs: Stagc dc formation pour Ies animatrices chargees dc dirigcr des activitćs fćminines; a or
1945 CHIMIE ORGANIQUE R.‘ nr Lir1. rc o1 H,C CH, (I) so, CH,C=CC1 le nitrile), F. 233°, le
2 CHIMIE OHGANigUE 1945 CHIMIE ORGANIQUE G£NeRALIT£S * Role des rayons «
4 CHIMIE ORGANIQUE1945 acide laurique — chlorure de lauroyle (par le chlorure de Ihionyle) —>- ac
więcej podobnych podstron