6161619717
roztworu białka (zarówno uzyskanego metodą transmisyjną jak i ATR) jest wizualne odjęcie wcześniej zmierzonego widma wody aż do uzyskania na widmie wynikowym płaskiej linii w okolicy 2000 - 1800 cm'1.
Alternatywnym rozpuszczalnikiem białek może być woda ciężka, D20. Jej zaletąjest to, iż nie posiada silnych pasm absorpcji w zakresie pasma amidowego I. Zastąpienie atomów wodoru deuterem nie powoduje drastycznych zmian w kształcie pasma amidowego F (znak prim oznacza, że widmo zostało zmierzone w wodzie ciężkiej), zmiany te jednak pozwalają na rozróżnienie pasm absorpcji struktur a od struktur pędowych, co w wodzie zwykłej (H20) nie byłoby łatwe. Niewielkiemu przesunięciu w stronę niższych liczb falowych ulegają też wartości absorpcji pozostałych struktur drugorzędowych (Rys. 5). Drastycznej zmianie ulega natomiast położenie pasma amidowego II. Wymiana protonowa powoduje przesunięcie maksimum tego pasma od ok. 1550 cm'1 do ok. 1450 cm'1 (to nowe pasmo nazywane jest pasmem amidowym II’). Tak duża zmiana jest podstawą dla eksperymentów mających na celu np. określenie stabilności hydrofobowego rdzenia białek.
c. Zwiększanie rozdzielczości widm - uzyskiwanie informacji o pasmach składowych
Stosuje się powszechnie kilka technik pozwalających określić liczbę i położenie pasm składowych, które można następnie przypisać konkretnym strukturom drugorzędowym. Wszystkie te techniki mają jednak poważną wadę - uzyskane wyniki są w dużym stopniu zależne od subiektywnych decyzji dokonywanych na kolejnych etapach obróbki widm i powinny być stosowane z ostrożnością.
i) Druga pochodna widm. Minima na drugiej pochodnej widm biocząsteczek określają w przybliżeniu liczbę i położenie pasm składowych. Kształt drugiej pochodnej, w szczególności informacja o liczbie pasm składowych, zależy od jakości danych pierwotnych. Druga pochodna widm jest bardzo wrażliwa na wszelkie zakłócenia (np. szumy aparaturowe, nieskorygowane pasma absorpcji pary wodnej, itp), dlatego należy ostrożnie analizować jej kształt. Na Rys. 6 przedstawiono serię drugich pochodnych widm lizozymu z białka jaja kurzego zmierzonych w zakresie temperatury 35°C - 56°C. Minima drugich pochodnych wskazują prawdopodobne położenie pasm składowych, które można przypisać poszczególnym strukturom drugorzędowym.
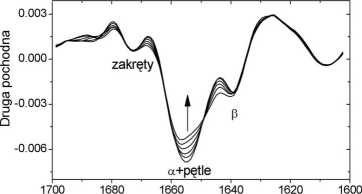
Liczba falowa (cm'1)
Rys. 6. Seria drugich pochodnych widm lizozymu z białka jaja kurzego, zmierzonych w zakresie temperatury 35°C - 56°C. Strzałką oznaczono kierunek zmian towarzyszących wzrostowi temperatury. Oznaczono także najważniejsze struktury drugorzędowe: a - a - helisy, (3 - (3 - kartki.
Wyszukiwarka
Podobne podstrony:
ekonomika (77) Sprawne zarządzanie transportem zarówno po stronie zaopatrzenia, jak * dystrybucji j
74590 IMGt72 rozpoznać i zdiagnozować te dzieci tak wcześnie, jak tylko jest to możliwe. Wczesna int
skan0136 Roztwory i równowagi fazowe 139 Rys. 4.5. Wyznaczanie współczynnika aktywności metodą krios
422 423 (2) Efekty w układzie naczyniowym narządów uzyskane są zarówno na drodze odruchowej, jak i p
f 2 Podstawowy model pracy socjalnej mówi, że praktyka ogólna jest zarówno metodą rozumowania jak i
X OBSERWATORIUM ŻYWEJ KULTURY-SIEĆ BADAWCZA Zamierzamy zarówno starać się o darczyńców, jak i uzyska
więcej podobnych podstron