8851686227
VII Sesja Magistrantów i Doktorantów Łódzkiego Środowiska Chemików
K-04
STRUKTURY KRYSTALICZNE ZIMNOLUBNYCH GALAKTOZYDAZ Z RODZINY GH2
Maria Rutkiewicz-Krotewicz Promotor: dr hab. inż. Anna Bujacz Politechnika Łódzka, Wydział Biotechnologii i Nauk o Żywności, Instytut Biochemii Technicznej
Rodzina Hydrolaz Glikozydowych GH2, to grupa szeroko rozpowszechnionych enzymów hydrolizujących wiązanie glikozydowe. Klasyfikacja tych enzymów została dokonana na podstawie sekwencji [1], a nie selektywności substratowej. W związku z tym, w grupie tej znajdują się enzymy wykazujące aktywność m.in.: P-galaktozydaz, (3-mannozydaz, egzo-p-glukozamidaz [2], (3-glucosydaz, a-L-arabinofuranozydaz [3]. Badania wykazały, że niektóre spośród tym enzymów są w stanie katalizować również reakcję transglikozylacji.
Białka należące do GH2 mają bardzo zbliżony strukturalnie rdzeń katalityczny, tworzący beczułkę TIM [4]. Poznane dotychczas struktury krystaliczne (3-D-galaktozydaz należących do tej rodziny wykazują aktywność w formie tetramerów lub heksamerów. W Instytucie Biochemii Technicznej PŁ zostały rozwiązane struktury dwóch nowych, zimnolubnych (3-D-galaktozydaz: z Paracoccus sp. 32D (ParpDG) oraz Arthrobacter sp. 32cB [Arth$DG), których jednostką funkcjonalną jest dimer (Fig. 1).
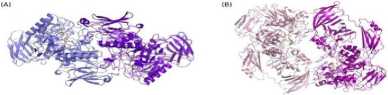
Fig. 1 Struktury krystaliczne dimerów (3-D-galaktozydaz: (A) Par^DG oraz (B) Arth (3DG.
Dane dyfrakcyjne dla kryształów obydwu białek zostały zarejestrowane na synchrotronie BESSY w Berlinie do rozdzielczości 2.4A i 2.15A. Struktura ParfiDG została określona w ortogonalnej grupie przestrzennej P2i2i2i, natomiast ArthfiDG w trygonalnej P3i21. Przewidywana w testach biochemicznych dimeryczność jednostki aktywnej obydwu enzymów została potwierdzona badaniami krystalograficznymi, które dodatkowo ujawniły szereg szczegółów strukturalnych, determinujących tworzenie funkcjonalnego dimeru.
[1] Henrissat, B. (1991). Biochem. J. 280, 309-316.
[2] Davies, G., Henrissat, B. (1995). Structure. 3,853-859.
[3] Schroder, C., Blank, S„ Antranikian, G. (2015). Front. Bioeng. Biotechnol. 3,76-82.
[4] Jacobson, R. H„ Zhang, X-J„ DuBosse, R. F„ Matthews, B. W. (1994). Naturę. 369, 761-766.
14
Wyszukiwarka
Podobne podstrony:
VII Sesja Magistrantów i Doktorantów Łódzkiego Środowiska Chemików K-01WIELOFUNKCYJNE MATERIAŁY
VII Sesja Magistrantów i Doktorantów Łódzkiego Środowiska ChemikówK-02 SYNTEZA, CHARAKTERYSTKA ORAZ
VII Sesja Magistrantów i Doktorantów Łódzkiego Środowiska Chemików K-03 UWRAŻLIWIANIE
VII Sesja Magistrantów i Doktorantów Łódzkiego Środowiska Chemików K-05 BIOSURFAKTANTY OTRZYMYWANE Z
VII Sesja Magistrantów i Doktorantów Łódzkiego Środowiska Chemików K-06 SYNTEZA, WŁAŚCIWOŚCI
VII Sesja Magistrantów i Doktorantów Łódzkiego Środowiska Chemików K-07CHARAKTERYSTYKA REAKTYWNOŚCI
VII Sesja Magistrantów i Doktorantów Łódzkiego Środowiska Chemików K-08 INNOWACYJNE MOŻLIWOŚCI
VII Sesja Magistrantów i Doktorantów Łódzkiego Środowiska Chemików K-09 WPŁYW RESZTY ALKOHOLOWEJ NA
VII Sesja Magistrantów i Doktorantów Łódzkiego Środowiska ChemikówProgram VII Sesji Magistrantów i
VII Sesja Magistrantów i Doktorantów Łódzkiego Środowiska ChemikówO Sesji Sesja Magistrantów i
VII Sesja Magistrantów i Doktorantów Łódzkiego Środowiska ChemikówOrganizatorzyPatronat JM Rektor
VII Sesja Magistrantów i Doktorantów Łódzkiego Środowiska ChemikówJury Sesji Dr hab. Katarzyna Lisow
PISMO PG 7Profesor Tadeusz Godycki-Ćwirko doktorem honoris causa Politechniki Łódzkiej środowisko
Rozdział 1 stopniem doktor lub tytułem zawodowym magister (doktor habilitowany nie jest zlepkiem dwó
Bibliografia prac językoznawczych łódzkiego środowiska polonistycznego Katedra Historii
Imię i nazwisko Karolina Nowak Tytuł / stopień naukowy magister, doktorantka Adres elektroniczny
Tytuł / stopień naukowy magister/doktorant Adres
Nasi absolwenci mówią o nas Studia magistersie i doktorat z fizyki na WPPT PWr umożliwiły mi za
więcej podobnych podstron