
Wodór z etanolu
Wstęp teoretyczny
W skali globalnej obserwuje się nieustanny wzrost zapotrzebowanie na energię.
Równocześnie, presja na ochronę środowiska oraz zmniejszające się zasoby paliw kopalnych
stanowią siłę napędową dla poszukiwań nowych, bardziej wydajnych i ekonomicznych źródeł
energii oraz metod jej przetwarzania i akumulowania. Dostęp do energii warunkuje
możliwość wszelkiego działania, umożliwia przekształcenie zasobów naturalnych w dobra i
przedmioty użytkowe, służące zarówno poszczególnym ludziom, jak i całemu społeczeństwu.
W wyniku zaostrzania standardów ochrony środowiska oraz zmniejszania się zasobów paliw
kopalnych wzrasta zapotrzebowanie na czystą energię. Pod tym pojęciem rozumie się energię,
której wytwarzanie nie stanowi zagrożenia dla środowiska i nie zmniejsza zasobów paliw
kopalnych. Zapotrzebowanie to może być zaspokojone poprzez wytwarzanie energii ze źródeł
odnawialnych – wydajnych i ekonomicznie opłacalnych. Rozwijanie alternatywnych źródeł
energii, stanowi jedną z opcji poprawy bilansu gospodarki energetycznej.
Wodór może być wykorzystywany w motoryzacji jako nośnik energii - paliwo
zasilające silniki pojazdów - bezpośrednio zasilać pojazdy poprzez spalanie w odpowiednio
dostosowanym silniku spalinowym, bądź też energia w nim zawarta może być najpierw
zamieniona na energię elektryczna (w ogniwie paliwowym), a ta dopiero zasila silnik
elektryczny pojazdu. Ta druga opcja jest znacznie bardzie efektywna. Współcześnie, wodór
tylko w niewielkim stopniu jest wykorzystywany do zasilania silników pojazdów
mechanicznych, jednak jego znaczenie szybko rośnie. Uważa się, że jeszcze w XXI wieku
wodór będzie głównym nośnikiem energii stosowanym przez ludzkość [3].
Wodór jest również jednym z podstawowych surowców przemysłu chemicznego,
szczególnie przemysłu rafineryjnego. Istnieje wiele metod produkcji wodoru np. konwersja
gazu wodnego, reforming węglowodorów (szczególnie metanu), zgazowanie węgla, odzysk z
gazów rafineryjnych i petrochemicznych. Większość przemysłowych metod wytwarzania
tego gazu oparta jest na przeróbce ropy naftowej, gazu ziemnego i węgla, a także różnych
metodach rozszczepienia wody (np. elektroliza).
Potencjalnie bardzo obiecującym surowcem dla wytwarzania wodoru jest etanol.
Alkohol ten może być otrzymywany z biomasy i dlatego traktować go należy, jako surowiec
odnawialny. Wodór
uzyskany na drodze parowego reformingu etanolu nie tylko nie zatruwa
środowiska, ale także jest nowym sposobem wykorzystania powszechnie dostępnych zasobów
odnawialnych [1]. Etanol jest stosunkowo łatwo otrzymywany z biomasy, w wyniku
hydrolizy materiałów celulozowych i ich fermentację lub też na drodze fermentacji cukru.
Jednocześnie koszty wytworzenia tego czystego nośnika energii – biorąc pod uwagę
zastosowanie etanolu z biomasy – również są przystępne. Dwutlenek węgla powstający w
reakcji jest obojętny z punktu widzenia efektu cieplarnianego gdyż rośliny (biomasa)
pochłaniają go w procesie fotosyntezy. Tak więc etanol to atrakcyjne pod względem
efektywności, kosztów i wygody, źródło zasilania pojazdów za pomocą wodorowych ogniw
paliwowych.
Parowy reforming etanolu to proces katalityczny, prowadzony w temperaturze 450-
550°C w reaktorze rurowym. Polega on na wprowadzeniu do reaktora mieszaniny reakcyjnej
etanol-woda, przed wprowadzeniem do stałego złoża reaktora musi ona być zamieniona w
parę.
Biorąc pod uwagę stechiometrię, reakcja parowego reformingu etanolu powinna przebiegać
jak poniżej [1]:
C
2
H
5
OH + 3H
2
O → 2 CO
2
+ 6H
2
(ΔH
0
298 = +347,4 kJ/mol)
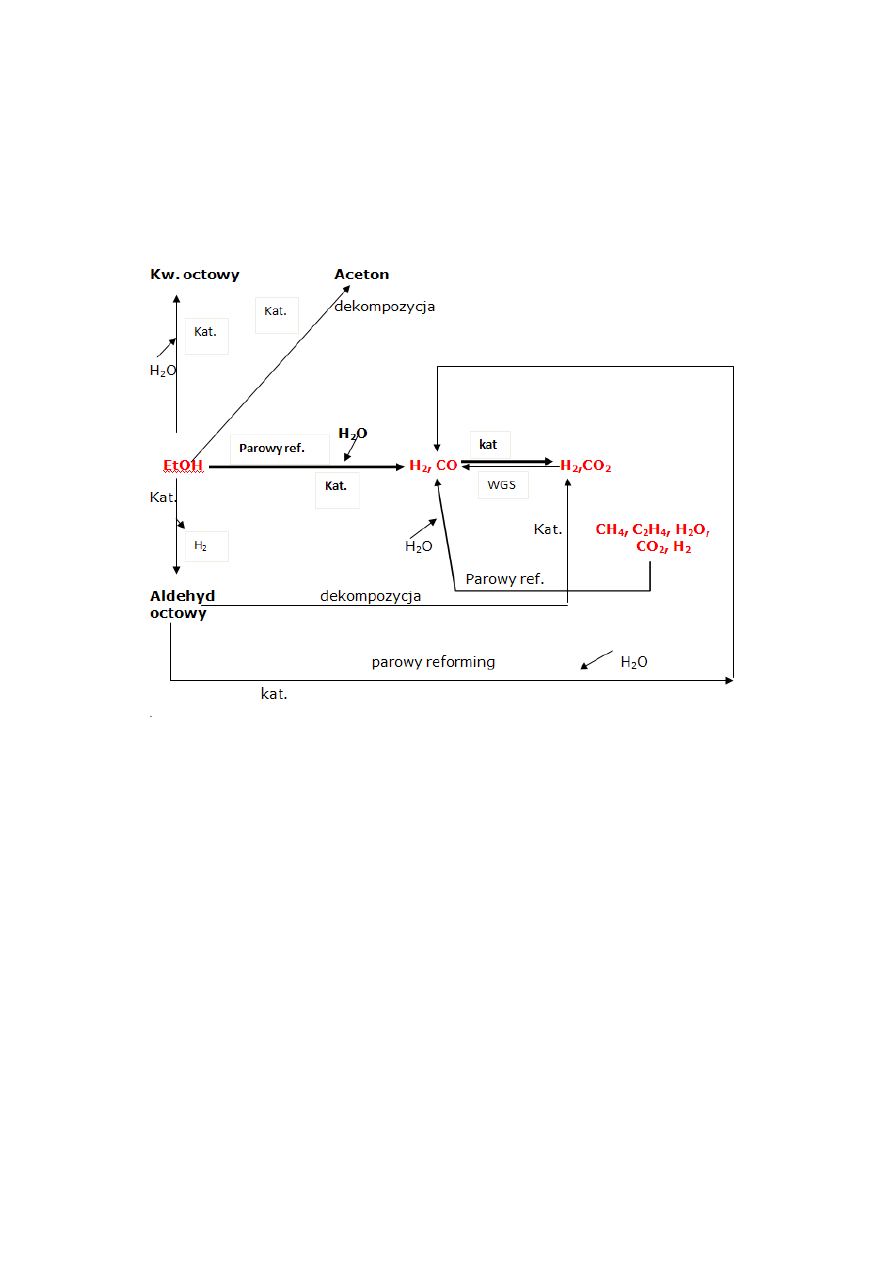
Na konwersję C
2
H
5
OH do H
2
składają się między innymi poniższe reakcje:
C
2
H
5
OH + H
2
O ↔ CH
4
+ CO
2
+ 2H
2
(ΔH
0
298 = 51,3 kJ/mol)
CH
4
+ H
2
O ↔ CO + 3 H
2
(ΔH
0
298 = 206,2 kJ/mol) (reforming parowy metanu)
CO + H
2
O ↔CO
2
+ H
2
(ΔH
0
298 = - 41,2 kJ/mol) (konwersja gazu wodnego)
Konwersja etanolu może przebiegać według różnych ścieżek reakcyjnych
w
zależności od zastosowanego katalizatora i warunków procesu. Produktami tych przemian,
oprócz wodoru i CO
2
, może być kwas octowy, aceton lub aldehyd octowy – wiadomym jest,
że kwaśne katalizatory np. tlenek glinu sprzyjają reakcji dehydratacji, zaś zasadowe (np.
tlenek magnezu) ułatwiają przebieg reakcji odwodornienia.
Znanych jest
wiele katalizatorów procesu parowego reformingu etanolu np. metale
szlachetne, tlenki metali
przejściowych, oraz mieszane tlenki o strukturze: spinelu AB
2
O
4
,
perowskituABO
3
, fluorytu A
2
B
2
O
8
. Katalizatory na bazie metali szlachetnych są bardzo
aktywne, jednak posiadają istotne wady – wrażliwość na zatrucie oraz wysoką cenę.
Zawierające kobalt (nikiel), cynk lub cer tlenki,
wydają się być jedną z najbardziej
obiecujących grup katalizatorów omawianego procesu. Katalizatory na bazie wymienionych
pierwiastków wykazują jednak niekorzystne cechy, takie jak: stosunkowo wysoka
temperatura reakcji, obecność tlenku węgla w produktach reakcji, mała odporność na
dezaktywację czy niewielka powierzchnia właściwa.
W ćwiczeniu, jako katalizatory
stosowane są mieszane tlenki metali o strukturze typu
spinelu i zawierające w swoim składzie cynk. Wybór tych materiałów uzasadniony jest
wysoką aktywnością zawierających cynk katalizatorów w procesie syntezy metanolu, oraz
parowego reformingu etanolu. Podkreśla się ich odporność na dezaktywację, wysoką
selektywność do wodoru oraz stosunkowo niewielki koszt wytwarzania spineli cynkowych.
Spinele są to podwójne, izomorficzne tlenki metali na II i III stopniu utlenienia. Ich
ogólny wzór to AB2O4 gdzie A jest metalem II wartościowym, zaś B – metalem III

wartościowym. Krystalizują w układzie regularnym, zwykle w postaci ośmiościanu. Nazwa
pochodzi od charakterystycznego, ostrokrawędzistego kształtu kryształów (po łacinie "spina"
- strzała). Struktura spinelu zbudowana jest z gęsto upakowanych anionów tlenu, kationy zaś
znajdują się w lukach tetraedrycznych(A) lub oktaedrycznych (B).
Kationy znajdujące się w
różnych lukach oddziałują ze sobą poprzez jony tlenu tzw. A-O-B (wymiana kwantowo-mechaniczna)
[2].
Rys.1 Struktura spinelu;
A – metal II wartościowy,
B – metal III
wartościowy ,
tlen
Zawierający żelazo spinel jest dobrym katalizatorem reakcji konwersji gazu wodnego i
dlatego oczekiwany jest pozytywny wpływ obecności tego komponentu na wydajność wodoru
oraz zmniejszenie zawartości tlenku węgla w końcowym produkcie. Kobalt, nikiel, obok
cynku, wykazuje najbardziej korzystne cechy, jako katalizator parowego reformingu etanolu.
Wreszcie spinele glinowe, charakteryzują się dobrze rozwiniętą powierzchnia właściwą i
znaczną stabilnością w warunkach hydrotermalnych.
Spinel cynkowo-glinowy ZnAl
2
O
4
charakteryzuje się dużą stabilnością termiczną,
wysoką odpornością mechaniczną, hydrofobowością i niską powierzchnią kwasową. Ze
względu na te właściwości spinel cynkowo-glinowych jest interesującym materiałem
stosowanym jako katalizator (synteza metanolu, selektywna redukcja NO
x
) lub jako nośnik
metali aktywnych, aby zastąpić bardziej tradycyjne katalizatory.
Spinel cynkowo-kobaltowy ZnCo
2
O
4
wykazuje wysoką aktywność katalityczną w
niektórych reakcjach takich jak, utlenianie związków alkilowych, utlenienia CO, katalityczne
spalanie węglowodorów lub selektywne utlenienie i redukcje niektórych cząsteczek
organicznych.
Cel ćwiczenia
Celem ćwiczenia jest zapoznanie się z procesem katalitycznego reformingu etanolu oraz
określenie aktywności katalitycznej spineli cynkowych w tej reakcji.
Część eksperymentalna
Celem ćwiczenia jest zapoznanie się z procesem katalitycznego reformingu etanolu oraz
określenie aktywności katalitycznej spineli cynkowych w tej reakcji.
Dla zrealizowania tego celu należy wykonać następujące zadania:
1) Przygotowanie materiału do badań, w tym przygotowanie odpowiedniej frakcji
katalizatora (powyżej 0,1 mm), upakowywanie reaktora.
2) Wykonanie testu aktywności katalitycznej katalizatora spinelowego w procesie
parowego reformingu etanolu
3) Określenie składu produktów reakcji w funkcji jej parametrów
4) Opracowanie wyników badań
W ćwiczeniu, skład gazowych produktów procesu określany jest przy użyciu
zmodyfikowanego chromatografu gazowego N504 z głowicami FID i TCD. Detektor FID
czyli płomieniowo – jonizacyjny jest najpowszechniej stosowanym detektorem w
chromatografii gazowej. Rozdzielona na kolumnie chromatograficznej próbka spalana jest w
płomieniu wodoru i powietrza. Związki zawierające węgiel wytwarzają jony, które zbierane
są na kolektorze (elektrodzie kolektorowej). Prąd jonowy kolektorowany jest na elektrodzie,
wzmacniany i rejestrowany [4].
Detektor ten reaguje na wszystkie związki organiczne, brak jest sygnału dla gazów
szlachetnych, O
2
, N
2
, CO, CO
2
, H
2
, H
2
S, COS, chlorowców, chlorowcowodorów, amoniaku i
tlenków azotu.
Detektor TCD czyli przewodnictwa cieplnego jest detektorem uniwersalnym
odpowiadającym na związki charakteryzujące się różnymi zdolnościami przenoszenia ciepła z
gazu nośnego. Zasada działania: Zmiana przewodnictwa cieplnego gazu przepływającego
przez detektor pod wpływem składnika opuszczającego kolumnę.
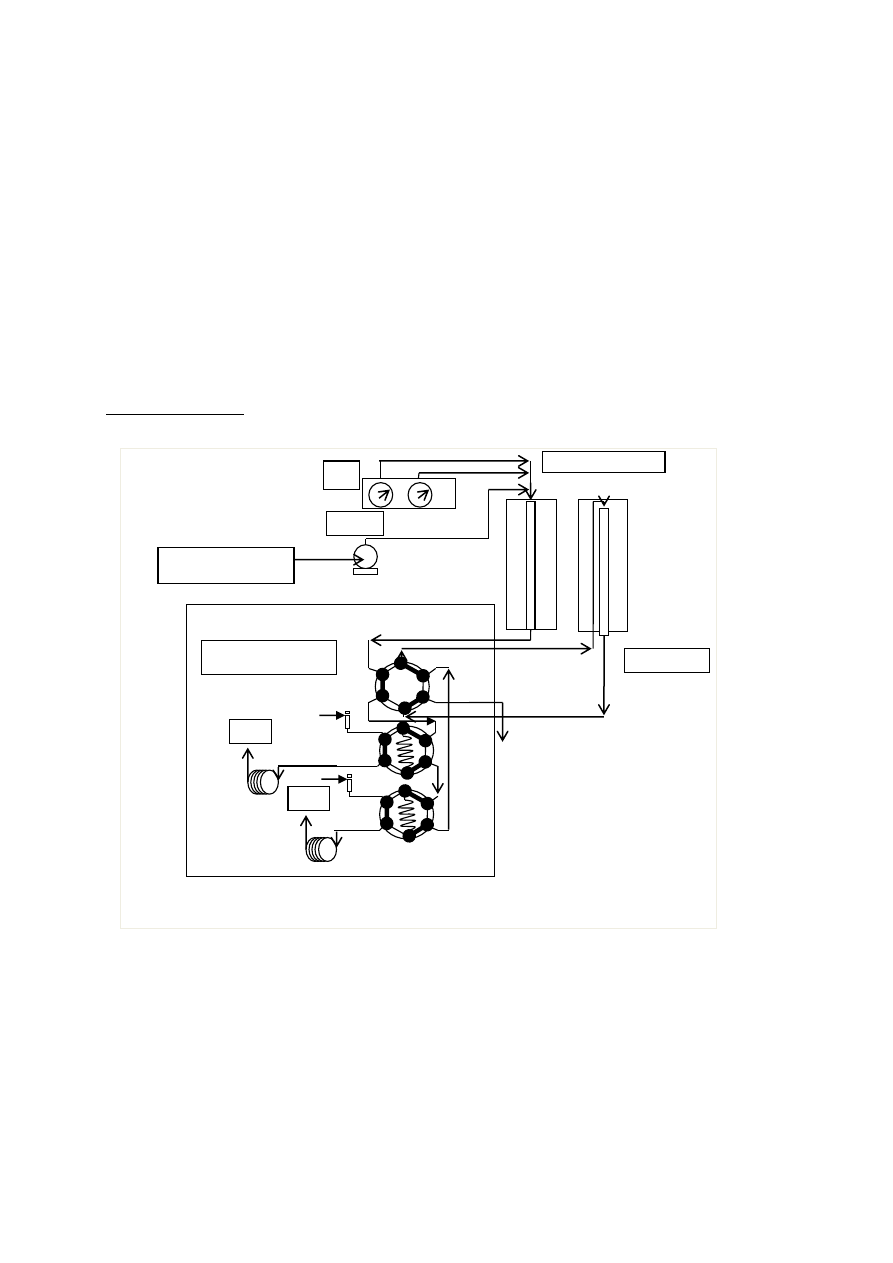
Schemat aparatury
Mieszanina etanolu i wody w stosunku 1:6 podawana jest za pomocą pompy do
podgrzewacza, gdzie zamieniana jest w parę i miesza się z gazem (N
2
). Następnie za pomocą
zaworu sterującego mieszanina z podgrzewacza dostaje się do złoża katalizatora w reaktorze i
zachodzi reakcja w temp.500°C
Opracowanie wyników
W sprawozdaniu należy zamieścić wyniki (chromatogramy) z przeprowadzonych analiz,
obliczone na ich podstawie konwersje oraz selektywności (wzory do obliczeń poniżej) oraz
wykresy.
FID
TCD
CHROMATOGRAF
H
2
O +ETANOL
H
2
N
2
PODGRZEWACZ
REAKTOR

Konwersja etanolu (EtOH)
K=(EtOH
In
-EtOH
out
/EtOH
In
)×100%
EtOH
In –
pole powierzchni piku etanolu na wejściu do reaktora
EtOH
out
– pole powierzchni piku po wyjściu z reaktora
Selektywność reakcji do poszczególnych produktów
S
i
=(i/∑i)×100%
i - pole powierzchni piku produktu „i”
∑i – suma pól powierzchni pików wszystkich produktów
Wykresy:
Konwersja EtOH w funkcji czasu reakcji
Selektywność poszczególnych produktów w funkcji czasu reakcji
Literatura
[1] Haryanto A., Fernando S., Murali N., Adhikari S. : Current status of hydrogenproduction
techniques by steam reforming of ethanol: a review. Energy & Fuels 2005, 19, 2098 – 2106
[2]Lis J .,Nauka o materiałach wykład XIII;
http://cb6-181.ceramika.agh.edu.pl/kco/nowa/nom_XIII.pdf
[3] Lewandowski W. M. : Proekologiczne odnawialne źródła energii. Warszawa,
Wydawnictwa Naukowo-Techniczne, wydanie trzecie, zm.
[4] Cowper C.J>, DeRose A.J. „Chromatograficzna analiza gazów”WNT Warszawa 1988
Wyszukiwarka
Podobne podstrony:
PLTRNiW cwiczenie 1
PLTRNiWII cwiczenie 2 id 362979
3 ćwiczenia BADANIE asfaltów
Ćwiczenie7
Cwiczenia 2
Ćwiczenia V
metody redukcji odpadów miejskich ćwiczenia
Ćwiczenia1 Elektroforeza
cwiczenia 9 kryzys
Ćwiczenia 1, cz 1
Ćwiczenie 8
9 ćwiczenie 2014
Cwiczenie 1
więcej podobnych podstron