
strona 1/8
Data utworzenia: 2008-11-30
Budowa atomu
Wiązania chemiczne
Dorota Lewandowska, Anna Warchoł, Lidia Wasyłyszyn
Treść podstawy programowej:
Budowa atomu: jądro i elektrony, składniki jądra, izotopy. Promieniotwórczość i jej różnorodne
konsekwencje. Atomy, jony i cząsteczki, pierwiastki i związki chemiczne, symbole chemiczne, warto-
ściowość pierwiastków. Wiązania chemiczne – jonowe i atomowe.
Zadania
Część A (0–5) – Standard I
Zadanie 1.
Stwierdzenie, które najlepiej opisuje atom, to:
część materii pozbawiona ładunku elektrycznego
A.
cząstka elementarna o masie równej około 1 [u]
B.
najmniejsza część pierwiastka chemicznego zachowująca jego właściwości
C.
najmniejsza część związku chemicznego zachowująca jego właściwości
D.
Zadanie 2.
Jądro atomowe zbudowane jest z:
dodatnio naładowanych neutronów i obojętnych protonów
A.
dodatnio naładowanych protonów i obojętnych neutronów
B.
dodatnio naładowanych protonów i ujemnie naładowanych elektronów
C.
ze wszystkich wymienionych cząstek (protonów, neutronów i elektronów)
D.
Zadanie 3.
Izotop węgla
14
C wykorzystywany jest do określenia wieku substancji pochodzenia organicznego.
Izotop ten różni się od izotopu
12
C:
liczbą atomową
A.
liczbą elektronów w atomie
B.
liczbą protonów w jądrze atomowym
C.
liczbą neutronów
D.
strona 2/8
Data utworzenia: 2008-11-30
Zadanie 4.
Jon naładowany ujemnie to:
proton
A.
anion
B.
kation
C.
elektron
D.
Zadanie 5.
5. Symbol chemiczny to skrót nazwy łacińskiej pierwiastka chemicznego. Prawidłowe przyporządko-
wanie nazwom pierwiastków ich symboli to:
magnez – Mg, węgiel – Cu, fosfor – P
A.
potas – P, siarka – S, wodór – W
B.
chlor – Cl, krzem – K, azot – N
C.
żelazo – Fe, wapń – Ca, sód - Na
D.
Część B (0–5)
– Standard II, III i IV
Zadanie 6.
Pierwiastek siarka jest mieszaniną czterech trwałych izotopów:
32
S,
33
S,
34
S i
36
S. Najwięcej neutro-
nów zawierają atomy siarki o liczbie masowej:
32
A.
33
B.
34
C.
36
D.
Zadanie 7.
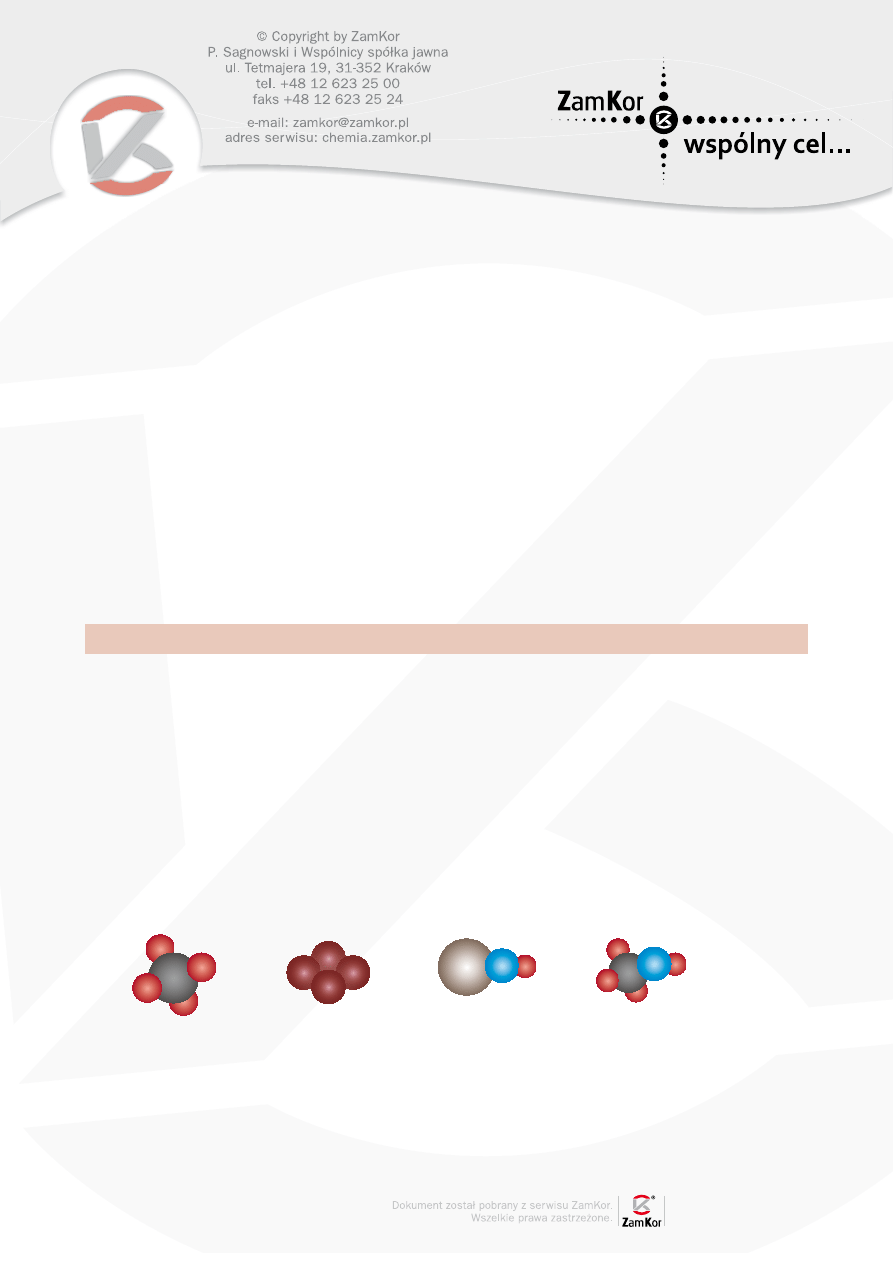
Cząsteczkę pierwiastka chemicznego przedstawia rysunek:
B.
C.
D.
A.
Zadanie 8.
8.
Wartościowość pierwiastka X w zapisie X
2
S
5
wynosi:
dwa
A.
trzy
B.
pięć
C.
siedem
D.

strona 3/8
Data utworzenia: 2008-11-30
Zadanie 9.
Rysunek przedstawia uproszczony model atomu magnezu:
+
12 p
12 n
-
2 e
-
8 e
-
2 e
Kation magnezu Mg
2+
przedstawiono na rysunku:
A.
+
12 p
12 n
-
2 e
-
8 e
B.
+
10 p
12 n
-
2 e
-
8 e
-
2 e
C.
+
14 p
12 n
-
2 e
-
8 e
-
2 e
D.
+
12 p
12 n
-
2 e
-
6 e
Zadanie 10.
Wagon kolejowy zawiera ładunek oznaczony symbolem:
Znak ten oznacza, że ładunek przewożony w tym wagonie:
jest przyjazny dla środowiska
A.
jes
B.
t łatwopalny
jest radioaktywny,
C.
jest wybucho
D.
wy.
strona 4/8
Data utworzenia: 2008-11-30
Odpowiedzi na pytania testowe zakreśl w poniższej tabeli:
1
2
3
4
5
6
7
8
9
10
A
A
A
A
A
A
A
A
A
A
B
B
B
B
B
B
B
B
B
B
C
C
C
C
C
C
C
C
C
C
D
D
D
D
D
D
D
D
D
D
Część C (0–5) Standard II
Jaki to pierwiastek?
Tabela przedstawia wybrane informacje o trzech pierwiastkach chemicznych:
Nazwa
Liczba atomowa
Liczba masowa
Wartościowość
sód
11
23
I
żelazo
26
56
III
cynk
30
65
II
Zadanie 11. (0–3)
Podaj symbol pierwiastka którego atom zawiera 30 neutronów. Zapisz wzór sumaryczny jego tlenku,
oraz jego nazwę chemiczną.
............................... – ...................................... – .................................................
symbol pierwiastka
wzór sumaryczny tlenku
nazwa tlenku
Izotopy
Zadanie 12. (0–2)
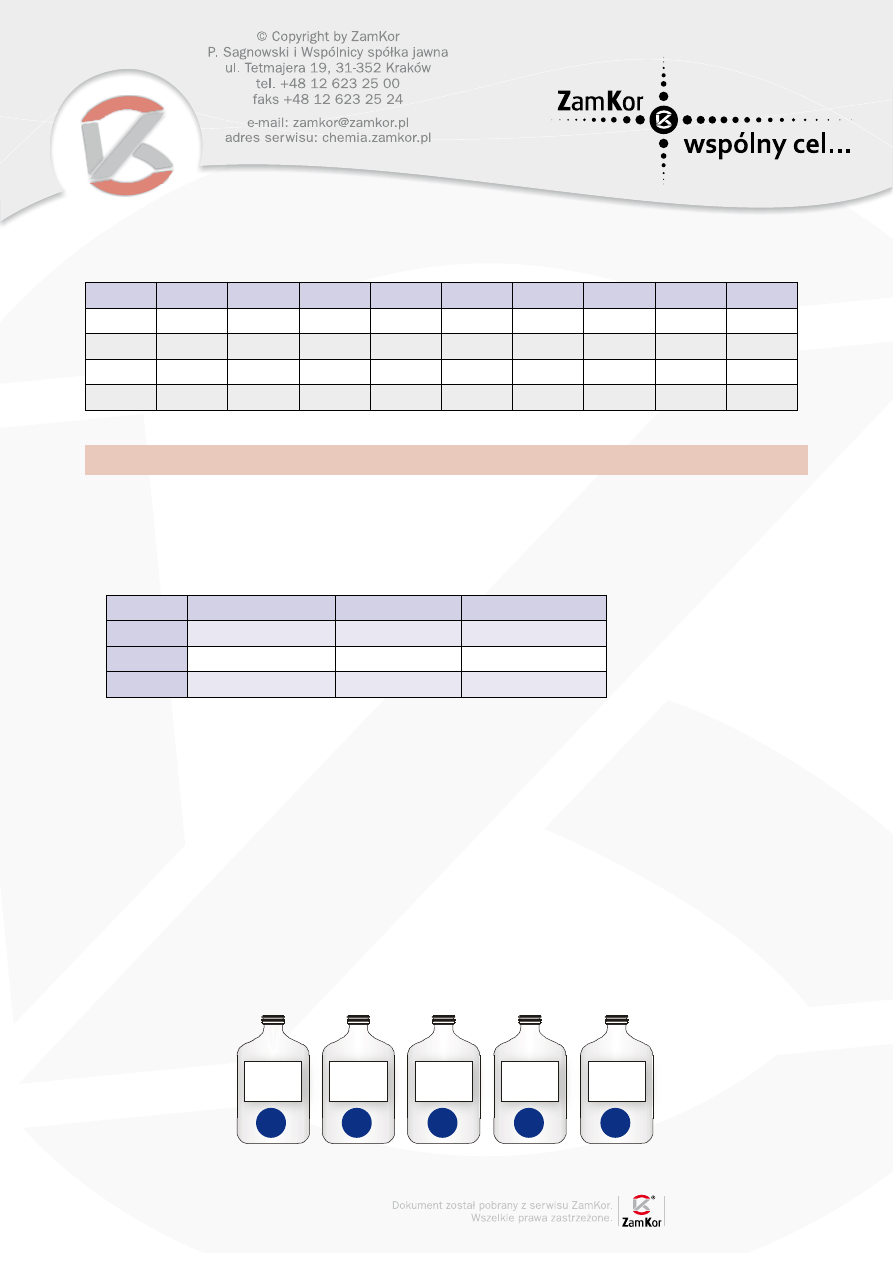
W pewnym laboratorium pierwiastki chemiczne oznaczano w nietypowy sposób. Na półkach stały
butelki z następującymi etykietami:
33
16
X
40
19
X
31
15
X
34
16
X
40
20
X
1
2
3
4
5

strona 5/8
Data utworzenia: 2008-11-30
Słoiki zawierające izotopy to: .................................................................................................
Butelka nr 3 zawiera atomy pierwiastka zbudowanego z ........... protonów, ........... elektronów
i ............. neutronów.
Część D (0–5) – Standard III
Wiązania chemiczne
Atomy takich samych lub różnych pierwiastków łączą się ze sobą tworząc cząsteczki. Niektóre
związki chemiczne posiadają budowę krystaliczną tzn. zbudowane są z jonów. Sposób połączenia
pierwiastków zależy od rodzaju wiązań.
Zadanie 13. (0–2)
Wskaż zdania prawdziwe opisujące wiązania chemiczne.
Wiązanie jonowe tworzy się pomiędzy pierwiastkami o podobnych właściwościach.
A.
Wiązanie jonowe powstaje wtedy, gdy jeden z pierwiastków przekazuje drugiemu elektrony
B.
Tworzeniu wiązań atomowych towarzyszy uwspólnianie par elektronowych.
C.
Wiązania atomowe tworzą się pomiędzy pierwiastkami o właściwościach skrajnie różnych
D.
– pomiędzy metalami i niemetalami.
Zdania prawdziwe to zdania: ...........................................
Zadanie 14. (0–2)
Przedstaw graficznie sposób powstawania wiązań w chlorku magnezu.
............................................................................................................................................
............................................................................................................................................
............................................................................................................................................
............................................................................................................................................
............................................................................................................................................
Zadanie 15. (0–1)
Przedstaw graficznie sposób powstawania wiązań w cząsteczce wodoru.
............................................................................................................................................
............................................................................................................................................
............................................................................................................................................
............................................................................................................................................
............................................................................................................................................
............................................................................................................................................

strona 6/8
Data utworzenia: 2008-11-30
Część E – Standard IV
Blaski i cienie promieniotwórczości 1
„ ... Sto lat minęło od odkrycia zjawiska promieniotwórczości, jednak wobec całej historii ludzkości
to zaledwie chwila. Z całą pewnością możemy powiedzieć, że jest to „chwila” bardzo ważna, nawet de-
cydująca o dalszych losach naszego świata. Nikt nie potrafi przewidzieć przebiegu dalszych wydarzeń,
ale w największym uproszczeniu możemy przedstawić dwie wersje...”
Zadanie 16. (0–3)
Dokończ myśl autora powyższego cytatu:
Sposoby wykorzystania promieniotwórczości dla dobra ludzkości to:
1. ........................................................................................................................................
.........................................................................................................................................
2. ........................................................................................................................................
.........................................................................................................................................
Zagrożenia związane z promieniowaniem jądrowym to:
1. ........................................................................................................................................
.........................................................................................................................................
2. .........................................................................................................................................
.........................................................................................................................................
Zadanie 17. (0–2)
Pewien pierwiastek chemiczny występuje w przyrodzie w postaci dwóch izotopów:
35
E i
37
E. Zawar-
tość lżejszego izotopu wynosi 75,53%, a cięższego 24,47%. Wiedząc, że masę atomową pierwiastka
można obliczyć jako sumę iloczynu liczb masowych izotopów i procentowej ich zawartości podzielonej
przez 100%, oblicz masę atomową pierwiastka oznaczonego symbolem E. Co to za pierwiastek che-
miczny? (Wskazówka: skorzystaj z układu okresowego pierwiastków).
............................................................................................................................................
............................................................................................................................................
............................................................................................................................................
............................................................................................................................................
............................................................................................................................................
............................................................................................................................................
1 A. Czerwiński,
Blaski i cienie promieniotwórczości, WSiP

strona 7/8
Data utworzenia: 2008-11-30
Odpowiedzi i kryteria punktowania
Zadania zamknięte – część A i B
Lp
Sprawdzana umiejętność
Prawidłowa
odpowiedź
1
Wskazanie najlepszego opisu atomu
C
2
Wskazanie cząstek elementarnych budujących jądro atomowe
B
3
Wskazanie różnicy pomiędzy izotopami tego samego pierwiastka
D
4
Wskazanie nazwy jonu o ładunku ujemnym
B
5
Przyporządkowanie pierwiastkom chemicznym ich symboli
D
6
Wskazanie atomu izotopu siarki o największej liczbie neutronów
D
7
Odróżnienie cząsteczki pierwiastka od cząsteczki związku chemicznego
B
8
Określenie wartościowości pierwiastka na podstawie wzoru sumarycznego
C
9
Wskazanie rysunku przedstawiającego kation magnezu
A
10
Interpretowanie znaku ostrzegającego przed substancją radioaktywną
C
Zadania otwarte – Część C, D i E
Lp
Kryteria oceniania
Suma
punktów
za zadanie
Przykładowe rozwiązanie
Uwagi
11
1 pkt – wskazanie właściwego
pierwiastka
1 pkt – zapisanie wzoru
sumarycznego
1 pkt – zapisanie nazwy tlenku
3
Fe
Fe
2
O
3
tlenek żelaza(III)
12
1 pkt – wskazanie izotopów
1 pkt – podanie liczby wszystkich
cząstek elementarnych
2
słoiki 1 i 4,
15 protonów
15 elektronów
16 neutronów
13
1 pkt – wskazanie prawidłowego
zdania
2
Zdania prawdziwe to zdania: B, C
14
1 pkt – zapis symboli Mg, Cl
uwzględniających elektrony
walencyjne
1 pkt – zaznaczenie kierunku
przekazywania elektronów
2
15
1 pkt – graficzne przedstawienie
wiązania w cząsteczce
wodoru
1
H H
Cl
Cl
Cl-
Cl-
Mg
Mg
2+
+

strona 8/8
Data utworzenia: 2008-11-30
Lp
Kryteria oceniania
Suma
punktów
za zadanie
Przykładowe rozwiązanie
Uwagi
16
1 pkt – za uzupełnienie 2 okien
tabeli
2 pkt – za uzupełniane 3 okien
tabeli
3 pkt – za uzupełniane 4 okien
tabeli
3
Sposoby wykorzystania promieniotwórczo-
ści dla dobra ludzkości:
diagnostyka medyczna
•
leczenie chorób nowotworowych
•
(radioterapia)
określanie wieku skał i minerałów
•
źródło energii
•
Zagrożenia związane z promieniowaniem
jądrowym:
broń jądrowa i termojądrowa
•
nieprawidłowa eksploatacja elektrowni
•
może prowadzić do katastrofy
odpady promieniotwórcze
•
Podanie
jednego z wy-
mienionych
powodów lub
każdego inne-
go prawdziwe-
go argumentu
17
1 pkt – obliczenia masy atomowej
pierwiastka E
1 pkt – zidentyfikowanie pierwiastka
2
(75,53% • 35 + 24,47% • 37) : 100% =
= 35,489 (35,5u)
chlor (Cl)
Podanie
nazwy lub
symbolu
Wyszukiwarka
Podobne podstrony:
7 BUDOWA ATOMU I PROMIENIOTW ôRCZO Ü ć zadania maturalne
budowa atomu przykładowe zadania(1)
8. budowa atomu pow+éoki i elektrony zadania maturalne, Chemia
BUDOWA ATOMU, WIĄZANIA zadania
atom - budowa i przemiany zadania2 , Budowa atomu
atom - budowa i przemiany zadania , Budowa atomu
zadania dodatkowe - budowa atomu, ……………………&h
7 BUDOWA ATOMU I PROMIENIOTW ôRCZO Ü ć zadania maturalne
Wykład 1, budowa atomu, wiązania chemiczne
chemia budowa atomu
BUDOWA ATOMU teoria
Chemia II Budowa atomu
budowa atomu(1)
budowa atomu I
Budowa atomu ćwiczenie 5
budowa atomu
więcej podobnych podstron