Budowa atomu_ćwiczenie 5
1. (0 – 3pkt) W podanym schemacie uzupełnij brakujące symbole nuklidów oznaczone literami X, Y, Z.
U
Y
Z
X
236
92
_
………………………………………………………………………………………………………………...
2. (0 – 2pkt) Najwyższy stopień utlenienia pierwiastka X wynosi +VI, a najniższy stopień utlenienia jest
równy –II. Ten pierwiastek znajduje się w 3 okresie.
a) Napisz konfigurację elektronową pierwiastka X. ……………………………………………………...
b) Podaj symbol gazu szlachetnego, którego atom ma taką samą konfigurację elektronową, jak jon
2
X
……………………………………………………………
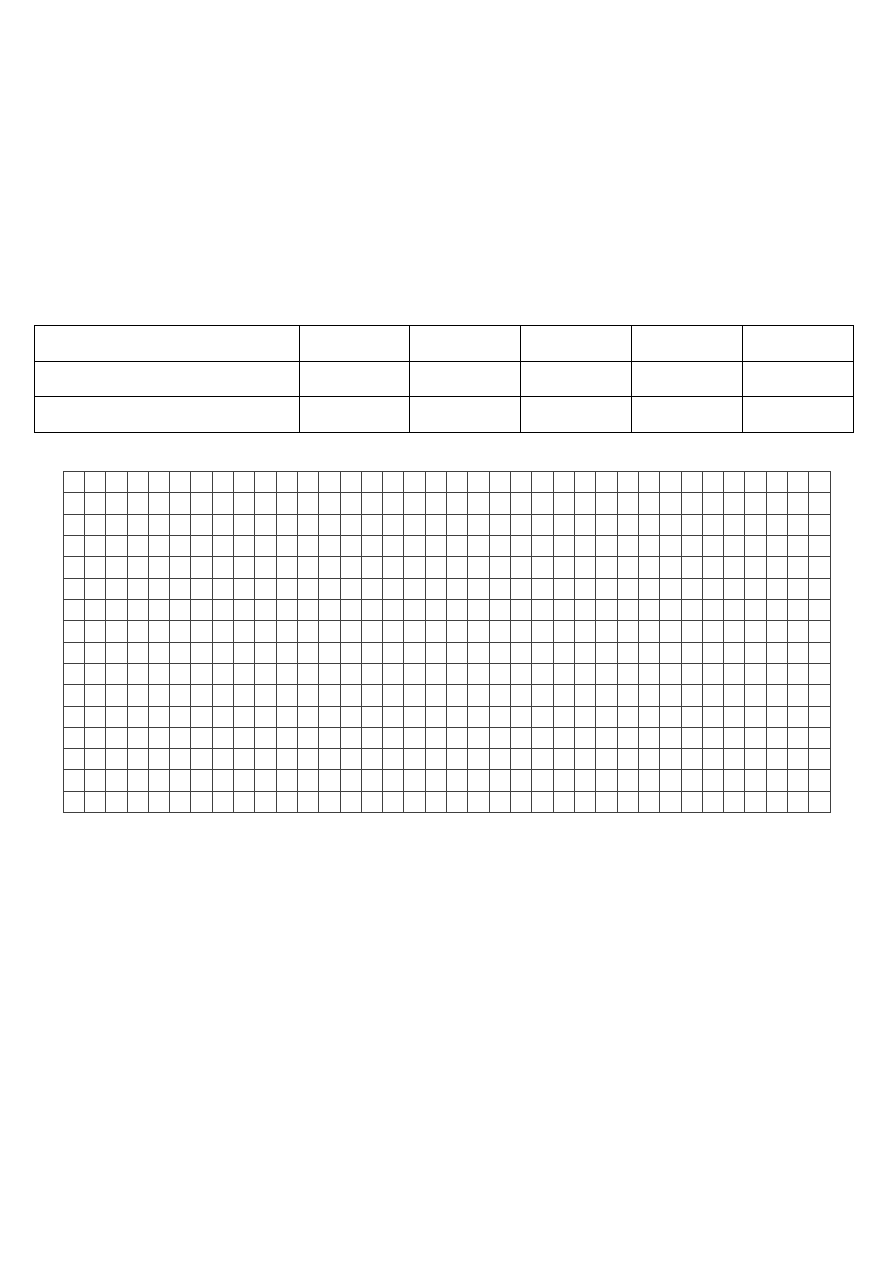
3. (0 – 4pkt) W pojemniku znajduje się 600mg pierwiastka promieniotwórczego, którego okres
połowicznego rozkładu jest równy3,8 dni.
a) Uzupełnij podana tabelę
Masa pierwiastka [mg]
600
37,5
Czas życia pierwiastka [dni]
0
7,6
11,4
Ilość, która ulega rozkładowi [%]
50
b) Narysuj wykres zależności ilości pierwiastka, który uległ rozpadowi, od czasu trwania rozpadu
c) Odczytaj z wykresu, ile czasu trwa proces rozpadu, w którym 30% próbki wyjściowej nie ulegnie
rozpadowi
…………………………………………………………………………………………………………............
4. (0 – 2pkt) Na podstawie konfiguracji elektronowej atomu pierwiastka E (1s
2
2s
2
2p
6
3s
2
3p
1
) określ:
a) numer okresu, w którym jest położony pierwiastek E: ___________________
b) numer grupy, w której jest położony pierwiastek E: _____________
c) liczbę elektronów walencyjnych pierwiastka E: ____________________
d) liczba elektronów należących do zrębu atomowego pierwiastka E: ____________
……………………….....……………………………………………………………………………………...
5. (0 – 2pkt) Poniżej zapisano konfiguracje elektronowe wybranych pierwiastków: Na, Cl, Ne, Ar.
A.
Na
23
11
: 1s
2
2s
2
2p
6
3s
1
;
C.
Ne
20
10
: 1s
2
2s
2
2p
6
;
B.
Cl
35
17
: 1s
2
2s
2
2p
6
3s
2
3p
5
;
D.
Ar
40
18
: 1s
2
2s
2
2p
6
3s
2
3p
6
.
Analizując konfiguracje sodu i chloru uzasadnij, dlaczego chlor jest pierwiastkiem o większej
elektroujemności.
………………………………………………………………………………………….......………………….
………………………………………………….…………………………...…………………………………
...………………………………………………………………………………………………………………
6. (0 – 3pkt) Uczeń przedstawiając konfigurację elektronową trzech pierwiastków, popełnił błędy. Zaznacz te
błędy, podaj poprawny zapis i symbole pierwiastków, które maja takie konfiguracje elektronowe.
1)
2)
3)
7. (0 – 3pkt) Wskaż, których z wymienionych informacji o pierwiastku i budowie jego atomu nie można
odczytać z konfiguracji elektronowej pierwiastka:
1) liczby masowej;
2) liczby atomowej;
3) liczby elektronów walencyjnych;
4) ładunku jądra atomowego;
5) położenia w układzie okresowym (nr okresu, nr grupy, bloku energetycznego);
6) liczby neutronów w jądrze atomowym.
Podaj możliwe informacje dla pierwiastka o konfiguracji elektronowej: 1s
2
2s
2
2p
6
3s
2
3p
4
.
…..………………………………………………………………………………………………………….……....
…..…..………………………………………………………………………………………………………….…..
…..…..………………………………………………………………………………………………………….…..
…..………………………………………………………………………………………………………….……....
…..…..………………………………………………………………………………………………………….…..
…..…..……………………………………………………………………………………………………...............
8. (0 – 3 pkt) Podaj skrócony zapis konfiguracji elektronowej atomu chloru (Cl) oraz wszystkie stany
wzbudzone tego pierwiastka: Cl (III), Cl (V) i Cl (VII). Na podstawie konfiguracji elektronowej wskaż
najbardziej trwałą konfigurację elektronową stanu wzbudzonego lub podstawowego atomu chloru w
związku chemicznym Cl (I) czy Cl (VII). Odpowiedź uzasadnij.
Cl (I) ..................................................................................................................................................................
Cl (III) ..............................................................................................................................................................
Cl (V) ...............................................................................................................................................................
Cl (VII) ..............................................................................................................................................................
Uzasadnienie: ...............................................................................................................................................
......................................................................................................................................................................
......................................................................................................................................................................
………………………………………
………………………………………
……………………………………….
Wyszukiwarka
Podobne podstrony:
Budowa atomu ćwiczenie 4(1)
budowa atomu ćwiczenie 2(1)
budowa atomu ćwiczenie 3
budowa atomu ćwiczenie 1(1)
Wykład 1, budowa atomu, wiązania chemiczne
chemia budowa atomu
BUDOWA ATOMU teoria
Chemia II Budowa atomu
budowa atomu(1)
budowa atomu zadania
budowa atomu I
budowa atomu
więcej podobnych podstron