
1

Joseph Thomson (1856-1940)
Nagroda Nobla z fizyki 1906
za odkrycie elektronu
2
Model Thomsona – „
atomy składają się ujemnie
naładowanych cząstek otoczonych przestrzenią
dodatnią
”

3
Ernest Rutheford (1871-1937)
Nagroda Nobla z chemii 1908
za potwierdzenie istnienia
jądra atomowego
cząstki alfa
folia Au
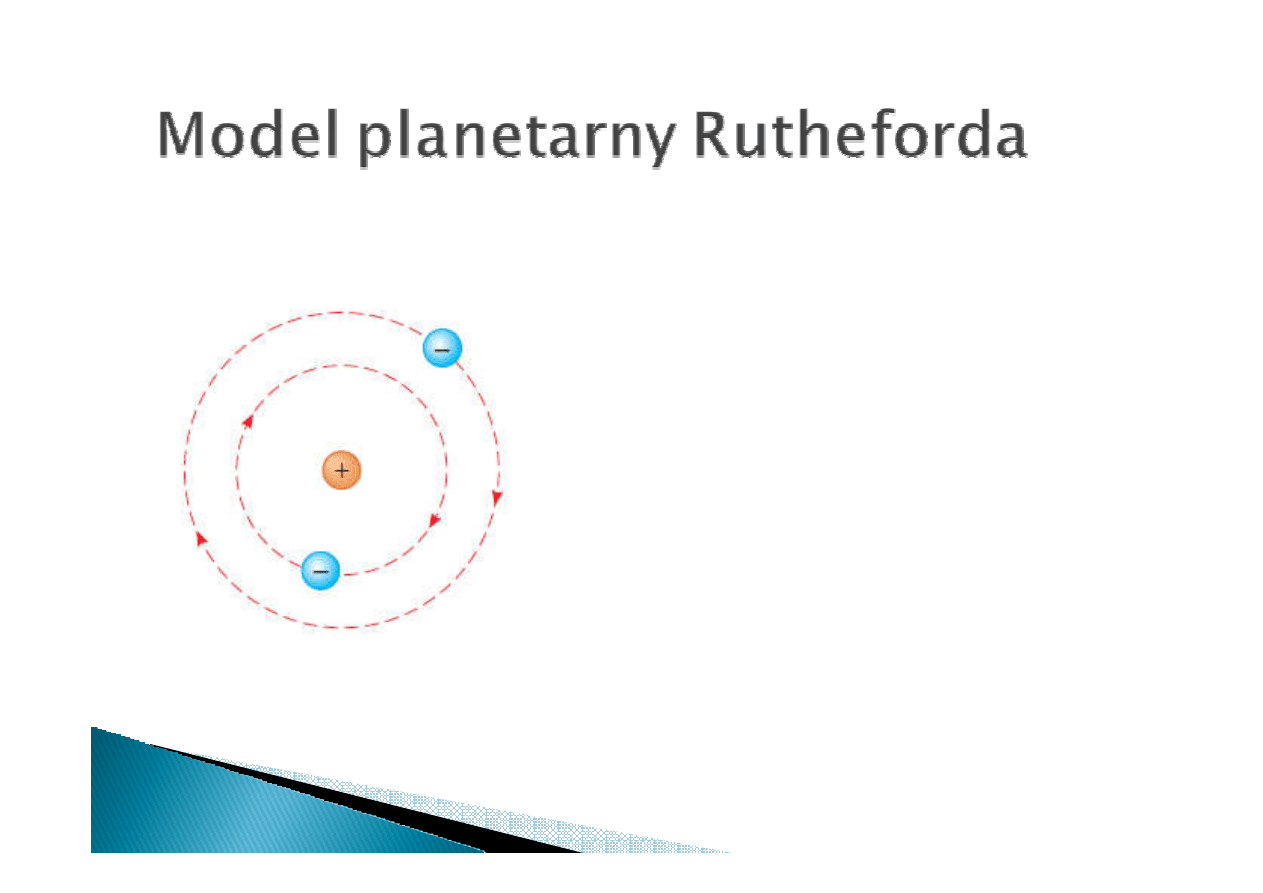
Problemy modelu planetarnego:
Problemy modelu planetarnego:
Problemy modelu planetarnego:
Problemy modelu planetarnego:
•
Wiadomo, że atomy emitują promieniowanie
elektromagnetyczne o ściśle określonych
długościach. Model planetarny nie przewiduje
takiego zachowania
•
W modelu planetarnym elektron krążący wokół
jądra pownien spadać na nie po spiralnym
torze co prowadzi do katastrofy. Atomy w
rzeczywsitości są stabilne.
4
5
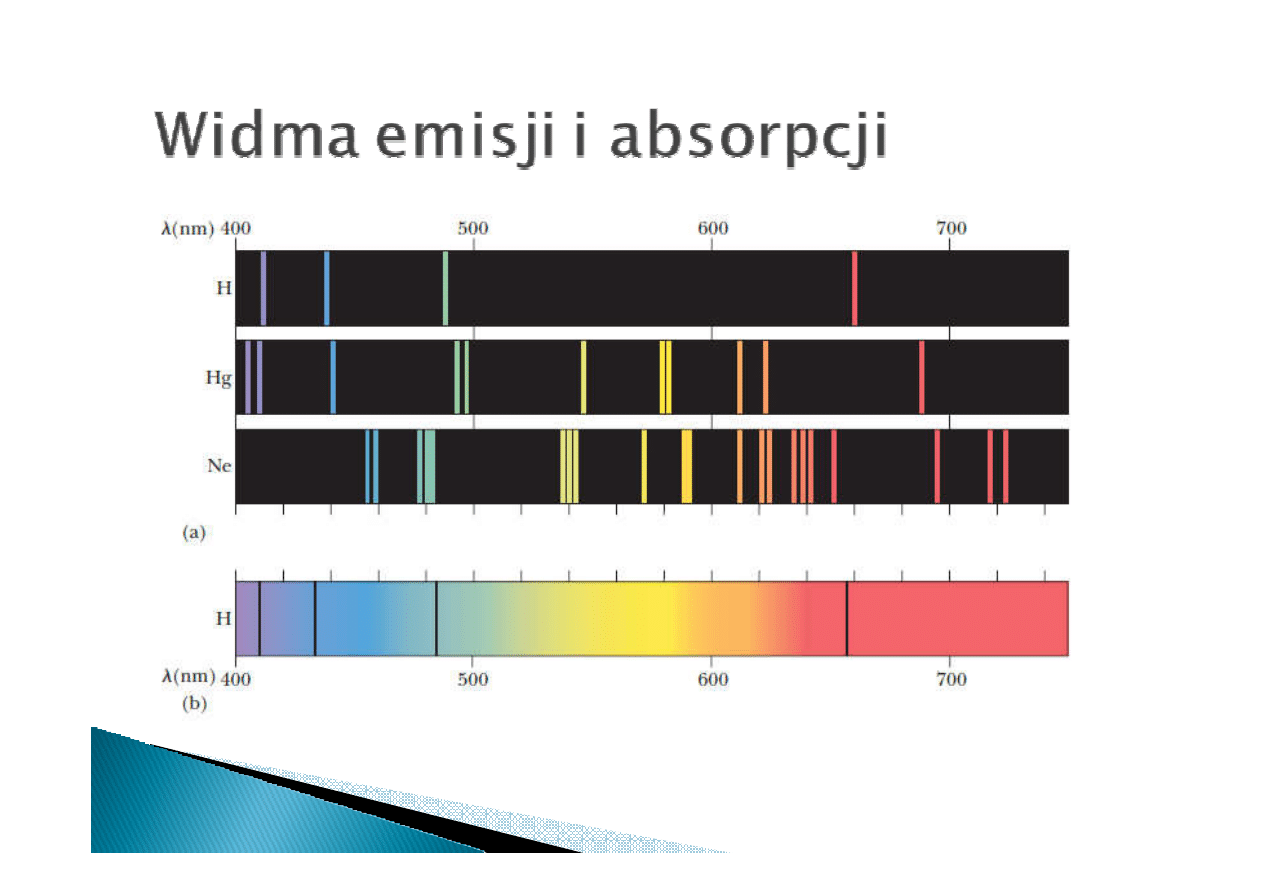
widmo emisji
widmo emisji
widmo emisji
widmo emisji
widmo absorpcji
widmo absorpcji
widmo absorpcji
widmo absorpcji
6
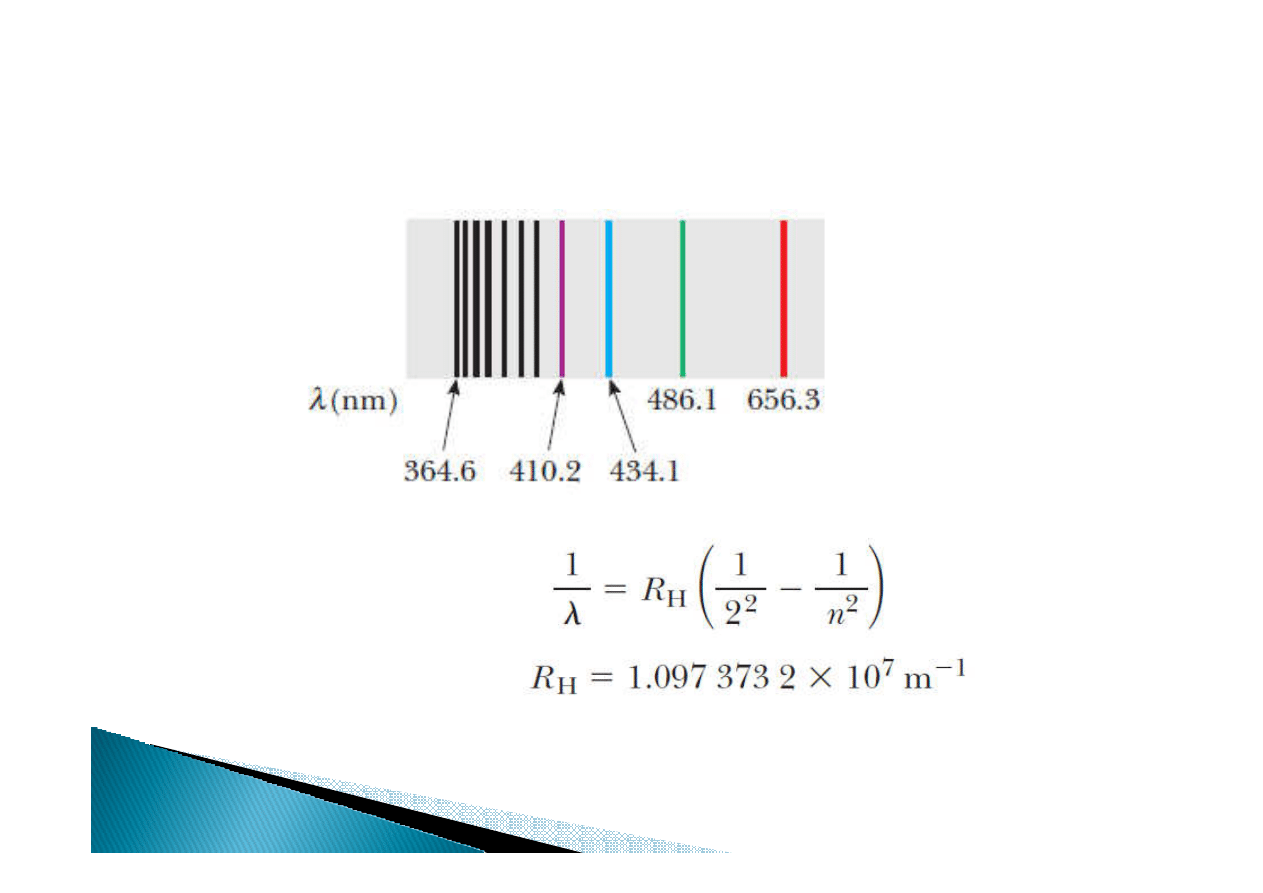
Widma emisji i absorpcji
Widma emisji i absorpcji
Widma emisji i absorpcji
Widma emisji i absorpcji
Widma emisji i absorpcji
Widma emisji i absorpcji
Widma emisji i absorpcji
Widma emisji i absorpcji
R
R
R
R
H
H
H
H
–
––
– Stała Rydberga
Stała Rydberga
Stała Rydberga
Stała Rydberga
Seria Balmera
Seria Balmera
Seria Balmera
Seria Balmera
(zakres widzialny):
(zakres widzialny):
(zakres widzialny):
(zakres widzialny):
Wodór
Wodór
Wodór
Wodór
7
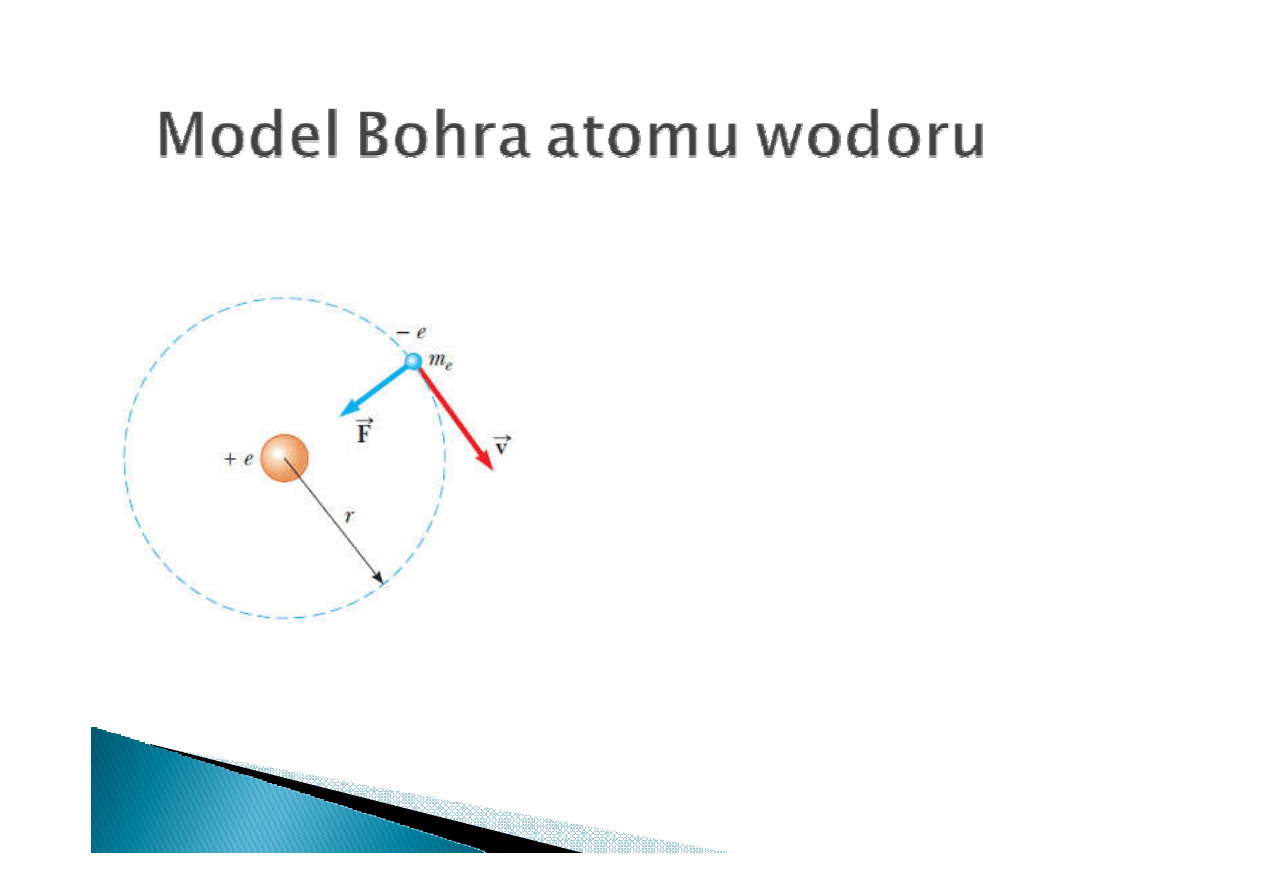
Postulaty Bohra:
Postulaty Bohra:
Postulaty Bohra:
Postulaty Bohra:
1. Elektron porusza się wokół protonu po okręgu
pod wpływem siły Coulomba
2. Tylko niektóre orbity elektronu są dozwolone. Są
to orbity na których elektron nie emituje energii
(promieniowania EM)
3. Promieniowanie EM jest emitowane podczas
przeskoku elektronu z orbity o wyższej energii na
orbitę o niższej energii. Emitowana energia nie
zależy od częstości ruchu elektronu po orbicie:
E
E
E
E
iiii
-
-
-
-E
E
E
E
ffff
=hf
=hf
=hf
=hf (E
i
-energia orbity początkowej, E
f
-
energia orbity końcowej, h stała Plancka, f-
częstotliwość emitowanego promieniowania).
4. Promień orbity wynika ze skwantowania momentu
pędu elektronu względem protonu:
h
n
vr
m
e
=
n=1, 2, 3, …

8
( )( )
r
e
k
r
e
e
k
E
p
2
−
=
−
=
r
e
k
v
m
E
e
2
2
2
−
=
r
e
k
v
m
r
v
m
r
e
k
e
e
2
2
2
2
2
2
2
=
⇒
=
r
e
k
E
2
2
−
=
2
2
2
2
2
r
m
n
v
n
vr
m
e
e
h
h
=
⇒
=
r
m
e
k
v
e
2
2
=
2
2
2
e
km
n
r
e
n
h
=
n=1, 2, 3, …
Energia
potencjalna:
Energia
całkowita:
II zasada
dynamiki
Newtona:
IV postulat
Bohra:
9
nm
ke
m
a
e
0529
.
0
2
2
0
=
=
h
nm
n
a
n
r
n
0529
.
0
2
0
2
⋅
=
=
eV
n
n
e
k
m
E
e
n
2
2
2
4
2
6
.
13
1
2
−
=
−
=
h
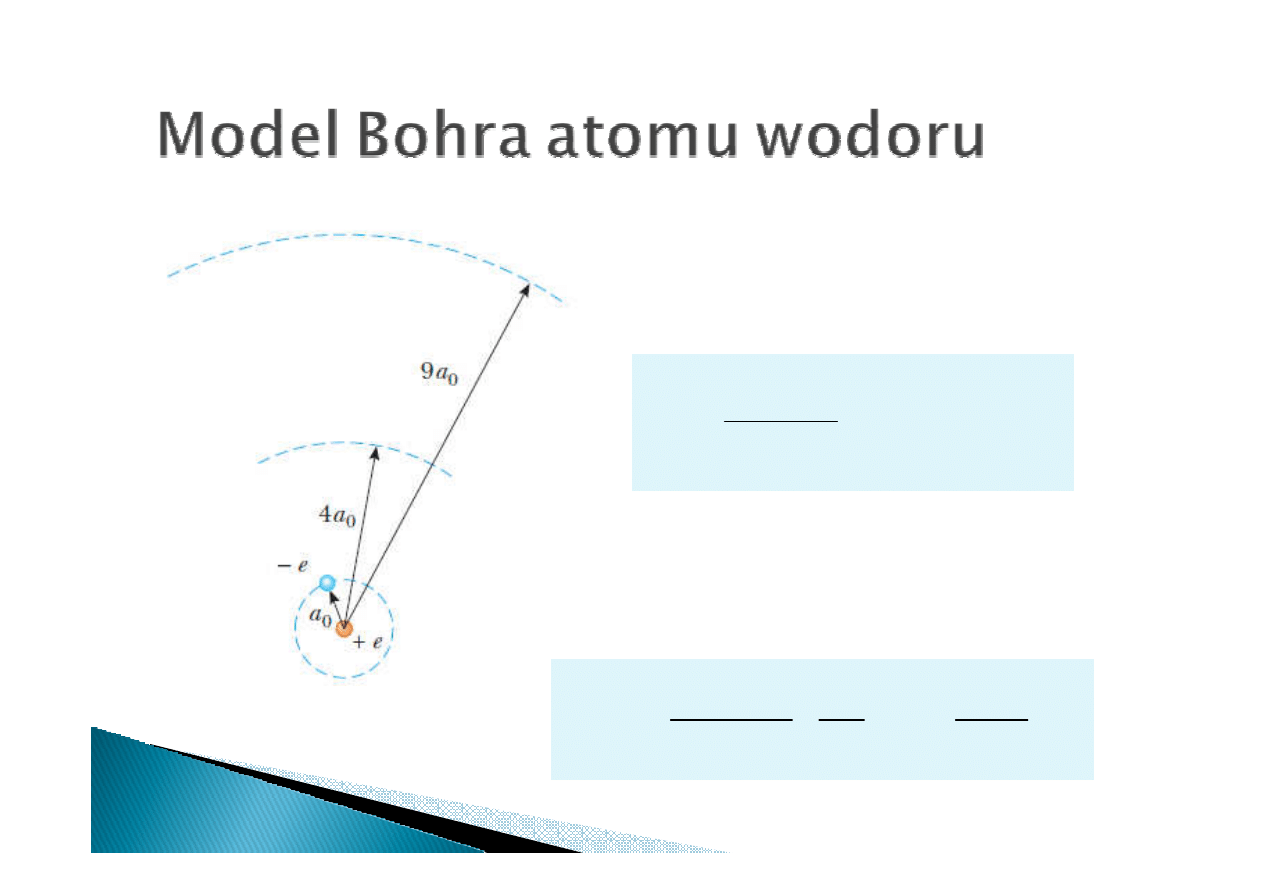
Promień Bohra
Promień Bohra
Promień Bohra
Promień Bohra
(promień atomu wodoru):
Energia n
Energia n
Energia n
Energia n-
-
-
-tej orbity:
tej orbity:
tej orbity:
tej orbity:
10
3
4
2
2
2
3
4
2
2
2
3
4
2
4
1
1
4
1
1
1
4
h
h
h
c
e
k
m
R
n
n
c
e
k
m
c
f
n
n
e
k
m
h
E
E
f
e
H
i
f
e
i
f
e
f
i
π
π
λ
π
=
−
=
=
−
=
−
=
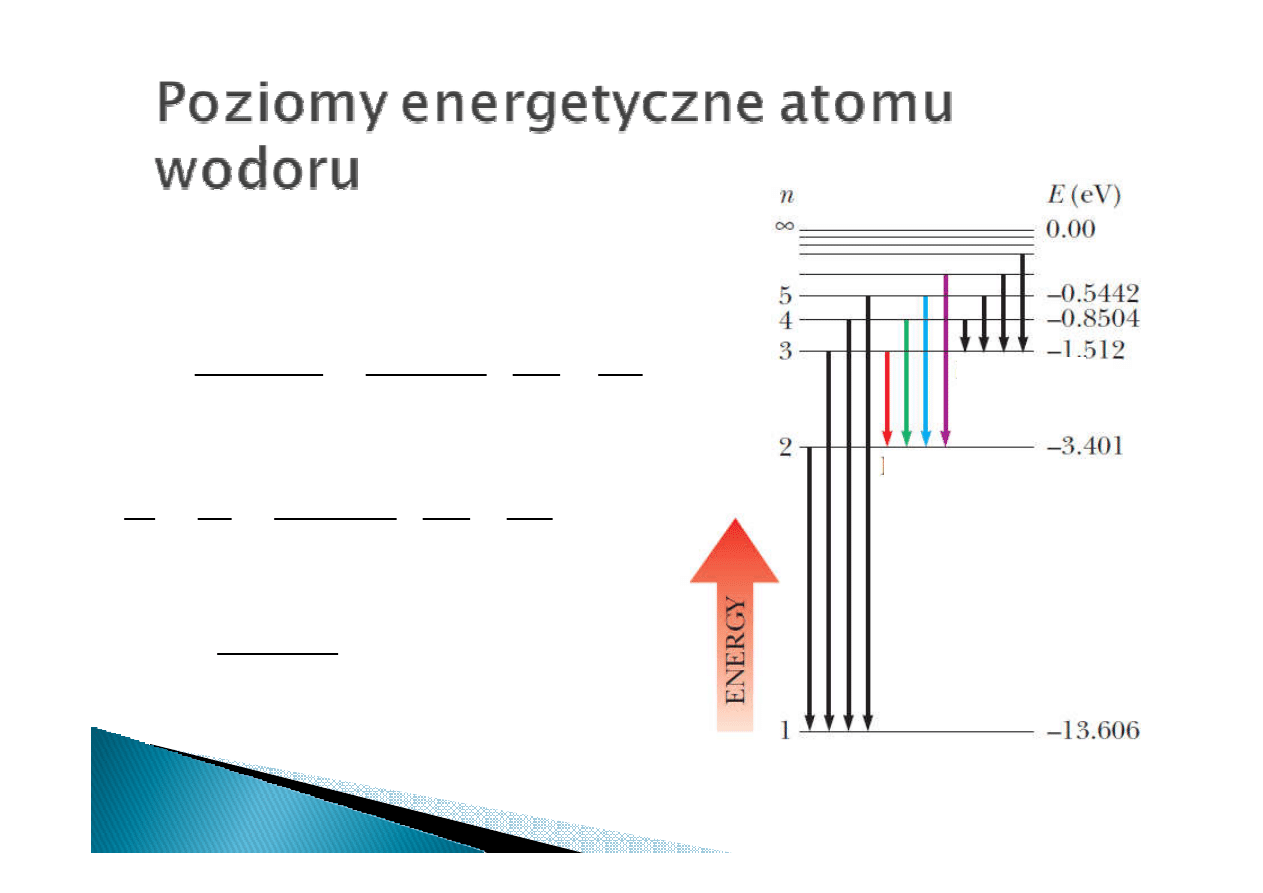
seria
Lymana
seria
Balmera
seria
Paschen
Częstotliwość promieniowania emitowanego
przy przejściu między poziomami:
11
Model Bohra dobrze przewiduje strukturę elektronową wodoru i atomów
wodoropodobnych (jednokrotnie zjonizowany hel, dwukrotnie zjonizowany
lit itd.). Zawodzi jednak w przypadku atomów wieloelektornowych
n
n
n
n-
-
-
- główna liczba kwantowa
główna liczba kwantowa
główna liczba kwantowa
główna liczba kwantowa
l
l
l
l –
––
–orbitalna liczba kwantowa
orbitalna liczba kwantowa
orbitalna liczba kwantowa
orbitalna liczba kwantowa
(odpowiedzialna z spłaszczenie orbity)
orbitalna liczba kwantowa może
przybierać wartości od 0 do n-1
Stany o tej samej liczbie n nazywamy
powłokami
powłokami
powłokami
powłokami.
n=1 powłoka K
n=2 powłoka L
n=3 powłoka M
itd…
m
m
m
m-
-
-
- magnetyczna liczba kwantowa
magnetyczna liczba kwantowa
magnetyczna liczba kwantowa
magnetyczna liczba kwantowa
(rozszczepienie poziomów w obecności
pola magnetycznego). Magnetyczna
liczba kwantowa może przybierać
wartości od –l do l
12
v
m
h
p
h
v
n
r
e
=
=
=
λ
π
2
h
n
vr
m
e
=
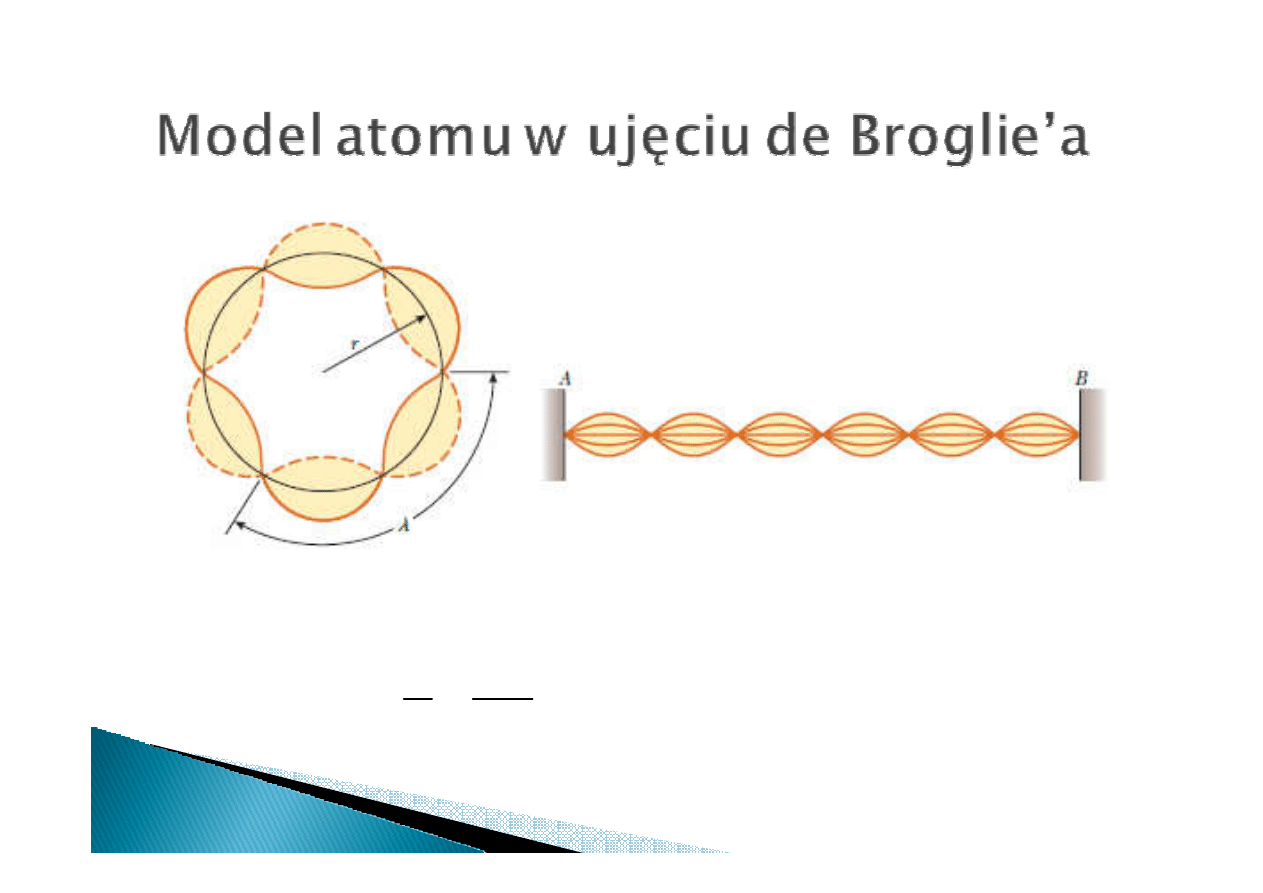
Funkcja falowa elektronu na
orbicie jest falą stojącą
13
liczba kwantowa
liczba kwantowa
liczba kwantowa
liczba kwantowa
nazwa
nazwa
nazwa
nazwa
dozwolone
dozwolone
dozwolone
dozwolone
wartości
wartości
wartości
wartości
ilość
ilość
ilość
ilość
dozwolonych
dozwolonych
dozwolonych
dozwolonych
wartości
wartości
wartości
wartości
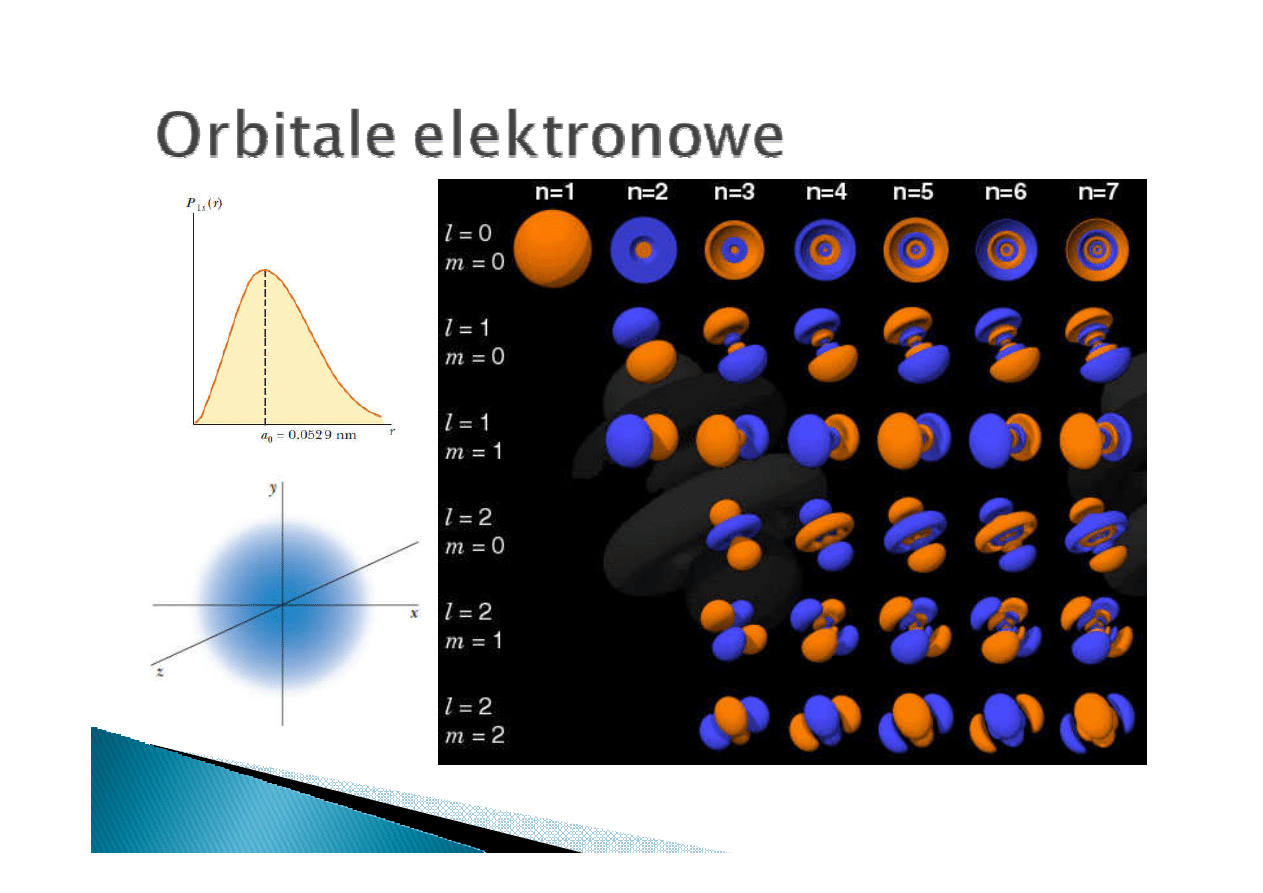
n
główna
1,2, 3, …
nieskończona
l
orbitalna
0,1,2,…, n-1
n
m
magnetyczna
-l, l+1, …, l-1, l
2l+1
Dla każdej głownej liczby kwantowej
Dla każdej głownej liczby kwantowej
Dla każdej głownej liczby kwantowej
Dla każdej głownej liczby kwantowej
n
n
n
n
istnieje
istnieje
istnieje
istnieje
n
n
n
n
2
2
2
2
stanów
stanów
stanów
stanów
o różnych liczbach
o różnych liczbach
o różnych liczbach
o różnych liczbach
llll
i
i
i
i
m.
m.
m.
m.
14
spin do
góry
jądro
jądro
spin do
góry
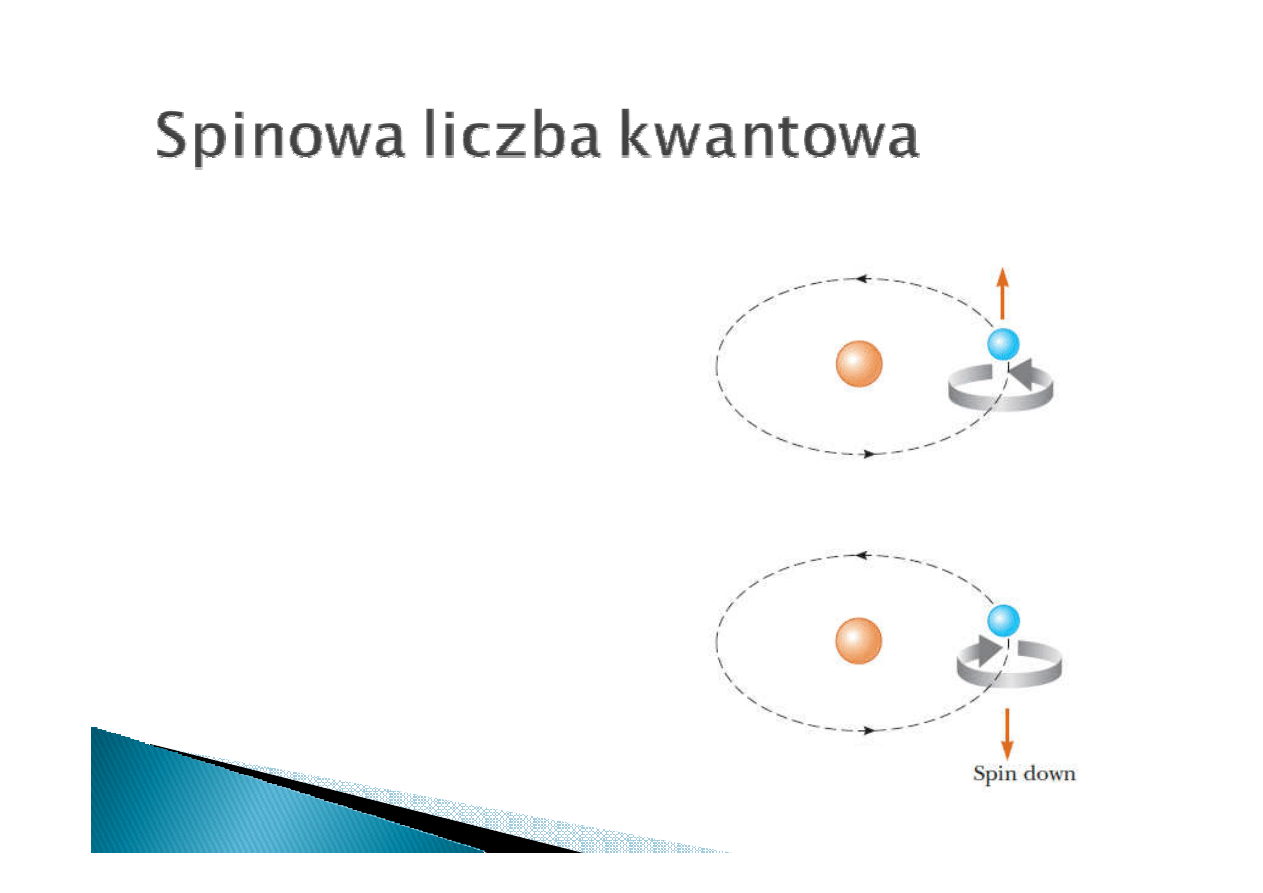
Dla każdego zestawu liczb kwantowych
n, l, m możliwe są dwa stany elektronu
związane z jego spinem
spinem
spinem
spinem-
-
-
- wewnętrznym
wewnętrznym
wewnętrznym
wewnętrznym
momentem pędu.
momentem pędu.
momentem pędu.
momentem pędu.
Spin elektronu opisuje spinowa liczba
spinowa liczba
spinowa liczba
spinowa liczba
kwantowa s
kwantowa s
kwantowa s
kwantowa s
Spinowa liczba kwantowa może
przybierać wartości +1/2 i -1/2
15
Wyszukiwarka
Podobne podstrony:
Wykład 1, budowa atomu, wiązania chemiczne
chemia budowa atomu
BUDOWA ATOMU teoria
Chemia II Budowa atomu
budowa atomu(1)
budowa atomu zadania
Budowa atomu ćwiczenie 5
budowa atomu
7 BUDOWA ATOMU I PROMIENIOTW ôRCZO Ü ć zadania maturalne
Prezentacja o budowach atomu id Nieznany
Zestaw zadań rachunkowych - światło i budowa atomu, kl 1 fizyka
1. Budowa atomu...., chemia(2)
Budowa atomu i wiązania chemiczne test odpowiedzi
4 6 budowa atomu,promieniotwórczosc izotopy
Budowa atomu testy chemia liceum, chemia liceum
Budowa atomu, Chemia
1 1 Budowa atomu Układ Odpowiedzi
budowa-atomu
18.budowa atomu
więcej podobnych podstron