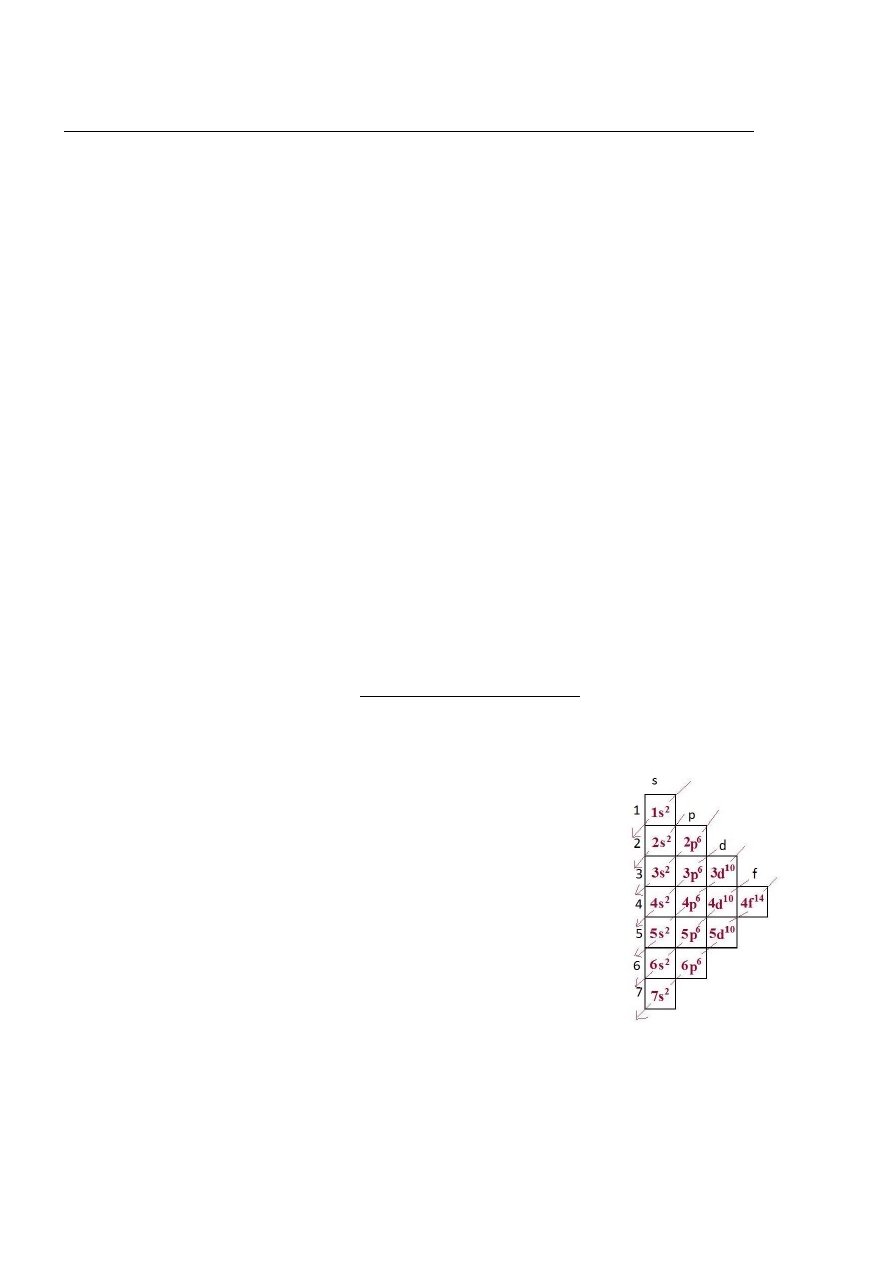
Strona | 1
Chemia
Budowa atomu, pierwiastki, liczba (A, Z), konfiguracja elektronowa, orbitale, związki.
1. Budowa atomu:
Atom jest zbudowany z jądra (naładowanego dodatnio) i zajmujących przestrzeń poza jądrem elektronów. Praktycznie
cała masa atomu skupiona jest w jądrze, gdzie znajdują się protony i neutrony, czyli nukleony. Za zwartą strukturę
atomu odpowiadają siły jądrowe, a elektrony, które krążą w tej samej odległości od jądra, tworzą powłokę elektronową.
W protonach znajdują się kwarki, a elektrony krążące najdalej od jądra to elektrony walencyjne.
Proton (p+) – ciężka cząsteczka elementarna, o dodatnim ładunku elektrycznym.
Elektron (e-) – trwała cząstka elementarna o ładunku ujemnym elektrycznym. Jeden z podstawowych składników
atomu, które krążą wokół jądra wytwarzając wokół chmurę elektronową. Są w ciągłym ruchu!
Jądro atomowe – centralna część atomu skupiająca całą jego masę; złożone z nukleonów (p+, no); ulega rozpadowi
promieniotwórczemu; główne wielkości charakteryzujące: [liczba masowa (A) i liczba atomowa (Z)].
Chmura elektronowa – jest to obszar, w którym istnieje prawdopodobieństwo znalezienia elektronów.
Powłoka elektronowa – jest to część chmury elektronowej, w której prawdopodobieństwo znalezienia elektronów jest
największe. Jest ich maksymalnie 7.
Pierwiastki – są złożone z małych cząsteczek, czyli atomów, mających takie same właściwości chemiczne. Pierwiastek
to substancja chemiczna, składająca się z jednego typu atomów, o tej samej ilości protonów w jądrze. Pierwiastki są
spisane w tak zwanej tablicy Mendelejewa, czyli układzie okresowym pierwiastków, gdzie są zapisane w postaci
skrótów, a ich ułożenie jest zależne od odpowiednich właściwości.
2. Liczba atomowa i liczba masowa
Liczba atomowa (Z) – określa liczbę protonów (p
+
) w jądrze atomu. Ponieważ atom to układ elektrycznie obojętny to
liczba ta określa również liczbę elektronów (e
-
). Często nazywana jest liczbą porządkową, gdyż wyznacza miejsce
danego pierwiastka w układzie okresowym.
Liczba masowa (A) – są to protony (p
+
) i neutrony (n
o
), czyli nukleony wchodzące w skład jądra atomowego. Jest
wyrażona w unitach [u].
Masa atomowa pierwiastka to masa atomu, wyrażona w atomowych jednostkach masy [u], która stanowi średnią
ważoną mas izotopów danego pierwiastka występujących w przyrodzie. Wartość masy atomowej izotopu (m1, m2, …)
zaokrąglona do liczby całkowitej jest równa jego liczbie masowej.
M
1
.... .M
n
- masy atomowe odmian izotopowych
%
1
.... %
n
- zawartości procentowe odmian izotopowych
3. Konfiguracja elektronowa
Jest to sposób rozmieszczenia elektronów na powłokach i podpowłokach, ich
rozmieszczenie zaczyna się od powłoki o najmniejszej energii. Pozwala przewidywać
właściwości i zachowanie pierwiastka w różnych warunkach oraz reakcje, w jakie
może on wchodzić.
Maksymalna liczba elektronów na powłoce to 2n2 n-powłoka
1 2 3 4 5 6 7
POWŁOKA (według odległości
K L M N O P Q od jądra)
ILOŚĆ E 2 8 18 32 50 72 98
Ostatnia powłoka – zajmują ją elektrony walencyjne, które określają wartościowość
pierwiastka, są w stanie „wyrwać” się z atomu.
Powłoka to eliptyczny tor, po którym porusza się elektron. Może rozszczepiać się na
podpowłoki.
4. Elektrony walencyjne
To elektrony na ostatniej powłoce, są najbardziej ekranowane, najbardziej osłaniane przez powłoki od jądra. Określają
one wartościowość pierwiastka i są, jako jedyne, w stanie „wyrwać” się z atomu. Na przykład wodór, mając tylko jeden
elektron, jest to elektron walencyjny. Ilość elektronów walencyjnych określa grupa, w której znajduje się dany
pierwiastek.
20
Ca: K
2
L
8
M
8
N
2
20
Ca: 1s
2
2s
2
2p
6
3s
2
3p
6
4s
2
Strona | 2
5. Zapis 3d
3
3 – oznacza numer powłoki, na której znajdują się elektrony.
d – oznacza, iż elektrony znajdują się na orbitalu typu d.
3
– oznacza, iż na orbitalu znajdują się 3 elektrony.
1s
2
2s
2
2p
6
3s
2
3p
6
4s
2
3d
3
- strzałka symbolizuje elektron o określonym spinie (spin związany jest z obrotem elektronu wokół własnej osi).
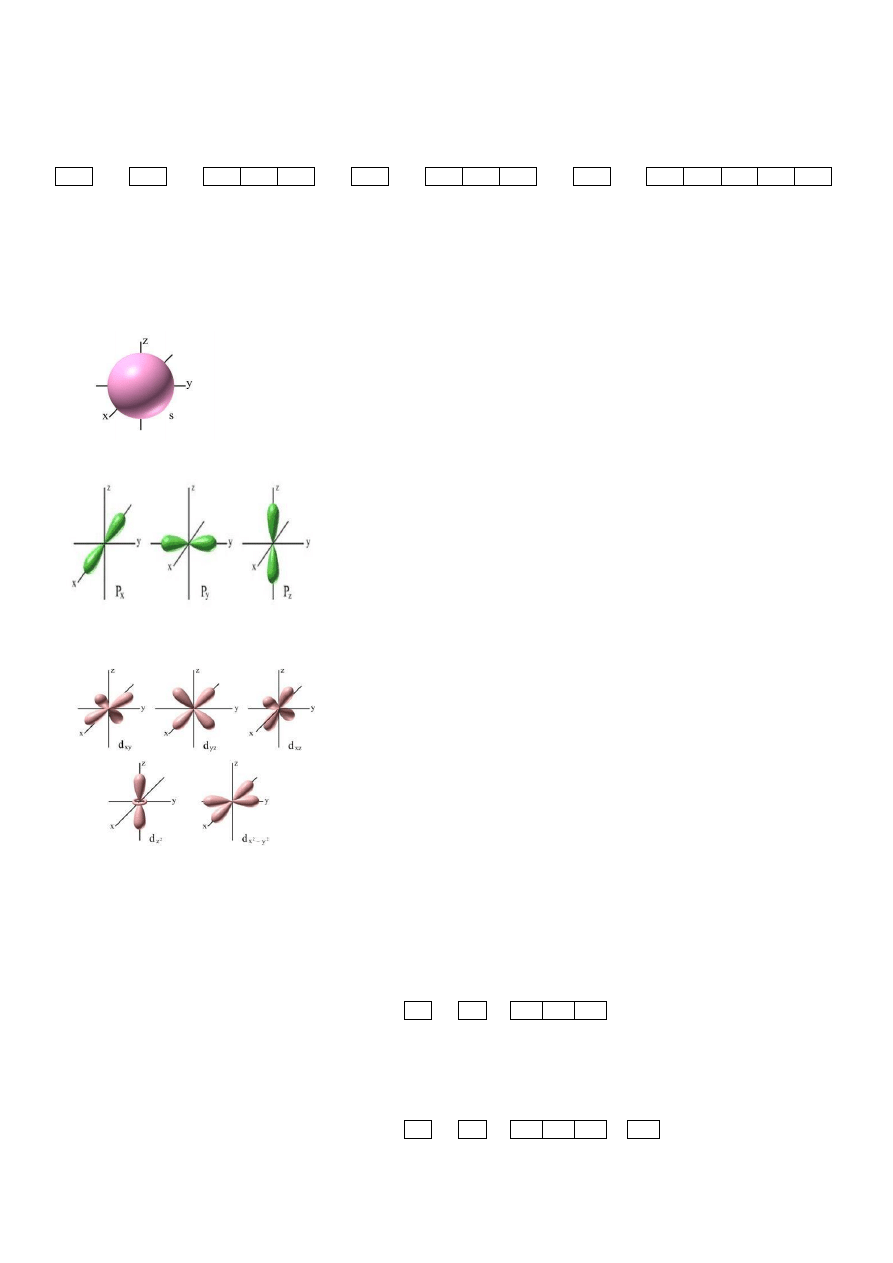
6. Orbitale
Powstają wskutek dzielenia się podpowłok, są schematycznie zapisywane za pomocą klatek. Orbitale to przestrzeń, w
której jest największe prawdopodobieństwo znalezienia elektronów.
Dzielimy je na orbitale:
- s (max. 2 elektrony) – ma najniższy stan energetyczny[kulisty może mieć po 2 elektrony].
- p (max. 6 elektronów) – orientacja przestrzenna [kontury są powłokami o symetrii osiowej względem odpowiednich
osi układu współrzędnych (px, py, pz) - więc na orbitalach typu p maksymalnie może znajdować się sześć elektronów].
- d (max. 10 elektronów) – orientacja przestrzenna, pięciokrotnie zdegenerowany (o jednakowej energii) [ma
skomplikowaną budowę - mamy pięć orbitali typu d - więc na orbitalach typy d maksymalnie może znajdować się 10
elektronów].
- f (max. 14 elektronów) – orientacja przestrzenna [ma jeszcze bardziej skomplikowaną budowę. Mamy 7 orbitali typu f
- więc na orbitalach typu f może znajdowac się maksymalnie 14 elektronów].
7. Reguła Hunda
Liczba niesparowanych elektronów musi być możliwie największa, czyli klatki w schemacie
klatkowym muszą być
zapełniane równomiernie po jednym elektronie o tym samym spinie (kierunku), a dopiero po zapełnieniu wszystkich
klatek dopisuje się po drugim elektronie do wpisanego już poprzednio, zaznaczając odwrotny spin.
8
O 1s
2
2s
2
2p
4
8. Zakaz Pauliego
Spiny, czyli kierunki, elektronów w jednej klatce w schemacie klatkowym konfiguracji elektronowej, muszą być różne.
Tzn. że strzałki symbolizujące elektrony w klatce muszą mieć przeciwne zwroty. A dokładniej, że nie mogą mieć takich
samych (w końcu zakaz).
12
Mg 1s
2
2s
2
2p
6
3s
2
Strona | 3
9. Orbitale zdegenerowane
Orbitale o jednakowej energii, posiadające taką samą charakterystykę energetyczną, prawdopodobieństwo osadzenia
się na każdym z nich elektronu jest dokładnie takie samo. Przykładem może być orbital typu d jest on pięciokrotnie
zdegenerowany.
10. Orbital typu „p”.
Kształt orbitali typu „p” przypomina sferyczne ósemki nabite na poszczególne osie współrzędnych. Istnieje znacznie
większe prawdopodobieństwo spotkania elektronu wewnątrz tego orbitalu, niż na zewnątrz. Ale prawdopodobieństwo
zajęcia orbitalu p
x
, p
y
lub p
z
jest takie samo. Orbital „p” jest trójkątnie zdegenerowany, ze względu na równocenność
energetyczną (orbitale p
x
, p
y
i p
z
maja taką samą energię) orbitali p
x
, p
y
i p
z
. Schematycznie orbital „p” oznacza się za
pomocą trzech klatek, zawierający pojedyncze lub sparowane elektrony.
10.
12
Mg
12
Mg 1s
2
2s
2
2p
6
3s
2
Układ okresowy pierwiastków, struktura, grupy pierwiastków, izotopy, mieszaniny
1) Układ okresowy pierwiastków
Jest to ułożenie tabeli z pierwiastków, według wzrastających liczb atomowych. Pierwiastki posiadają cyklicznie
powtarzające się właściwości. Ich układ składa się z kolumn czyli grup oraz wierszy czyli okresów. Grupy wpisuje się w
kolumnach a okresy w rzędach. Grupy dzielimy na główne i poboczne. Pierwiastki pogrupowane są wg ich cyklicznie
pojawiających się podobieństw właściwości. Nazwy grup biorą się od pierwszego pierwiastka występującego w danej
kolumnie np.: berylowce,... Wyjątkiem jest grupa pierwsza która nazwana jest litowce.
2) Grupy i okresy
Grupy złożone są z pierwiastków o podobnych właściwościach i których atomy mają tyle samo elektronów
walencyjnych (1-18), a okresy zawierają pierwiastki, których atomy mają tą samą liczbę powłok elektronowych (1-7).
Można podzielić go na bloki: s, p, d, f. Blok s obejmuje grupy pierwszą, drugą i hel, blok p obejmuje grupy od trzynastej
do osiemnastej bez helu, blok d obejmuje grupy od trzeciej do dwunastej, blok f tworzą lantanowce i aktynowce. Bloki s
i p to bloki główne. Lewa strona układu okresowego zawiera pierwiastki metaliczne, a im dalej w prawo tym mniej
metalicznie, a w ostatniej grupie są gazy szlachetne.
3) Izotopy
Są to odmiany pierwiastków o tej samej liczbie protonów, a różnej ilości neutronów w jądrze. Podział izotopów: trwałe
(nieulegające samorzutnemu rozpadowi na izotopy innych pierwiastków), nietrwałe (jądra tych atomów są niestabilne
i mogą ulegać samorzutnemu rozpadowi, dając inne atomy) czyli promieniotwórcze. Pierwiastki mają różne ilości
izotopów. Te odmiany pierwiastków różnią się od siebie masą.
4) Izotopy wodoru
Prot, deuter i tryt. Wszystkie mają po jednym protonie i elektronie, ale prot nie ma neutronów, deuter ma jeden
neutron, a tryt ma dwa neutrony. Deuter i prot to izotopy trwałe, a tryt to izotop nietrwały. Izotopy nietrwałe dzieli się
na naturalne i sztuczne (których wytwarzanie zazwyczaj nie jest dobre dla zdrowia, jednak są w stanie zabijać komórki
rakowe).
5) Izotopy promieniotwórcze
Radionuklidy to nuklidy (izotopy) radioaktywne (promieniotwórcze),
Dzielą się na radionuklidy:
naturalne (są tworzone w gwiazdach, szczególnie przy wybuchu supernowej)
sztuczne (wytwarzane przez człowieka głównie w reaktorach jądrowych i akceleratorach). Są stosowane np. w
medycynie, do rozpoznawania i leczenia niektórych chorób, np. raka.
6) Czas połowicznego rozpadu
Określa po jakim czasie zaniknie połowa jąder danego pierwiastka.
Czas ten, oznaczany symbolem T
1/2
, zgodnie z
definicją musi spełniać zależność:
gdzie
N(t) – liczba obiektów pozostałych po czasie t,
N
0
– początkowa liczba obiektów.

Strona | 4
Pierwotnie czas ten dotyczył nietrwałych jąder atomowych pierwiastków (promieniotwórczych). W tym przypadku po
czasie połowicznego rozpadu aktywność promieniotwórcza próbki zmniejsza się również o połowę. Okres
połowicznego rozpadu dotyczy również nietrwałych cząstek. Może być wyznaczony z wykładniczego charakteru
rozpadu, który w przypadku izotopów promieniotwórczych nosi nazwę prawa rozpadu naturalnego.
7) Mieszanina i związek chemiczny
Minimum dwa (może być więcej) pierwiastki lub związki chemiczne, które są ze sobą zmieszane w dowolnych
proporcjach i mają swoje właściwości. Mieszaniny mogą występować w różnych stanach skupienia. Dzielą się na
jednorodne, (homogeniczne, czyli roztwory właściwe) i niejednorodne (heterogeniczne, czyli koloidy i zawiesiny).
Jednorodne połączenie co najmniej dwóch różnych pierwiastków chemicznych za pomocą dowolnego wiązania.
Zapisuje się je w postaci wzorów chemicznych, np. H2S (siarkowodór).
9) Porównanie mieszaniny i związków chemicznych
MIESZANINA
ZWIĄZEK CHEMICZNY
Składniki nie posiadają wiązań między sobą.
Składniki posiadają wiązania między sobą.
Może składać się z ogromnej ilości składników.
Zazwyczaj składają się z niewielu składników.
Składniki można rozdzielić na wiele różnych
sposobów, w tym metodami fizycznymi takimi jak
odparowanie, wytapianie etc.
Można rozdzielić jedynie za pomocą metod reakcji
chemicznych (wymiany, analizy).
Zawiera różne cząstki składowe.
Posiada cząstki ściśle określonego rodzaju.
Wiązania (oddziaływania) chemiczne
1. Reguła oktetu
Mówi o tym, że atomy pierwiastków dążą do tego, aby mieć taką konfigurację elektronową, jak najbliższy im w układzie
okresowym gaz szlachetny (czyli mieć osiem elektronów walencyjnych). Atomy osiągają to przez oddanie, przyjęcie lub
uwspólnienie elektronów z innym atomem. Np. atom magnezu (metal) oddaje 2 elektrony i staje się dodatnim jonem
magnezu.
2. Wiązanie chemiczne
Łączenie się atomów pierwiastków, reagujące atomy muszą zderzać się ze sobą w sposób efektywny.
3. Wiązanie jonowe
Pomiędzy atomami różniącymi się znacznie elektroujemnością, czyli wiązanie pomiędzy atomami metali i niemetali.
Atom o większej elektroujemności przyciąga elektrony atomu o mniejszej elektroujemności. Atom przechwytujący
elektrony staje się anionem, a atom oddający elektrony kationem. Jest to przyciąganie elektrostatyczne różnoimiennie
naładowanych jonów. Przykładem jest wiązanie pomiędzy tlenem i magnezem w tlenku magnezu. Oba atomy uzyskują
wtedy konfigurację elektronową najbliższego helowca.
4. Wiązanie kowalencyjne
Dzielą się na wiązania kowalencyjne atomowe i wiązania kowalencyjne spolaryzowane.
- Spolaryzowane wiązania kowalencyjne występują pomiędzy atomami różnych niemetali (np. HCl), atomy tych
niemetali mają zbliżoną, ale nie identyczną elektroujemność, a para elektronowa połączona tym wiązaniem nie ma
równomiernego rozłożenia, ale bliżej pierwiastka o wyższej elektroujemności. Cechami są np. stały stan skupienia czy
stosunkowo szybko zachodzące reakcje.
- Atomowe wiązania kowalencyjne występują pomiędzy atomami tych samych niemetali o wysokiej i jednakowej
elektroujemności (np. O
2
). Każdy atom dostarcza jeden elektron. Cechami są np. słabe oddziaływanie na siebie atomów
czy stosunkowo wolno zachodzące reakcje.
5. Wiązanie metaliczne
Szczególny rodzaj wiązania między elektrododatnimi metalami, a elektronami, na które oddziałują atomy sąsiednich
pierwiastków. Elektrony (tzw. zdelokalizowane) mogą się swobodnie poruszać i nie mają ustalonego kierunku.
Taki materiał jest dobrym przewodnikiem ciepła i prądu. Przykładem może być kryształ sodu.
6. Wiązanie wodorowe
Słabe wiązanie chemiczne, polegające na przyciąganiu elektrostatycznym między atomem wodoru a atomem
elektroujemnym. Ma duży wpływ na właściwości związków, występuje np. w białkach i kwasach nukleinowych.

Strona | 5
7. Oddziaływania van der Waalsa
Słabe oddziaływanie pomiędzy cząsteczkami niepolarnymi, ma mały zasięg. Są one częściowo odpowiedzialne za stan
skupienia materii. Przykładem są oddziaływania między warstwami sieci krystalicznej grafitu.
8. Wiązanie pi
Powstaje przez boczne nałożenie się na siebie dwóch orbitali p. Wiązania pi występują w wiązaniach wielokrotnych
(dwa lub więcej), a najbardziej prawdopodobne miejsce do znalezienia elektronów to powyżej i poniżej osi łączącej
atomy. Wiązanie pi jest słabsze od wiązania sigma.
9. Wiązanie sigma
Powstaje przez czołowe nałożenie się na siebie orbitali s. A najprawdopodobniejsze miejsce znajdowania się elektronu
to oś łącząca oba atomy.
10. Węgiel w stanie wzbudzonym:
- Konfiguracja: 6C*: 1s
2
2s
1
* 2p
3
*
- Model klatkowy:
Elektron został wzbudzony z 2s do 2p, dzięki czemu jest w stanie utworzyć cztery wiązania.
Stany skupienia materii, wielkości i prawa, teoria pasmowa
1) Gaz
Ciało łatwo zmienia kształt (łatwo jest je uformować, np. powietrze w pokoju przyjmuje kształt pokoju) i zajmuje całą
przestrzeń (nie ma jakby „dziur” pomiędzy powietrzem). To wszystko dzieje się dzięki temu, że cząsteczki mają
swobodę ruchu. Cząsteczki gazu zderzają się ze sobą i ze ściankami naczynia w jakim są zamknięte (np. w zakręconym
słoiku z powietrzem uderzają o szklane ścianki). Cząsteczki gazu poruszają się z różną prędkością, na którą mają wpływ
czynniki takie jak temperatura i ich masa molowa.
2) Ciecz
Stan skupienia pomiędzy gazem a ciałem stałym, ciało ciekłe trudno zmienia objętość, ale łatwo kształt – dostosowuje
się do naczynia, np. w szklance ciecz ma kształt szklanki. Ciecze mają swoje temperatury wrzenia i krzepnięcia, czyli
temperatury, do których jeśli podgrzeje się ciecz, to zaczyna ona zmieniać się w gaz lub ochłodzi, to zamienia się w ciało
stałe.
3) Napięcie powierzchniowe
To zjawisko fizyczne, które występuje tam, gdzie styka się ciecz z ciałem stałym, gazem lub inną cieczą. Przykładem
może być unoszenie się na wodzie niektórych przedmiotów, np. lilii wodnych.
4) Opór elektryczny
To zaburzenie przepływu prądu w przewodniku, wywołane zderzaniem się elektronów z jonami przewodnika. Rośnie
wprost proporcjonalnie do długości przewodnika, a odwrotnie proporcjonalnie do pola przekroju przewodnika.
Czynnikiem wpływającym na wielkość oporu danego przewodnika jest również jego oporność właściwa,
charakterystyczna dla różnych ciał. Ciała dzielą się, ze względu na właśnie opór właściwy, na przewodniki,
półprzewodniki i izolatory. Przewodniki mają najmniejszy opór właściwy, a izolatory największy, natomiast
półprzewodniki pomiędzy poprzednimi. Dobrymi przewodnikami są na przykład metale, a izolatory to na przykład
drewno, guma.
5) Teoria pasmowa ciał stałych
Charakteryzuje przewodniki za pomocą pasma energetycznego czyli przedziału energii, jaką mogą posiadać elektrony
w przewodniku. Na przykład w przewodnikach pasmo przewodnictwa jest nieprzerwane, w półprzewodnikach
przerwa, w której nie mogą znaleźć się elektrony jest na tyle wąska, że niektóre z elektronów mogą ją ‘przeskoczyć’ a w
izolatorach jest na tyle duża, że elektrony praktycznie nie są w stanie jej przekroczyć.
6) Półprzewodnik typu n
To półprzewodnik z domieszką dającą nadmiar elektronów, a domieszka jest zwana donorową (‘oddaje elektron’).
Dodatek nieznacznej ilości pierwiastka z grupy o wyższym numerze. Półprzewodnik taki powstaje na przykład w
wyniku wprowadzenia do bardzo czystego krzemu pierwiastka grupy 15, np. arsenu. Zwiększa to liczbę elektronów
walencyjnych w krzemie: każdy atom Si(grupa 14) ma cztery, a każdy atom As(grupa 15) ma pięć elektronów
walencyjnych. Dodatkowe elektrony obsadzają wyższe, normalnie puste pasmo przewodnictwa i umożliwiają
przewodzenie elektryczności przez ciało. Półprzewodnik typu n zawiera nadmiar ujemnie naładowanych elektronów.
Strona | 6
7) Półprzewodnik typu p
To półprzewodnik z domieszką dającą niedobór elektronów, a domieszka jest zwana akceptorową (przyjmuje
elektron). W wyniku domieszkowania krzemu np. indem(grupa 13), liczba elektronów walencyjnych w ciele jest
mniejsza niż w czystym krzemiei pasmo walencyjne nie jest już całkowicie zapełnione. Mówimy, że pasmo to zawiera
„dziury”. Ponieważ pasmo walencyjne nie jest zapełnione jego elektrony mogą przewodzić elektryczność. Brak
elektronów jest równoważny obecności dodatnio naładowanych dziur.
8) Stop metaliczny
To mieszanina metali, mająca właściwości metaliczne, w której występuje metal i co najmniej jeden dodatkowy
składnik (zwykle dodawany, aby zwiększyć wytrzymałość). Przykładem jest stal lub brąz.
9) Stop
Mieszaniny dwóch lub większej ilości metali.
Podział:
homogeniczne (jednofazowe) – atomy różnych metali są rozmieszczone równomiernie (np. mosiądz, brąz)
heterogeniczne (wielofazowe) – mieszaniny obszarów krystalicznych o różnym składzie (np. lut)
Skład typowych stopów:
mosiądz – do 40% cynku w miedzi
brąz – metal inny niż cynk i nikiel w miedzi
lut – cyna - ołów
stal – stop żelaza z węglem (mniej niż 2%)
Stopy zazwyczaj wykazują na ogół większą twardość i mniejszą przesadną elektryczność niż czyste metale.
Krystalografia, alotropia
1. Krystalografia
Bada, opisuje i klasyfikuje kryształy i substancje o strukturze krystalicznej.
2. Anizotropia
Cecha charakterystyczna niektórych ciał, głównie krystalicznych, polegająca na tym, że wykazują one różne
właściwości fizyczne w zależności od kierunku, w którym się je bada. Przeciwieństwem anizotropii jest izotropia.
3. Izotropia
Charakterystyczna cecha ciał, głównie niekrystalicznych, polegająca na tym, że we wszystkich kierunkach wykazują one
te same właściwości fizyczne. Przeciwieństwem izotropii jest anizotropia.
4. Komórka elementarna
To, w krystalografii, najmniejsza i powtarzalna część struktury kryształu. Ma kształt równoległościanu i jest
symetryczna, czyli jej odbicie względem osi symetrii pokrywa się z drugą częścią.
5. Sieć przestrzenna
To sposób, w jaki wypełniona jest przestrzeń atomami. Polega na tym, że pewna konfiguracja atomów, czyli komórka
elementarna, jest powtarzalna.
6. Układy krystalograficzne
Regularny
Tetragonalny
Heksagonalny
Trygonalny
Jednoskośny
Trójskośny
Rombowy
Układ tetragonalny
Układ krystalograficzny, w którym trzy osie są w stosunku do siebie prostopadłe, dwie z nich mają taką samą długość i
leżą w jednej płaszczyźnie, a trzecia oś (oś główna) jest od nich dłuższa lub krótsza.
Strona | 7
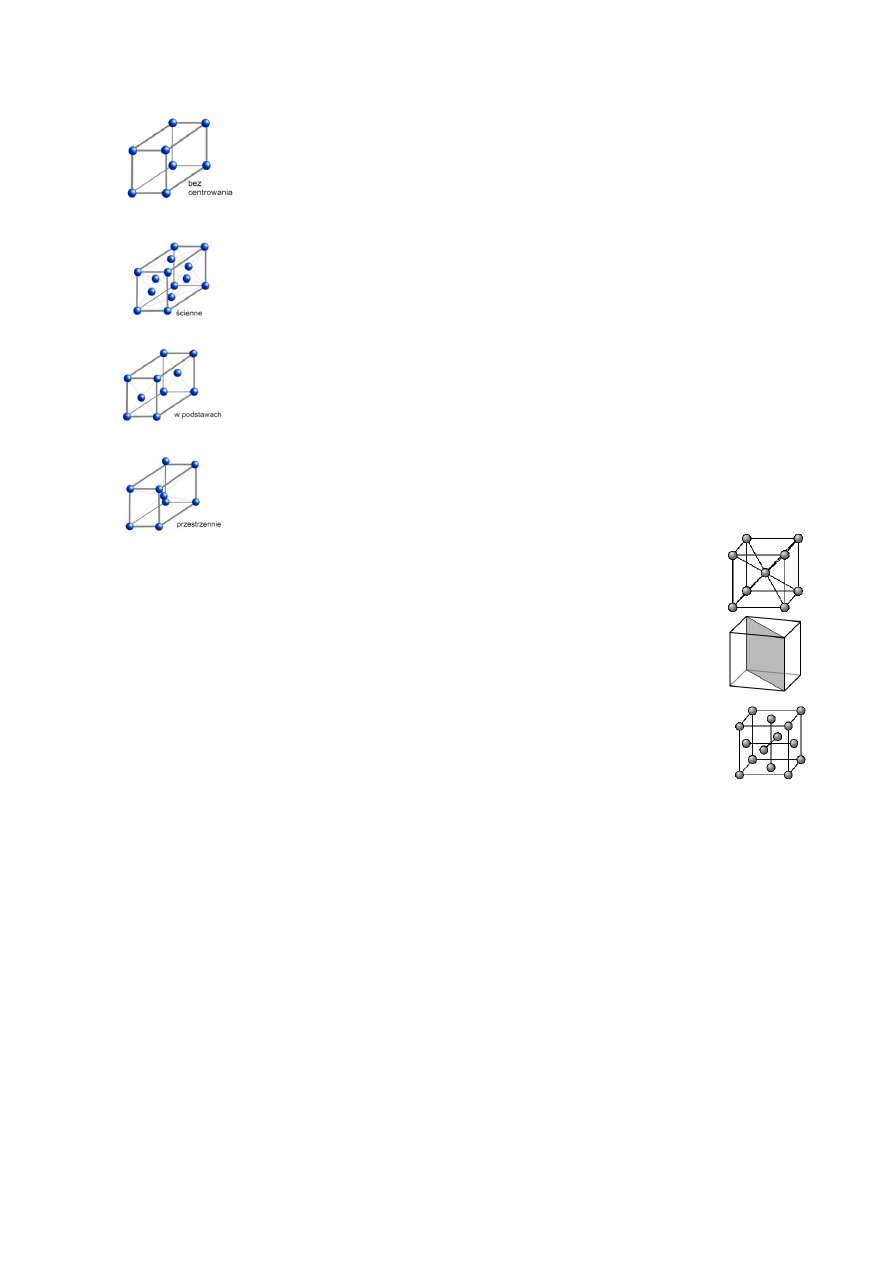
7. Centrowanie komórek elementarnych (rodzaje):
a) bez centrowania – atomy znajdują się tylko w rogach komórki
b) ściennie – atomy znajdują się zarówno w rogach, jak i na ścianach komórki elementarnej
c) w podstawach – atomy znajdują się w rogach i podstawach komórki elementarnej
d) przestrzennie – atomy znajdują się w rogach i w środku komórki elementarnej
8. Elementy symetrii:
a. punkt, środek symetrii – punkt położony wewnątrz kryształu, który ma tę własność, że na
dowolnej prostej przeprowadzonej przez ten punkt, w jednakowej od niego odległości, znajdują się
jednakowe pod względem geometrycznym i fizycznym punkty kryształu.
b. płaszczyzna symetrii – płaszczyzny dzielące kryształ na dwie części pozostające względem siebie
w takim stosunku jak przedmiot do swego obrazu w zwierciadle płaskim.
c. oś obrotu symetrii – prosta, wokół której powtarzają się jednakowe części kryształu, przy czym te
części mogą się powtarzać co kąt α = 60°, 90°, 120°, 180°, 360°, liczbę n = 360/α nazywa się
odwrotnością osi symetrii; w kryształach możliwe są osie jedno-, dwu-, cztero-, sześciokrotne.
9. Kryształy cząsteczkowe
Pojedyncze cząsteczki utrzymywane w wyniku oddziaływania (van der Waalsa i dipolowego)
Ponieważ całkowite oddziaływanie między cząsteczkowe w zasadzie jest słabe kryształy cząsteczkowe mają
niskie temp. topnienia
Są zwykle dosyć miękkie, bo cząsteczki łatwo mogą być przemieszczane z jednego położenia w inne
Są złymi przewodnikami elektryczności, ponieważ elektron związany z jedną cząsteczką z trudem przeskakuje
do innej.
Ten typ kryształu występuje częściej w związkach organicznych.
10. Defekty punktowe sieci krystalograficznej
To naturalne błędy występujące w regularności sieci przestrzennej kryształów. Np. luki czyli brak atomu w miejscu, w
którym powinien się znajdować wg regularności sieci przestrzennej.
Wakans (luka) – brak atomu w węźle sieci przestrzennej
Obcy atom w sieci krystalicznej
Atom wtrącony międzywęzłowo
Defekt Frenkla – atom wtrącony powoduje rozsunięcie sąsiednich atomów na odległość większą od normalnej
Defekt Schottky’ego – polega na powstaniu wakansu i wywędrowaniu atomu, który ten wakans utworzył na
powierzchnię kryształu (powszechny w kryształach metali)
11. Polimorfizm
Inaczej wielopostaciowość, polega na tym, że występują różne odmiany krystalograficzne tej samej substancji
chemicznej, np. węgiel występuje w postaci między innymi diamentu i grafitu.
Strona | 8
12. Alotropia
Zjawisko występowania, w tym samym stanie skupienia, różnych odmian tego samego pierwiastka chemicznego
różniących się właściwościami fizycznymi i chemicznymi. Odmiany alotropowe pierwiastka mogą różnić się między
sobą strukturą krystaliczną lub liczbą atomów w cząsteczce.
13. Odmiany alotropowe węgla:
- Grafit – ciemnoszara, miękka substancja, przewodząca prąd elektryczny, odporna na działanie wysokiej temperatury,
np. w ołówkach.
- Diament – przezroczysty, krystaliczny, ciało stałe, izolator, jest najtwardszym naturalnym minerałem, jest bezbarwny,
ale z domieszkami mogą występować zabarwione odmiany (np. błękitny, żółty a nawet czarny). W diamencie każdy
atom węgla jest połączony z czterema sąsiednimi, jest gęstszy od grafitu.
- Fuleren – posiadają zawsze parzystą liczbę atomów węgla, mają symetryczną strukturę, różnią się od diamentów i
grafitu budową sieci krystalicznej i właściwościami.
Chemia organiczna, węglowodory, paliwa, izomeria, polimery
1) Węglowodory
Związki chemiczne, które zbudowane są tylko z atomów węgla i wodoru.
Dzielą się na węglowodory:
- łańcuchowe:
nasycone (alkany) – mają tylko wiązania pojedyncze CH
3
– CH
3
(etan) wzór ogólny C
n
H
2n+2
nienasycone (alkeny i alkiny) – mają jedno wiązanie podwójne lub potrójne CH
2
= CH
2
(etylen) wzór ogólny
C
n
H
2n
; CH ≡ CH (etyn) wzór ogólny C
n
H
2n-2
- pierścieniowe
nasycone (cykloalkany)
(cyklopentan) wzór ogólny C
n
H
2n
nienasycone (cykloalkeny i cykloalkiny)
(cyklopropen)
aromatyczne (areny) – beznen C
6
H
6
2) Źródła naturalne węglowodorów
To ropa naftowa (ciecz), węgiel kamienny (ciało stałe) i gaz ziemny (gaz).
3) Etapy przerobu ropy naftowej:
Rafinacja-oczyszczanie substancji w celu nadania im Lu uzyskania odpowiednich właściwości
Destylacja frakcyjna- rozdzielenie ropy na frakcje wg temperatury wrzenia, frakcja(mieszanina cieczy o
podobnych temperaturach wrzenia, ‘lekkie’ frakcje mają niskie temperatury wrzenia o krótkie łańcuchy.)
Destylacja frakcyjna (destylacja) : która polega na rozdzieleniu i oczyszczaniu ciekłych związków chemicznych,
wykorzystująca fakt, że wrząca mieszanina ciekła wysyła parę o innym składzie aniżeli skład mieszaniny
ciekłej. Po skropleniu pary otrzymuje się szereg frakcji o innym składzie niż skład cieczy poddanej destylacji.
Destylację prowadzi się w instalacjach tzw. rurowo-wieżowych (gł. aparatami są piece rurowe i kolumny
destylacyjne), zwane Wieżami. Odwodnioną ropę naft. poddaje się stabilizacji, ogrzewa w piecu (do temp.
350C) i wprowadza do kolumny odzielenie na: benzynę, naftę, olej napędowy (odprowadzane po ochłodzeniu
do zbiorników magazynowych) oraz mazut
Kraking-reakcja rozpadu dłuższych łańcuchów na krótsze (lżejszy węglowodór, niższa temp spalania) pod
wpływem temperatury lub katalizatora
Reforming- proces otrzymywania benzyny, lżejszych frakcji przez rozbicie prostych łańcuchów alkanów i
przebudowanie ich w rozbudowane łańcuchy.
4) Izomeria
Dzieli się na izomerię konstytucyjną (strukturalną) i stereoizomerię (geometryczną i optyczną). Jest to zjawisko
występowania związku o takim samym wzorze, ale różnej budowie cząsteczek. Izomerie różnią się właściwościami.
Przykładem izomerii alkanu o wzorze sumarycznym C4H10 są n-butan i 2-metylopropan.

Strona | 9
5) Cząsteczka chiralna
Cząsteczka związku chemicznego, która sama w sobie i jej odbicie nie pokrywają się (coś w rodzaju prawej i lewej
dłoni). Cząsteczka ta i jej odbicie tworzą enancjomery, które mają takie same właściwości chemiczne, ale różnią się
właściwością fizyczną: są aktywne optycznie.
6) Polimer
Substancje chemiczne składające się z wielokrotnie powtórzonych elementów (merów). Mają dużą masę cząsteczkową
i dzielą się na syntetyczne (wytworzone sztucznie) i naturalne. Przykładem polimeru jest celuloza (naturalny polimer).
7) Reakcje otrzymywania polimerów
Dzielą się na polimeryzację (proces chemiczny polegający na łączeniu wielu monomerów w wielocząsteczkowy
łańcuch: ulegają jej związki nienasycone, czyli te, które posiadają wiązania podwójne lub potrójne, w czasie reakcji te
wiązania pękają, co umożliwia przyłączanie kolejnych monomerów) i polikondensację (kondensacja związków o
małych cząsteczkach, w wyniku której powstaje wielkocząsteczkowy produkt). Różnicą pomiędzy polimeryzacją a
polikondensacją jest między innymi to, że w wyniku reakcji polikondensacji powstaje, oprócz głównego produktu,
dodatkowy produkt o małej cząsteczce (np. H2O).
Spektroskopia, absorpcja i emisja światła, zjawiska optyczne
1. Absorpcja światła
To pochłonięcie pewnych energii fal świetlnych przez substancję, np. kiedy widzimy żółty przedmiot, to znaczy, że
zaabsorbował on fale o innych długościach niż żółta.
2. Emisja światła
To proces wysyłania promieniowania świetlnego przez wzbudzoną materię, np. żarówka emituje światło.
3. Prawo Lamberta-Beera
A – absorbancja
I
0
– natężenie światła padającego na ciało
I – natężenie światła po przejściu przez ciało
4. Rozszczepienie światła
Rozdzielenie się fali światła białego na fale o różnych długościach (kolory). Występuje na przykład w postaci tęczy,
która pojawia się, gdy światło słoneczne rozszczepi się za pomocą kropel deszczu.
5. Odbicie światła
Ciało, na które pada światło, odbija część (lub całą) wiązkę światła, dzięki czemu nasze oko jest w stanie odebrać obraz
(dlatego na przykład w ciemności nie widać kolorów). Charakterystyczną zasadą odbicia światła jest to, że kąt padania
jest równy kątowi odbicia. Występuje na granicy dwóch ośrodków (niekoniecznie przeźroczystego), np. odbicie się
światła od kartki.
6. Rozproszenie światła
Światło rozproszone to światło, którego kierunek rozchodzenia się został zmieniony w sposób nieuporządkowany i
częściowy. Wydaje się wtedy, że ośrodek rozpraszający świeci. Np. świecenie światła przez chmury.
7. Załamanie światła
Zjawisko powstające gdy promień światła przechodzi z jednego ośrodka, do drugiego (przy czym oba te ośrodki muszą
być przeźroczyste i mieć różne gęstości). Do załamania światła dochodzi na granicy dwóch ośrodków, przy czym
postały kąt jest uzależniony od różnicy gęstości ośrodków. Przykładem jest ‘zakrzywienie’ łyżeczki, jakie możemy
zaobserwować, gdy włożymy ją np. do herbaty. Powstaje wrażenie, że zanurzona część łyżeczki nie łączy się z
wynurzoną, jest jakby ‘przesunięta’.

Strona | 10
Stężenia
1) Układ koloidalny
Niejednorodna mieszanina, zwykle dwufazowa, tworząca układ dwóch substancji, w którym jedna z substancji jest
rozproszona w drugiej. Rozdrobnienie (czyli dyspersja) substancji rozproszonej jest tak duże, że fizycznie mieszanina
sprawia wrażenie substancji jednorodnej, jednak nie jest to wymieszanie na poziomie pojedynczych cząsteczek. Składa
się z rozpuszczalnika i z substancji rozpuszczonej. W koloidzie można wyodrębnić dwie fazy: ciągłą (stanowi ją
substancja rozpraszająca) oraz rozproszoną (substancja zawieszona). Charakterystyczną właściwością koloidów jest
ich zdolność do intensywnego rozpraszania światła, co zwane jest efektem Tyndalla. Polega na przepuszczeniu przez
koloid wiązki światła, którego promienie ugną się na cząstkach fazy rozproszonej. Podczas takiego zjawiska w
odpowiednich warunkach można dostrzec stożek Tyndalla, który jest smugą światła w roztworze koloidalnym.
Przykłady koloidów: mgła, dym, piana mydlana, lakier do paznokci, mleko, pumeks, styropian.
2) Stężenie procentowe
To udział związków chemicznych w mieszaninach i roztworach wyrażony w procentach. Pojęcie to oznacza najczęściej
zawartość substancji rozproszonej lub rozpuszczonej w stosunku do całości mieszaniny lub roztworu, jednak czasami
określa się w ten sposób również udział procentowy roztworu nienasyconego w stosunku do roztworu nasyconego (w
tych samych warunkach termodynamicznych). Klasyczne wagowe stężenie procentowe to liczba gramów związku, jaka
jest obecna w 100 g roztworu, jednak w przypadków rozcieńczonych roztworów wodnych zazwyczaj stężenie
procentowe oznacza w praktyce liczbę gramów związku chemicznego obecnego w 100 cm³ roztworu, gdyż przyjmuje
się tu, że w przybliżeniu roztwory takie mają gęstość zbliżoną do wody — czyli 100 g/100 cm³. W przypadku bardziej
stężonych roztworów nie jest to jednak już prawdą i gęstość takich roztworów może znacznie odbiegać od tej wartości.
Wzór:
gdzie:
C
p
to stężenie procentowe [%]
m
s
to masa substancji rozpuszczanej [g]
m
r
to masa roztworu [g]
m
rozp
to masa rozpuszczalnika [g]
3) Stężenie molowe (M, C
m
)
Roztworów związków chemicznych – liczba moli danego związku jaką zawiera 1 dm
3
danego roztworu.
Stężenie molowe jest równe stosunkowi liczby moli n substancji rozpuszczonej do objętości roztworu. Jednostką
stężenia molowego w układzie SI jest mol×m
–3
, jednak w literaturze chemicznej powszechnie stosuje się mol×dm
–3
=
mol/dm
3
= mol/l, zapisywane także jako "M". Do wyrażania niskich stężeń stosuje się też jednostki mM, μM, nM itp.
Określenie roztworu jako n-molowy oznacza, że jego stężenie molowe wynosi n mol/dm
3
.
Stężenie molowe substancji X zapisuje się w nawiasie kwadratowym [X].
Wzór:
gdzie:
C
m
= stężenie molowe [mol/dm
3
]
n = liczba moli związku chemicznego [mol]
V
r
= objętość roztworu [dm
3
]
m
s
= masa substancji rozpuszczanej [g]
M = masa molowa substancji rozpuszczanej [g/mol]
Stężenie molowe zależy od temperatury, gdyż objętość roztworu zmienia się wraz z temperaturą.
4) Ułamek molowy
Jest to rodzaj miary stężenia, który jest stosunkiem liczby moli danego składnika mieszaniny lub roztworu do sumy
liczby moli wszystkich składników.
Szczególnie niskie ułamki molowe są podawane w częściach na milion (ppm) lub nawet częściach na miliard (ppb).
Ułamek molowy składnika A (x
A
) w a-składnikowej mieszaninie wynosi:
gdzie n
i
jest liczbą moli substancji i.
Suma ułamków molowych wszystkich składników roztworu jest równa jedności.
Roztwór jednomolowy – roztwór zawierający w objętości 1 dm
3
1 mol danej substancji.
Wyszukiwarka
Podobne podstrony:
Chemia Bionie wyk1
chemia powt
Wykład Chemia kwantowa 11
wyklad z czwartku chemia fizycz dnia19 marca
chemia(1) 3
Chemia węglowodory
Chemia organiczna czesc I poprawiona
ERGONOMIA chemia
chemia organiczna wykład 6
Chemia wyklad I i II (konfiguracja wiÄ…zania Pauling hybrydyzacja wiazania pi i sigma)
Chemia procesu widzenia
Chemia R cje chemiczne
Chemia materiałów V
Wykład 9 CHEMIA ORGANICZNA
CHEMIA NIEORGANICZNA 2
więcej podobnych podstron