
PEPTYDY I BIAŁKA
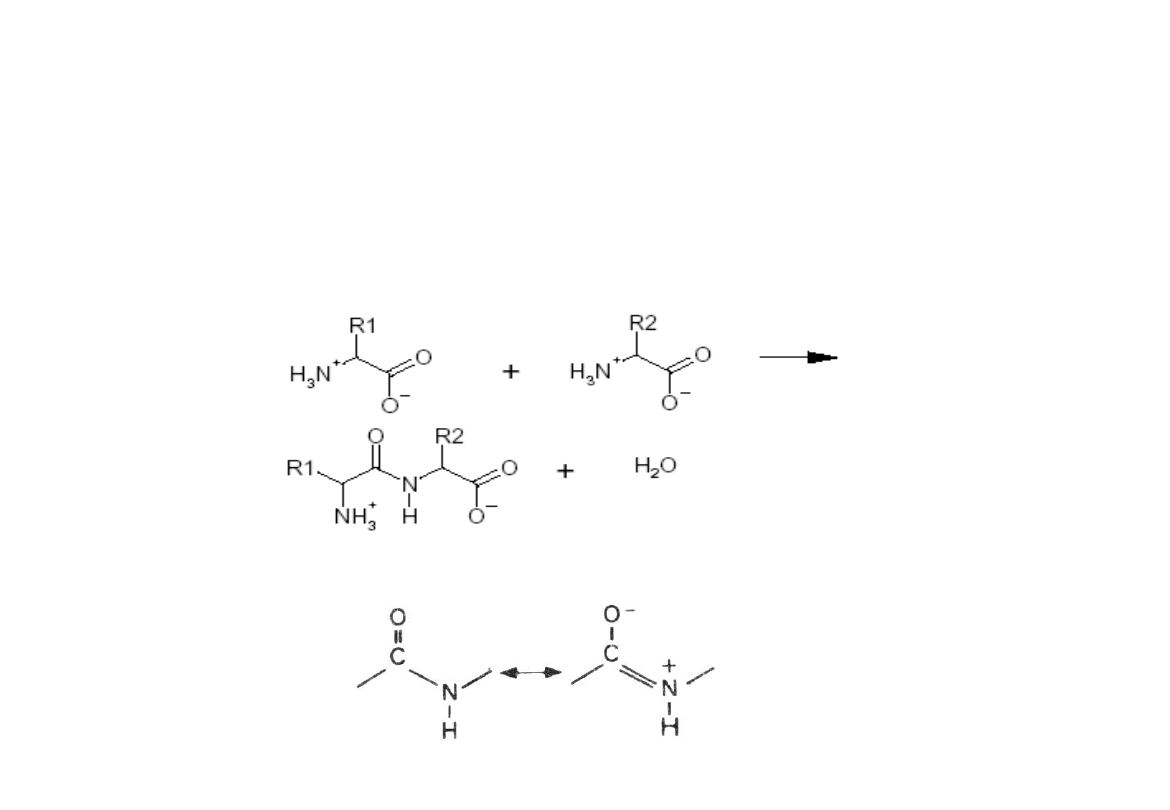
Wiązanie utworzone pomiędzy grupą karboksylową
jednego aminokwasu, a grupą aminową drugiego
Wiązanie peptydowe


PEPTYDY
Peptydy pełnią niezmiernie istotne funkcje w organizmach żywych.
Są,między innymi, hormonami, regulatorami, decydują o uwalnianiu lub
zahamowaniu wydzielania innych hormonów, ich poziom wpływa również
na nasze zachowanie i samopoczucie. Występują na różnym poziomie
stężeń. Niektóre z nich można izolować z materiału biologicznego na skalę
przemysłową np. glutation, czy insulinę, a dla stwierdzenia występowania
innych trzeba stosować niezwykle czułe metody analityczne.
Peptydy naturalne różnią się bardzo pod względem budowy. Jedne są
prostymi oligopeptydami, inne - większe, charakteryzują się
skomplikowaną budową przestrzenną. Znane są również peptydy złożone,
czyli połączenia peptydów z innymi grupami związków, np. glikopeptydy,
czy lipopeptydy.
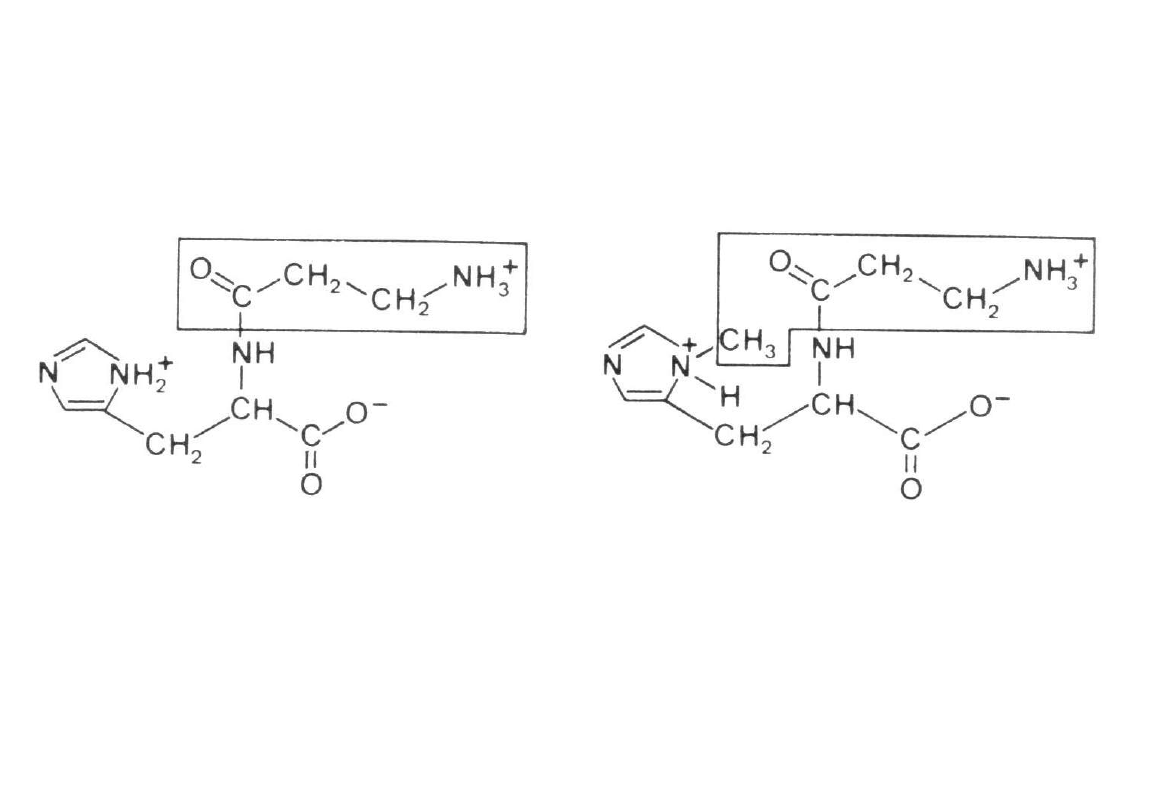
Karnozyna i anseryna
Karnozyna
(-alanylo-histydyna)
Anseryna
(-alanylo-metylohistydyna)

Karnozyna i anseryna
- specyficzne składniki mięśni szkieletowych ptaków i
ssaków
- stymulują niektóre procesy biochemiczne takie jak
fosforylacja oksydacyjna oraz aktywność
enzymatyczna systemu białek kurczliwych mięśni
- karnozyna jest prawdopodobnie neurotransmiterem
- oba dipeptydy mają właściwości buforowe, co
zapobiega zakwaszeniu podczas intensywnej pracy
mięśnia
- poubojowo wpływają na procesy dojrzewania mięsa

Glutation
• Glutation (GSH) jest jednym z najprostszych hormonów
peptydowych. W jego skład wchodzą zaledwie trzy reszty
aminokwasowe -Glu, Cys i Gly.
Glutation jest bardzo rozpowszechniony w przyrodzie, znajduje się
bowiem we wszystkich komórkach zwierząt wyższych. Mimo
prostej budowy, łatwiej jest go pozyskiwać ze źródeł naturalnych,
np. z drożdży, niż otrzymywać syntetycznie. Jego biosynteza
katalizowana przez enzymy, przy współudziale ATP, różni się od
zachodzącej w rybosomach syntezy białek.
GSH pełni różnorakie funkcje biologiczne, głównie jako aktywator
wielu enzymów, występuje także jako koenzym hydrolazy
acyloglutationowej, dehydrogenazy formaldehydowej, tautomerazy
indolilopirogronowej i wielu innych. Glutation ponadto, dzięki
obecności grupy tiolowej SH, działa jako antyutleniacz oraz bierze
udział w wielu biologicznie ważnych reakcjach redoks.
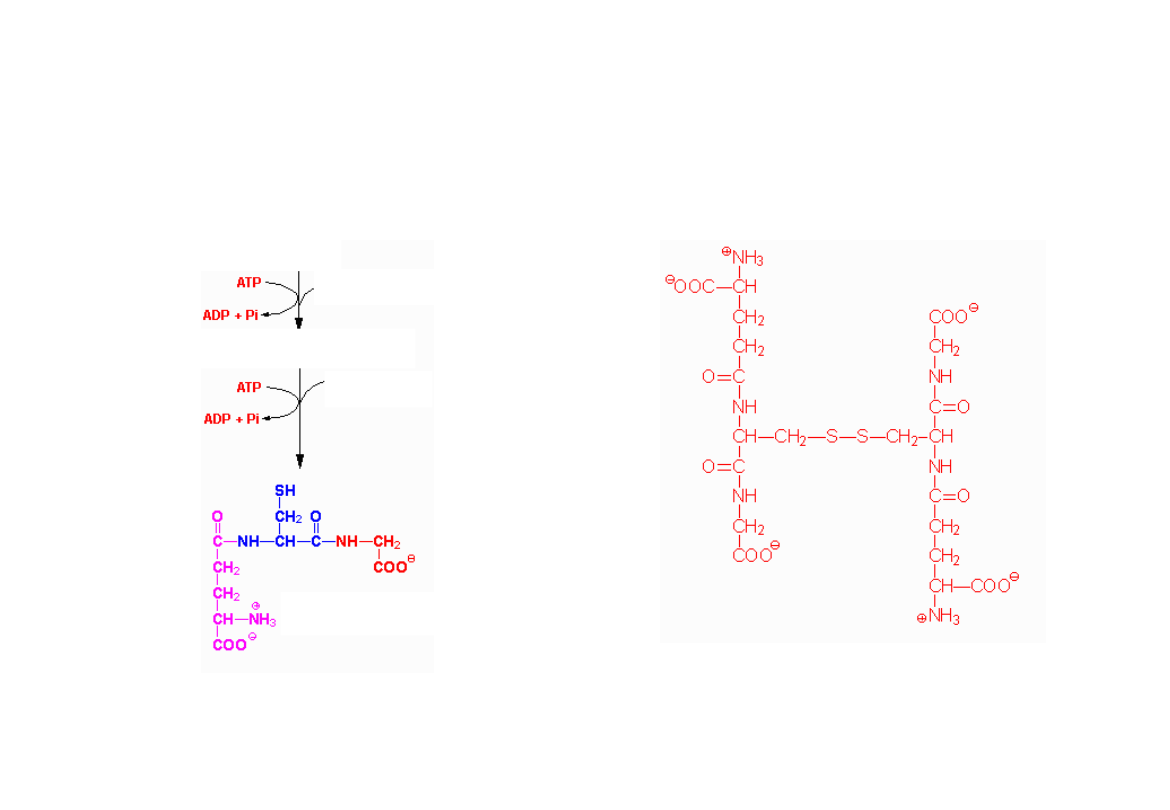
Synteza glutationu
Kwas glutaminowy
Cysteina
-
glutamylo
cysteina
Glicyna
GLUTATION
Forma utleniona
(G-S-S-G)
Forma zredukowana
(GSH)

Angiotensyna
Angiotensyna - jest znana w dwóch postaciach I i II. Angiotensyna
I jest dekapeptydem (10 AA), powstającym z angiotensynogenu
w wyniku działania reniny, po czym pod wpływem enzymu
konwertującego zostają odszczepione kolejne dwa C-końcowe
aminokwasy i powstaje angiotensyna II.
Angiotensynogen znajduje się we frakcji globulinowej osocza.
Renina jest wytwarzana w kłębuszkach nerkowych. Struktura
pierwszorzędowa ludzkiej, wieprzowej i końskiej angiotensyny I
jest identyczna, a w wołowej zamiast Ile jest Val.
Angiotensyna II obkurcza naczynia krwionośne, wywołując w
rezultacie podwyższenie ciśnienia tętniczego.
Podwyższa
ciśnienie krwi silniej niż noradrenalina.
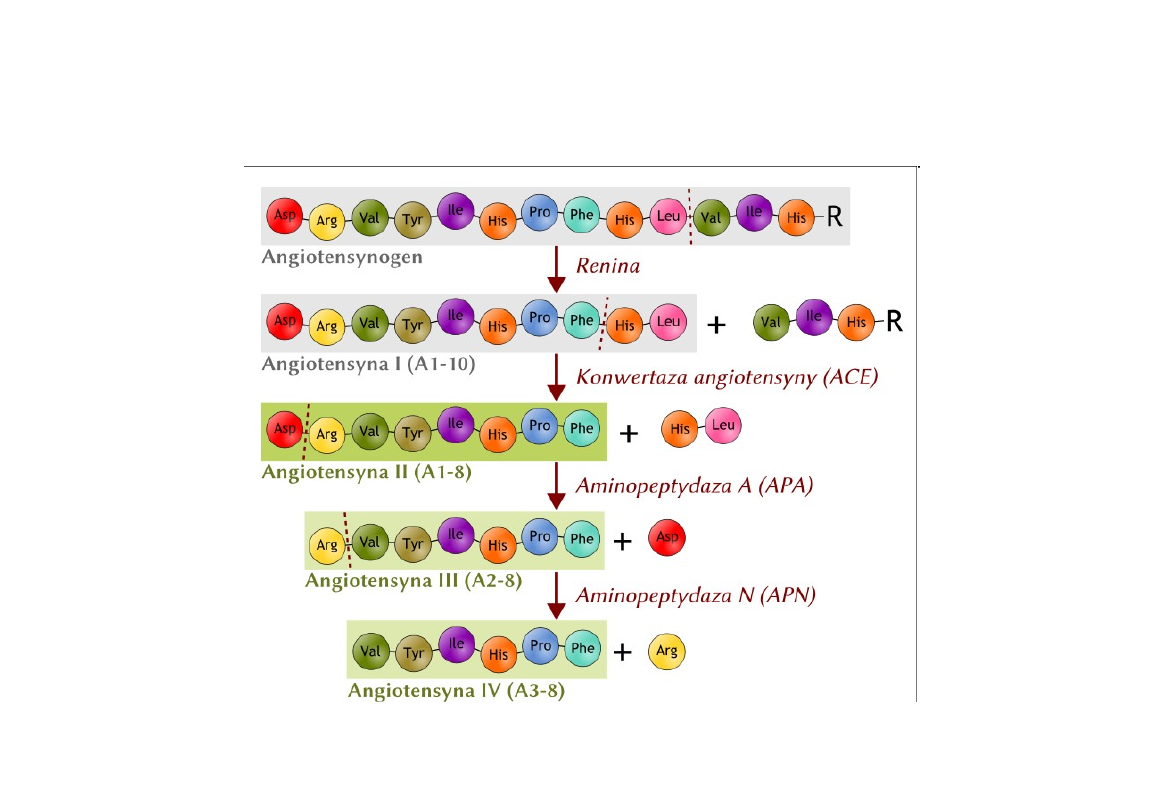
Synteza angiotensyny

Bradykinina
Bradykinina – 9- peptyd występujący w osoczu krwi ssaków, obok innych
licznych kinin uwalnianych z -globulin osocza krwi pod wpływem
proteaz.
Bradykinina i inne kininy obniżają ciśnienie krwi poprzez poszerzanie
naczyń krwionośnych. In vitro powodują ponadto skurcze mięśni
gładkich jelit, macicy i oskrzeli. Bradykinina należy do tych peptydów
naturalnych, z którymi wiązano ogromne nadzieje otrzymania
pochodnych służących jako leki obniżające ciśnienie krwi. Jednak mimo
zsyntezowania kilkuset analogów bradykininy, z których wiele obniżało
ciśnienie krwi, nie udało się znaleźć pochodnej spełniającej wymagania
terapeutyczne.

Oksytocyna i wazopresyna
Oksytocyna i wazopresyna są syntezowane w podwzgórzu, nazywane są
jednak hormonami tylnego płata przysadki z uwagi na miejsce ich wykrycia i
występowania. Oba te cykliczne 9-peptydy powstają ze wspólnego
prekursora, jakim jest białko zbudowane ze 166 reszt aminokwasów.
Struktura oksytocyny jest identyczna u wszystkich ssaków, natomiast w
budowie wazopresyny występują pewne różnice, np. w pozycji 8 w
wazopresyny świńskiej znajduje się lizyna, natomiast w wazopresynie
ludzkiej i wołowej występuje arginina.
Oksytocyna wywołuje skurcze mięśni gładkich macicy, pełniąc istotną rolę
w procesie porodu. Macica nieciężarna jest niewrażliwa lub bardzo mało
wrażliwa na działanie oksytocyny. Jest powszechnie stosowana w lecznictwie
w celu wywołania opóźnionych porodów, dla wzmocnienia akcji porodowych,
dla zahamowania krwotoków porodowych, po cesarskich cięciach, czy też po
zabiegu przerywania ciąży. Ponadto stwierdzono, że oksytocyna oddziałuje
na psychikę, a także ma wpływ na zachowania socjalne. Między innymi
oksytocyna jest odpowiedzialna na kształtowanie cech macierzyńskich.
Uczestniczy w mechanizmach wydzielania mleka i ejakulacji u samców.

Wazopresyna -
nazywana jest często hormonem antydiuretycznym (antydiuretyną,
ADH) ponieważ jeden z efektów jej działania polega na zatrzymywaniu
wody w organizmie (aktywność antydiuretyczna). Jej antydiuretyczne
działanie powoduje dziesięciokrotne zagęszczenie tzw. pramoczu.
Wazopresyna wywołuje również zwężanie tętniczek i naczyń
włoskowatych co powoduje wzrost ciśnienia tętniczego krwi. Jest to jej
aktywność presyjna. Wazopresyna pobudza także syntezę i wydzielanie
hormonów przysadki, nadnerczy i gonad, stymuluje ponadto proces
uczenia się i zapamiętywania.
Wazotocyna –
Analog oksytocyny i wazopresyny. Bierze udział w składaniu jaj u
ptaków oraz w procesach związanych z tarłem u ryb. Jest 9-peptydem
wytwarzanym w podwzgórzu a wydzielanym w tylnym płacie przysadki
mózgowej

Glukagon i insulina
Glukagon - produkowany w trzustce podobnie jak insulina, jest liniowym
polipeptydem, zawierającym 29 reszt aminokwasowych. Ma jednak w
porównaniu z insuliną przeciwne działanie fizjologiczne ponieważ podwyższa
stężenie glukozy we krwi; jest więc antagonistą insuliny. Glukagon ponadto
wpływa na pracę serca podwyższając częstotliwość jego skurczów; ma także
własności lipolityczne.
Insulina - produkowany w trzustce polipeptyd, zbudowany jest z 51 reszt
aminokwasowych. Mimo, że jej masa cząsteczkowa wynosi około 6. 000 Da,
często zaliczana jest do białek z uwagi na łatwość z jaką tworzy dimery a
nawet heksamery. Insulina wykazuje szerokie spektrum aktywności
biologicznej, w tym obniża poziom glukozy we krwi, zwiększając zawartość
glikogenu w wątrobie. Wzmaga także biosyntezę białek oraz kwasów
tłuszczowych.
Insulina ludzka jest peptydem złożonym z dwóch łańcuchów: A -
zawierającym 21 reszt aminokwasowych i B - zawierającym 30 takich reszt.
Oba łańcuchy połączone są dwoma mostkami disiarczkowymi, a w łańcuchu
A znajduje się dodatkowy mostek S-S.
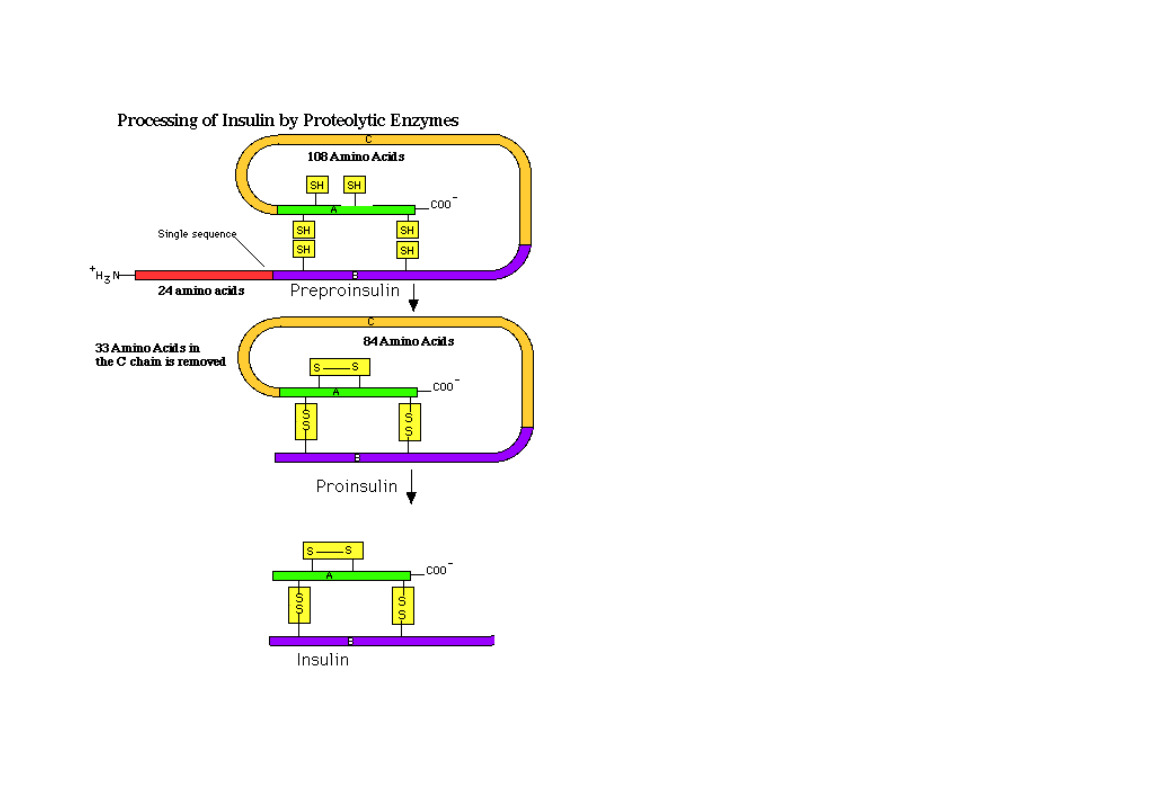
Aktywacja insuliny

ACTH
Adrenokortykotropina (ACTH, kortykotropina) jest to hormon
produkowany i wydzielany przez przedni płat przysadki mózgowej, a działa
w nadnerczach, gdzie stymuluje syntezę kortykosterydów - sterydowych
hormonów, zwanych również hormonami kory nadnercza. Te niezbędne do
życia substancje są odpowiedzialne za metabolizm węglowodanów i
równowagę elektrolityczną organizmu. ACTH należy do tak zwanych
neurohormonów. Nazwa ta jest związana z mózgiem jako miejscem
powstawania hormonu. Wydzielanie ACTH w przednim płacie przysadki
następuje pod wpływem bodźców stresowych lub obniżenia poziomu
hormonów kory nadnercza we krwi. Następnie kortykotropina jest
transportowana przez krew do kory nadnercza, gdzie stymuluje produkcję
kortykosterydów. Wzrost poziomu kortykosterydów hamuje wydzielanie
ACTH. Hormon ten jest również odpowiedzialny za gospodarkę tłuszczami w
organizmie. ACTH jest liniowym peptydem zawierającym 39 reszt
aminokwasowych

Melanotropina (MSH)
-peptyd wytwarzany przez przysadkę, występuje w trzech odmianach: -MSH,
3
-MSH i -MSH. Prekursorem melanotropin jest proopiomelanokortyna.
Melanotropiny są to kilkunastopeptydy (a - 13, b - 18 i y - 12), nieznacznie
zróżnicowane gatunkowo u różnych zwierząt pod względem składu i długości
łańcucha.
Stymulują syntezę melaniny i regulują rozprzestrzenianie się tego barwnika w
skórze, przez co wpływają na jej zabarwienie. Poziom melanotropin jest
regulowany przez dwa inne hormony peptydowe - melanoliberynę i
melanostatynę, które są również uwalniane w przysadce.

Somatotropina (GH)
-nazywana również hormonem wzrostu lub hormonem somatotropowym
jest peptydem syntezowanym w przednim płacie przysadki, a nazwa jego
związana jest bądź z rolą jaką pełni w stymulacji wzrostu - hormon wzrostu,
bądź z jego oddziaływaniem na całe ciało - somatotropina.
Somatotropina stymuluje przede wszystkim podłużny wzrost kości, a tym
samym umożliwia rozrost tkanek miękkich. Po zarośnięciu przynasad kości
długich bierze udział w rozroście tkanki chrząstnej i kostnej.
Działa anabolicznie, reguluje przemiany mineralne, tłuszczowe, pośrednio
również węglowodanowe. Jej biosynteza w okresie wzrostu jest
uruchamiana pod wpływem innego peptydu-
somatoliberyny
, a hamowana
przez
somatostatynę
. Występują znamienne różnice zarówno w długości
łańcucha, jak w składzie aminokwasowym hormonu u poszczególnych
gatunków zwierząt. Ludzka somatotropina zbudowana jest ze 191 reszt
aminokwasowych i jedynie somatotropiny naczelnych wykazują zbliżoną
budowę, a zarazem i porównywalną aktywność.

Gastryna i sekretyna
Gastryna
- peptyd wytwarzany przez błonę śluzową
żołądka, stymuluje wydzielanie kwasu solnego w
żołądku, wydzielanie enzymów w trzustce oraz pracę
mięśni
żołądkowo-jelitowych.
Jest
siedemnastopeptydem.
Sekretyna
- jest to hormon peptydowy wytwarzany w
błonie śluzowej jelita cienkiego. Stymuluje on trzustkę
do wydzielania insuliny i soku trawiennego, a także
wątrobę do wytwarzania żółci. Jest to polipeptyd
składający się z 27 reszt aminokwasowych.

Hormony podwzgórza
Tyreoliberyna, występuje w podwzgórzu jako hormon uwalniający
tyreotropinę (tyrotropinę), zwany w skrócie TRF (thyreotrophin releasing
factor). TRF również tripeptydem, ma nastepującą sekwencję: Glu-His-Pro-
NH
2
. Tyreotropina, której wydzielanie stymuluje TRF, jest glikoproteidowym
hormonem przedniego płata przysadki, zwiększającym aktywność
wydzielniczą tarczycy, w tym zwiększającym wychwyt jodu przez tarczycę,
a także pobudzającym syntezę hormonów tego gruczołu. TRF jest
stosowany w diagnostyce i leczeniu tarczycy.
Liberyny i statyny
Podwzgórze, część międzymózgowia, jest miejscem powstawania szeregu
peptydów w tym
liberyn
- hormonów uwalniających inne hormony i
statyn
hamujących wydzielanie hormonów. I tak np. obok melanoliberyny istnieje
melanostatyna, regulujące stężenie melanotropiny, podobnie jak i inna para
somatoliberyna z somatostatyną decydują o stężeniu somatotropiny w
organizmie. Na stężenie prolaktyny wpływ wywierają prolaktoliberyna i
prolaktostatyna. Peptydy uwalniające i hamujące są substancjami bardzo
aktywnymi i występują w bardzo małych stężeniach. Liberyny i statyny
często są krótkimi lub średniej długości peptydami.

Gonadoliberyna
GnRH
(hormon
uwalniający
gonadotropinę,
luteotropinę i folitropinę) jest dekapeptydyloamidem, zawierającym
kwas piroglutaminowy na N-końcu.GnRH jest stosowany w
diagnostyce i leczeniu zaburzeń płodności kobiet i mężczyzn.
Kortykoliberyna (corticotropin releasing factor, CRF), zwana również
amuniną, jest peptydem zawierającym 41 reszt aminokwasowych.
Kortykoliberyna, oprócz uwalniania kortykotropiny (ACTH), wpływa
również na poziom endorfiny.
Somatostatyna (SST) w skrócie SRIF (growth hormone inhibiting
factor) lub SW jest cyklicznym (mostek disiarczkowy) 14-peptydem
produkowanym w podwzgórzu i w przewodzie pokarmowym.
Hormony podwzgórza – cd.
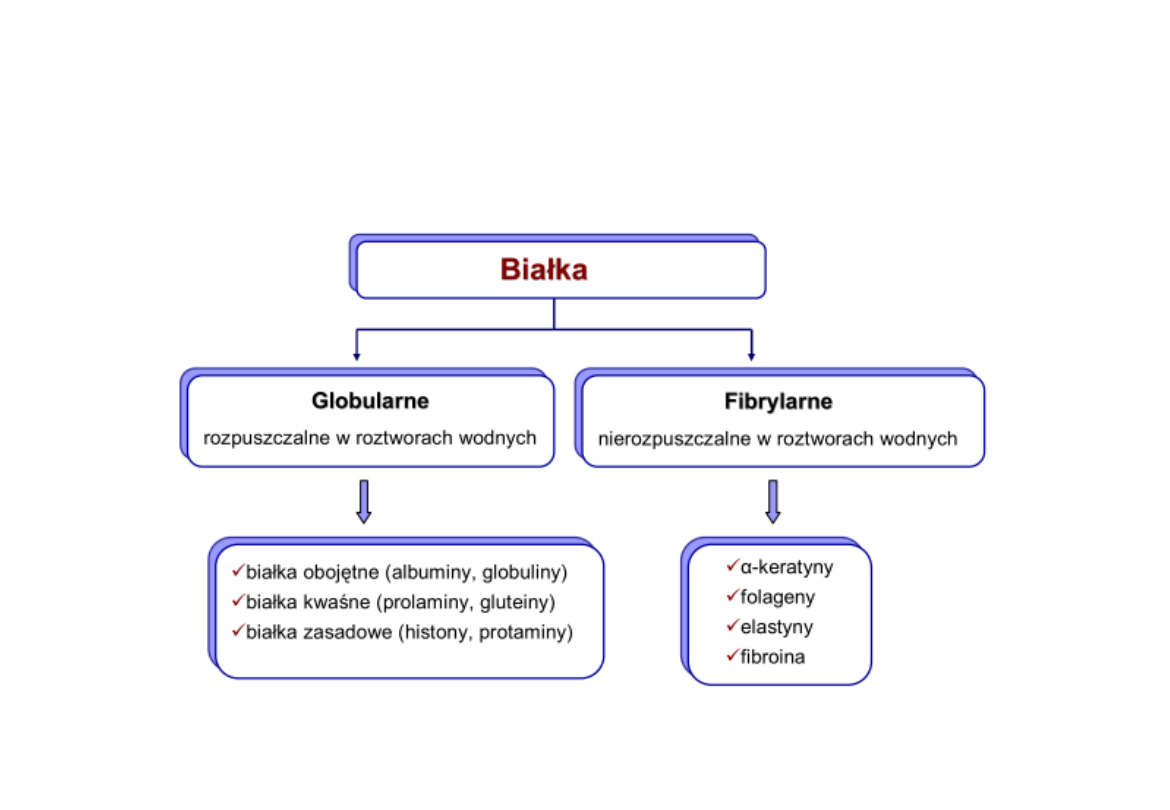
Podział białek
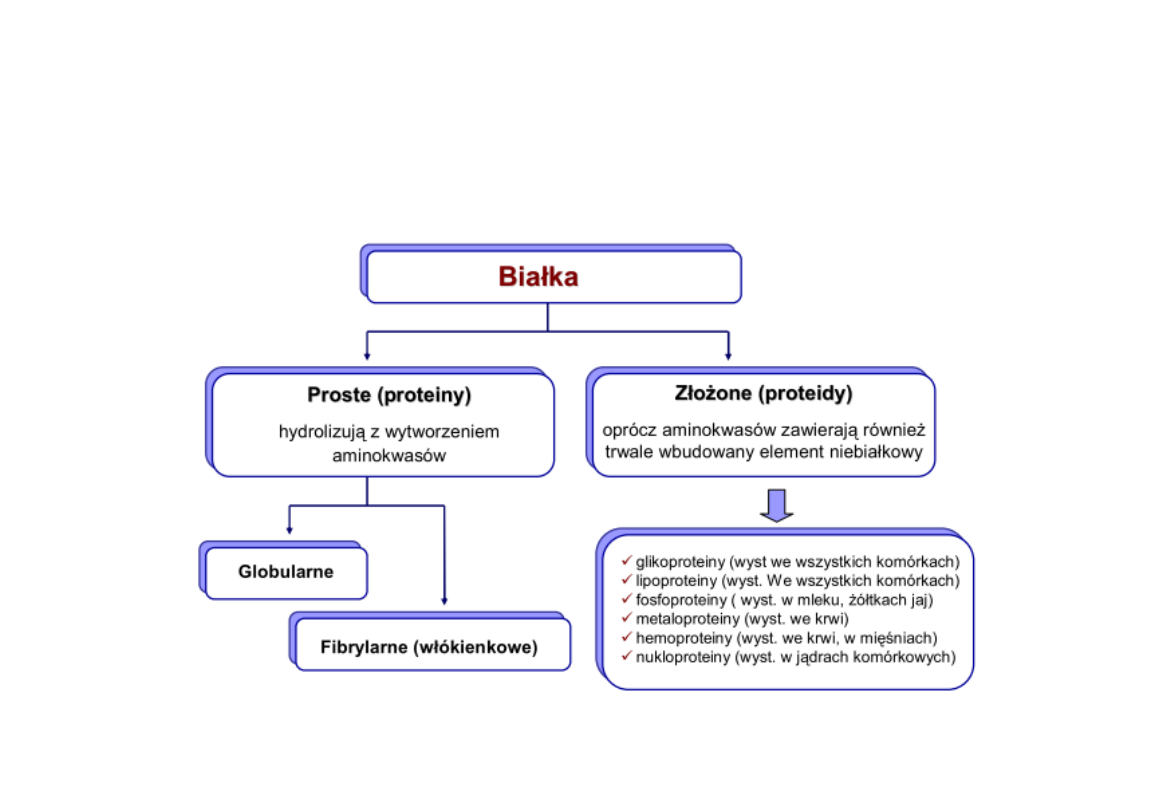
Podział białek


Funkcje białek
1) Kataliza enzymatyczna (większość enzymów to białka)
•
rybonukleaza
•
lizozym
•
chymotrypsyna
•
karboksypeptydaza A
2) Transport i magazynowanie
•
Mioglobina
•
Hemoglobina
•
Metaloproteidy
•
Albuminy
3) Strukturalna
•
Keratyny
•
Elastyna
•
Kolageny
•
Miozyna
•
Aktyna
•
Tropomiozyna
•
Troponina
4) Rola ochronna
•
Immunoglobuliny
•
Fibrynogen-fibryna
•
Białka chroniące przed zamarzaniem
5) Regulacji hormonalnej (niektóre hormony,komórkowe receptory rozpoznające hormony i neuroprzekaźniki)
6) Kontroli ekspresji genów (histony, aktywatory, represory i inne czynniki regulujące ekspresję genów)

Właściwości fizykochemiczne
białek
Wielkość białek waha się w granicach 5–100 nm, ich roztwory mają
charakter koloidowy. Trwałość ciekłych roztworów koloidowych, czyli zoli,
zależy m.in.
od ładunku rozproszonych cząstek białkowych, stopnia uwodnienia i
temperatury.
Zmiany tych czynników mogą prowadzić do łączenia się cząstek w
większe skupienia, czego konsekwencją może być spadek
rozpuszczalności i wypadanie ich z roztworów (koagulacja).
Zol może przechodzić odwracalnie w żel, czyli w formę elastycznego ciała
stałego, proces ten nazywa się żelatynowaniem. W żelu cząstki białkowe
wiążą się ze sobą, tworząc układy przestrzenne.
Cechą białek jest powolna dyfuzja i niezdolność do dializy, czyli do
przenikania przez błony półprzepuszczalne. Dzięki temu można
oczyszczać roztwory białek ze związków drobnocząsteczkowych przez
dializę.

Większość białek dobrze rozpuszcza się w wodzie lub rozcieńczonych
roztworach soli, kwasów lub zasad.
O rozpuszczalności decyduje przede wszystkim ich zdolność do hydratacji,
budowa chemiczna, obecność soli w środowisku i pH roztworu.
Hydratacja białka polega na wiązaniu dipoli wody z grupami polarnymi
łańcuchów bocznych aminokwasów oraz z atomami N i O wiązań
peptydowych,w konsekwencji cząstka białkowa otoczona jest płaszczem
wodnym. Ilość wody hydratacyjnej związanej z białkiem może być rzędu
0,3–0,4 g na 1 g białka. Woda hydratacyjna stanowi nieodłączną i
znamienną część cząstki białkowej, która wpływa na własności
strukturalne oraz funkcjonalne białka.
Uwodnienie i pęcznienie jest wspólną cechą białek rozpuszczalnych, a także
nierozpuszczalnych.
Właściwości fizykochemiczne
białek

Jeden z czynników określających własności fizykochemiczne poszczególnych
białek to ładunek elektryczny cząsteczki, który wynika z obecności
zjonizowanych grup funkcyjnych w łańcuchach bocznych aminokwasów białka.
Określony ładunek elektryczny poszczególnych białek zależy od ilości i rodzaju
grup zdolnych do jonizacji oraz od stężenia jonów H
+
w roztworze białka.
Wartość pH, w którym cząsteczka białka zawiera tę samą liczbę zjonizowanych
grup dodatnich i ujemnych, odpowiada punktowi izoelektrycznemu (pI)
białka, wówczas jego sumaryczny ładunek równy jest zero.
W tych warunkach (w pI) nie wędruje ono w polu elektrycznym, ma najniższą
rozpuszczalność i najmniejszą lepkość. W pH niższym od pI białko wykazuje
ładunek dodatni, zachowuje się jak kation. W pH wyższym od pI białko wykazuje
ładunek ujemny, zachowując się jak anion.
Białka kwaśne mają niską wartość pI, która np. dla pepsyny wynosi 1, a 4,8 dla
albuminy, głównego białka surowicy. Białka zasadowe mają wysoką wartość pI,
która przykładowo dla cytochromu c wynosi 10,6, a dla histonów 10–11.
Właściwości fizykochemiczne
białek

Masa cząsteczkowa białek
1 dalton (Da) – atomowa jednostka masy używana przez
chemików, która w przybliżeniu jest równa masie atomu
wodoru.
Ze względów praktycznych została zdefiniowana jako 1/12
masy atomu węgla 12 C. Nazwa dalton pochodzi od
nazwiska twórcy współczesnej teorii atomowej, Johna
Daltona.
W przypadku białek do określania wielkości cząsteczki
używa się jednostek 1000 – krotnie większych czyli
kilodaltonów (kDa)

Rozpuszczalność białek

Wpływ siły jonowej




Czynniki denaturujące


Struktury białek
I. Struktura pierwszorzędowa
- jest kowalencyjnym „szkieletem” polipeptydu utworzonego przez
specyficzną sekwencję aminokwasów
- sekwencja ta jest zakodowana w DNA i określa końcowy trójwymiarowany
kształt
- sekwencje peptydów są zapisywane od lewej do prawej strony
II. Struktura drugorzędowa
- Przestrzenna interakcja sąsiednich reszt aminokwasowych
- Często tworzy się, gdy łańcuch peptydowy opuszcza rybosom
- Cechą charakterystyczną jest tworzenie wiązań wodorowych:
a) w obrębie tego samego łańcucha
- -helisa
- β-zwój
b) pomiędzy różnymi łańcuchami
- β-struktura pofałdowanej kartki
c) struktura kolagenu
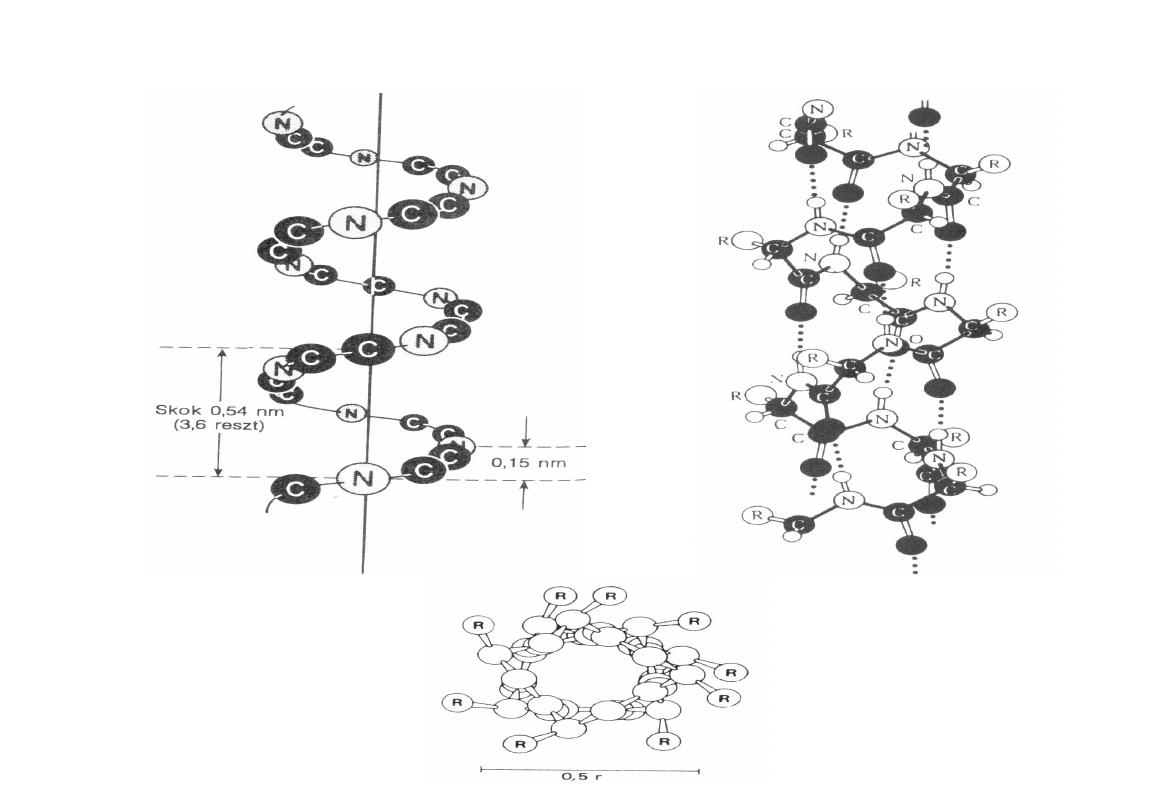
-helisa
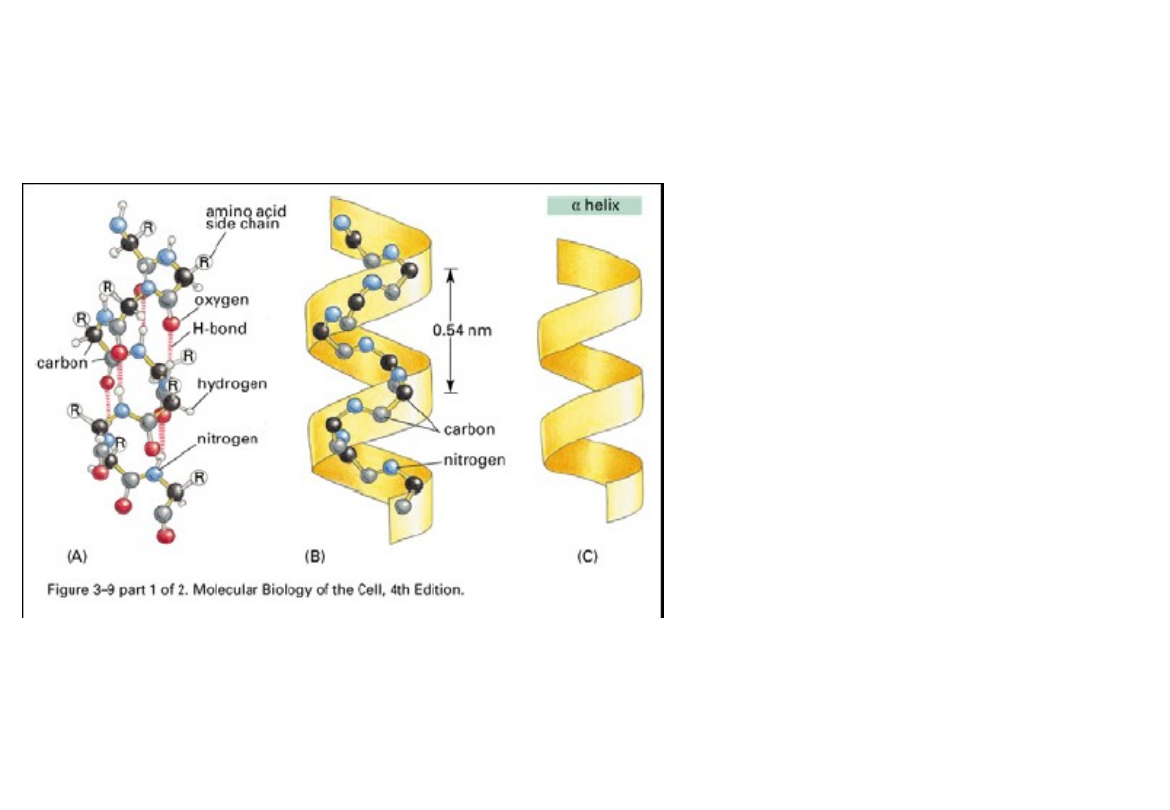
-helisa
• na 1 skręt helisy przypada
3,6 reszt aminokwasowych
• jest prawoskrętna (zgodnie z
ruchem wskazówek zegara)
• Aa stabilizujące heliks:Ala,
Val, Leu, Phe, Trp, met, His i
Gln
• Aa destabilizujące heliks:
Gly, Glu, Asp, Lys, Arg, Tyr,
Asn, Ser Thr i Ile
• Obecność Pro prowadzi
zawsze do przerwania -
helisy (tzw. punkt załamania)

-helisa – cechy charakterystyczne
W α -helisie płaszczyzny wiązań peptydowych układają się spiralnie w ten sposób,
że są styczne do hipotetycznego walca. Dzięki temu powstaje cylindryczna struktura,
utworzona ze szkieletu polipeptydu, od której na boki sterczą łańcuchy boczne
aminokwasów (R). Przekrój poprzeczny α -helisy przedstawiono na rysunku. Na
jeden skok α -helisy przypada 3,6 reszt aminokwasowych. Odległości między
sąsiednimi resztami aminokwasowymi wynoszą 0,15 nm wzdłuż osi helisy, a cała
długość skoku równa się 0,54 nm.
Struktura α -helisy jest najkorzystniejsza energetycznie, stabilizowana wieloma
wiązaniami wodorowymi. Wiązania wodorowe tworzone są między atomem tlenu
karbonylowego jednego wiązania peptydowego, a atomem wodoru grupy
aminowej czwartego z kolei wiązania peptydowego. Wiązania wodorowe między
grupami pochodzącymi z różnych wiązań peptydowych biegną równolegle do osi
helisy. W α -helisie mogą być wyczerpane wszystkie możliwe wiązania wodorowe
między atomami różnych wiązań peptydowych, z wyjątkiem miejsc, w których
znajdują się aminokwasy destabilizujące i uniemożliwiające wytworzenie wiązań
wodorowych. Prolina zmienia kierunek łańcucha polipeptydowego i przerywa
strukturę α -helisy, jeśli więc aminokwas ten jest obecny, to tylko na końcu α -helisy.

β-harmonijka
-harmonijka – cechy
charakterystyczne
Struktura harmonijkowa (struktura β), jest rozciągnięta, odległość między dwoma
sąsiednimi atomami Cα wynosi 0,35 nm. Dlatego odległości między atomami
wiązań peptydowych liniowo sąsiadujących wzdłuż polipeptydu są za duże, aby
mogły wytworzyć wiązania wodorowe.
W strukturze- β wiązania wodorowe mogą powstać tylko między różnymi rejonami
tego samego polipeptydu, które równolegle przylegają do siebie, lub między
odrębnymi polipeptydami. W pojedynczym polipeptydzie o strukturze- β wiązania
wodorowe między atomami wiązań peptydowych mogą być tworzone tylko między
odległymi sekwencjami, a nie sąsiadującymi liniowo, co odróżnia tę stukturę od α
-helisy.
Równoległa struktura- β to taka, w której przylegające do siebie rejony polipeptydu
lub odrębne polipeptydy ułożone są w tym samym kierunku, to znaczy, że z tej
samej strony mają swe N-końce, a z drugiej strony C-końce.

Antyrównoległa struktura β to taka, w której przylegające do siebie rejony
polipeptydu lub odrębne polipeptydy ułożone są w przeciwnych
kierunkach, to znaczy, że z tej samej strony jeden ma N-koniec, a drugi C-
koniec. Kierunek przebiegu łańcucha polipeptydowego odwracają zwroty β,
w których tlen karbonylowy jednego wiązania peptydowego jest połączony
wiązaniem wodorowym z wodorem grupy aminowej czwartego z kolei
wiązania peptydowego.
Zwroty- β często łączą końce antyrównoległych struktur β w obrębie
pojedynczego polipeptydu. Następstwem występowania wielokrotnych,
wielowarstwowych struktur- β jest duża wytrzymałość i sztywność białek,
w których występują.
Rejony polipeptydu, nie przyjmujące jednej z omówionych regularnych
struktur drugorzędowych, pozostają w konformacji zwoju lub pętli.

Struktura kolagenu

III. Struktura trzeciorzędowa
- Giętkość łańcucha w punktach niestabilności
- Tworzenie innych niekowalencyjnych wiązań
(np. mostki solne, oddziaływania hydrofobowe)
- Tworzenie mostków disulfidowych pomiędzy
resztami Cys
- Peptyd przybiera ją w komórce bardzo szybko, a
odpowiedzialne są za to:
a) białkowa izomeraza disulfidowa
b) chaperony (białka opiekuńcze)
IV. Struktura czwartorzędowa
- Określa przestrzenne oddziaływanie pomiędzy
poszczególnymi łańcuchami polipeptydowymi w
wielołańcuchowym białku
- Wyróżnia się podjednostki, tzw. protomery
- Wiele białek o budowie podjednostkowej zawiera
podjednostki zróżnicowane funkcjonalnie (np.
podjednostki regulatorowe i katalityczne)
Struktury białek
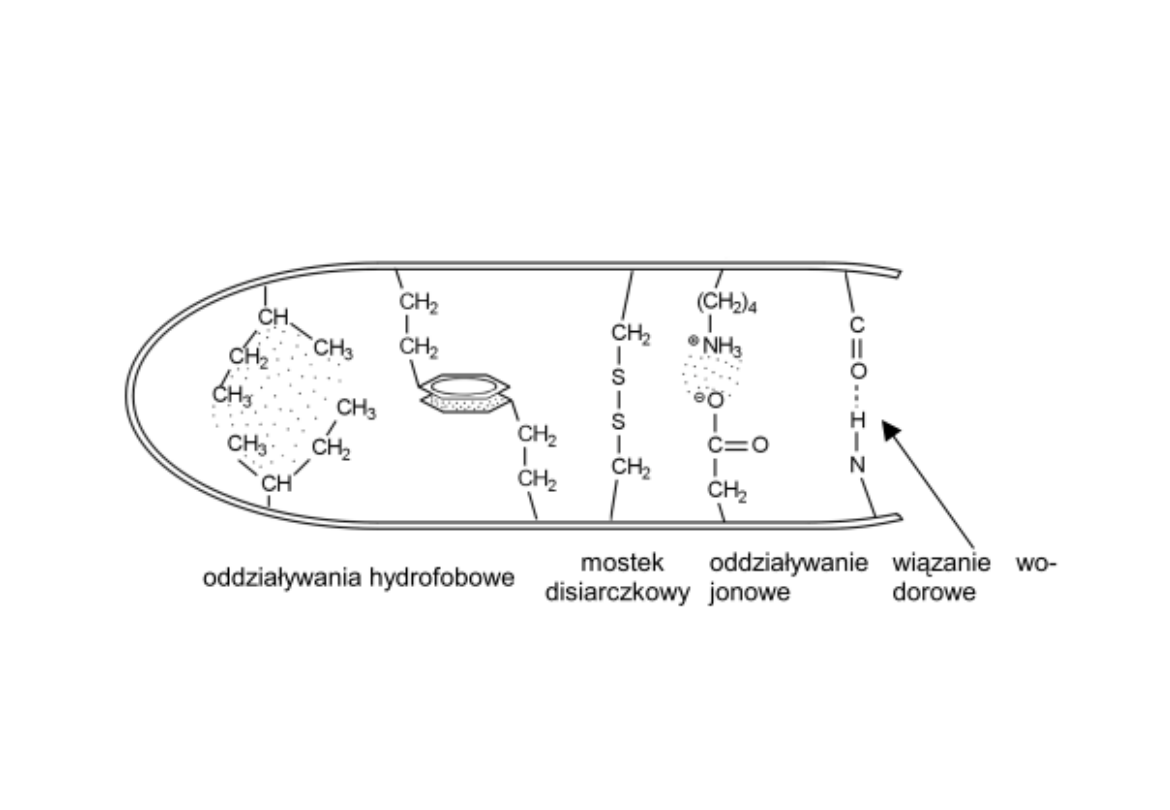
Wiązania chemiczne stabilizujące struktury białek
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
Wyszukiwarka
Podobne podstrony:
Peptydy i białka
Peptydy i białka
01 Aminokwasy, peptydy, białka, enzymyid 3054 ppt
68 Aminokwasy peptydy i bialka(1)
68 Aminokwasy peptydy i bialka
Biochemia, Peptydy, Peptydy, Białka
Aminokwasy,peptydy,białka i inne
peptydy i bialka, Biologia-liceum
Aminokwasy, peptydy, białka
Peptydy i białka, STOMATOLOGIA, II ROK, Biochemia, zbiorcze
Peptydy i Białka, Kosmetologia, Notatki i wyłady, Biochemia
peptydy i bialka
Chemia 6 Aminokwasy Peptydy i Białka
AMINOKWASY, PEPTYDY, BIAŁKA
Aminokw,peptydy,białka,enzymy
Peptydy i białka
01 Aminokwasy, peptydy, białka, enzymyid 3054 ppt
więcej podobnych podstron