Wykonanie ćwiczenia:
szybkość reakcji v = k(a-x) (x stężenie substratu)
Zadanie 1. Obliczyć czas potrzebny do zmniejszenia stężenia substratu:
z 0,25 M do 0,05 M przy stałej szybkości reakcji k = 0,027 min-1.
t - czas reakcji ?
k = stała szybkość reakcji 0,027 min-1
a - stężenie początkowe 0,25 M
(a-x) - stężenie końcowe w danym momencie 0,05 M
zamieniamy k na t miejscami
z 0,4 M do 0,15 M przy stałej szybkości reakcji k = 0,322 s-1
t - czas reakcji ?
k = stała szybkość reakcji 0,322 s-1
a - stężenie początkowe 0,4 M
(a-x) - stężenie końcowe w danym momencie 0,15 M
z 0,1 M do 0,02 M przy stałej szybkości reakcji k = 0,108 l/min.
Zadanie 2.
Obliczyć energię aktywacji, przyjmując, że podczas hydrolizy w temp. 25oC szybkość Vm reakcji wynosiła 0,27 mg/min, a w temp. 35oC 0,48 mg/min.
Wyliczyć energię aktywacji, wiedząc, że stała szybkości reakcji w temp. 27oC wynosiła 0,245.
Energia aktywacji pewnej reakcji wynosi 50 kJ/mol. Jak zmieni się stała szybkości tej reakcji, jeśli temperatura zostanie obniżona z 250C na 15oC?
Ile razy wzrosła szybkość pewnej reakcji, jeśli jej temperaturowy współczynnik wynosi γ=3, a temperatura wzrosła o 5oC?
γ = 5
∆T = 8
Ile razy wzrosła szybkość pewnej reakcji, jeśli jej temperaturowy współczynnik wynosi γ=4, a temperatura wzrosła o 8oC?
Temperaturowy współczynnik pewnej reakcji wynosi γ=3. O ile stopni należy podnieść temperaturę, aby szybkość reakcji wzrosła 10 razy?
γ = 3 Temperaturowy współczynnik pewnej reakcji
∆T = ? Różnica temperatury
szybkość reakcji wzrosła
Temperaturowy współczynnik pewnej reakcji wynosi γ=4. O ile stopni należy podnieść temperaturę, aby szybkość reakcji wzrosła 3 razy?
γ = 4 Temperaturowy współczynnik pewnej reakcji
∆T = ? Różnica temperatury
szybkość reakcji wzrosła
Temperaturowy współczynnik pewnej reakcji wynosi γ=1. O ile stopni należy podnieść temperaturę, aby szybkość reakcji wzrosła 3 razy?
γ=1. nie wpływa na przyśpieszenie reakcji.
Zadanie . Obliczyć stałą szybkości reakcji k (enzymatycznych), jeżeli:
po 5 minutach stężenie substratu zmalało z 0,2 M do 0,05 M.
k =? stała szybkości reakcji
t - czas reakcji 5 min
a - stężenie początkowe substratu 0,2 M
(a-x) - stężenie substratu w danym momencie 0,05 M
Zawsze ilość substratu maleje a ilość produktu rośnie = < 1.
po 8 minutach stężenie substratu zmalało z 0,3 M do 0,15 M.
k =? stała szybkości reakcji
t - czas reakcji 8 min
a - stężenie początkowe substratu 0,3 M
(a-x) - stężenie substratu w danym momencie 0,15 M
po 30 s stężenie substratu zmalało z 0,02 M do 0,015 M.
k =? stała szybkości reakcji
t - czas reakcji 30s
a - stężenie początkowe substratu 0,02M
(a-x) - stężenie substratu w danym momencie 0,15M
W którym przypadku k miało najwyższą wartość? Podać jednostkę k.
Zadanie 3.
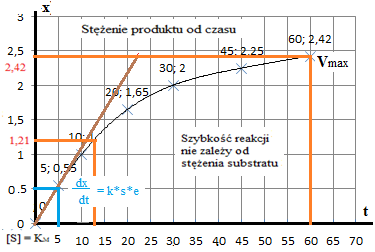
Wyznaczyć rząd reakcji oraz stałą szybkości k dla reakcji hydrolizy skrobi, wiedząc że po 5 min stężenie produktu wynosiło 0,55 mg/cm3, po 10 min - 1,00, po 20 1,65; po 30 - 2,00; po 45 - 2,25; po 60 - 2,42; po 90 - 2.42 mg/cm3. Wykreślić krzywe
t (czas) |
x (stężenie produktu) |
a-x (stężenie substratu) |
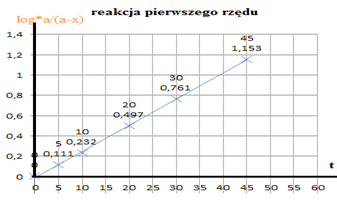
log*a/(a-x)
|
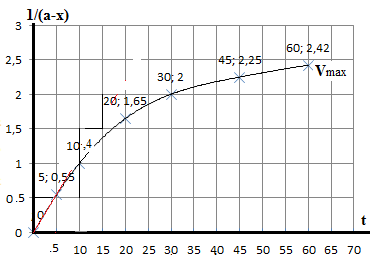
1/(a-x) |
0 |
0 |
2,42 |
log*2,42/242 = 0 |
1 / 2,42 = 0,413 |
5 |
0,55 |
2,42 - 0,55 = 1,87 |
log*2,42/1.87 = 0,111 |
1 / 1,87 = 0,535 |
10 |
1 |
2,42 - 1 = 1,42 |
log*2,42/142 = 0,232 |
1 / 1,42 = 0,704 |
20 |
1,65 |
2,42 - 1,65 = 0,77 |
log*2,42/0,77 = 0,497 |
1 / 0,77 = 1,299 |
30 |
2 |
2,42 - 2 = 0,42 |
log*2,42/0,42 = 0,761 |
1 / 0,42 = 2,381 |
45 |
2,25 |
2,42 - 2,25 = 0,17 |
log*2,42/0,17 = 1,153 |
1/ 0,17 = 5,882 |
60 |
2,42 |
0 |
- |
- |
90 |
a = 2,42 |
0 |
- |
- |
|
|
|
||
Wyznaczyć rząd reakcji z treści zadania.
stężenia produktu od czasu x / t
szybkości reakcji od czasu Po przekształceniu obliczamy według wzoru v = x/t = 0,55 / 5 = 0,11.
Wyznaczamy graficznie, styczną do łuku.
Szybkość początkowa reakcji V0 = x/t nie jest zależna od rzędu reakcji i mierzymy ją w punkcie pierwszym.
Wyznacz stałą szybkości k dla reakcji. Stała Michaelisa v = V max / 2
Szybkość reakcja enzymatycznej (zerowa V od S)
k - stała szybkość reakcji
S - stężenie substratu 1,87 M
e - stężenie enzymu 0,55 M
Stała Michaelisa v = V max / 2 = 2,42/2=1,12 połowa stężenia)
wartości log*a/(a-x) od czasu a = 2,42
wielkości 1/(a-x) od czasu
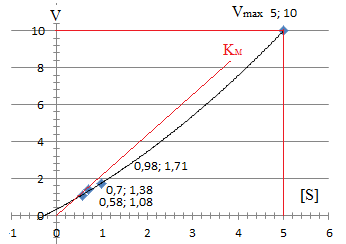
Zadanie 5. Prowadząc hydrolizę sacharozy o stężeniach 0,0125 - 0,1 M przy pomocy inwertazy drożdżowej, otrzymano w poszczególnych czasach reakcji następujące ilości glukozy i fruktozy [mg]:
Stężenie |
|
|
Czas reakcji [min] |
|
|
sacharozy [M] |
[V0] |
5 |
10 |
15 |
30 |
0,100 |
0,98/5=0,196 |
0,98 |
1,71 |
2,52 |
3,84 |
0,050 |
0,70/5=0,14 |
0,70 |
1,38 |
1,94 |
2,76 |
0,025 |
0,58/5=0,116 |
0,58 |
1,08 |
1,48 |
2,21 |
0,0125 |
0,37/5=0,074 |
0,37 |
0,55 |
0,82 |
0,86 |
Na podstawie podanych wyników:
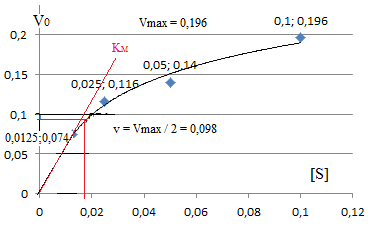
Wyznaczyć stałą Michaelisa-Menten Wyznaczyć szybkości początkowe dla każdego stężenia substratu, wykreślić krzywą Michaelisa-Menten (zależność szybkości początkowych od stężenia substratu) i wyznaczyć stałą Michaelisa-Menten
Wykreślić krzywą Lineweavera-Burka dla zależności od 1I[S] i wyznaczyć stałą Michaelisa-Menten oraz szybkość maksymalną VM
t = 5 min / połowa substratu / po 10 min
[S] = 4* 10-5 mol * dm -3.
V max = 2,04 *10-5 M·min-1
k = ?
v = ?
KM = ?
t = 10 min
[S] = 4* 10-5 mol * dm -3.
k = 0,135 min-1
= ( a - x) stężenie substratu po 10 min
x = ? stężenie produktu po 10 min
Określić stałe kinetyczne KM i Vmax.
Który z enzymów wykazuje większe powinowactwo do substratu?
Określić stałe kinetyczne KM i Vmax.
Jakiego rodzaju inhibicję wywołała modyfikacja trypsyny?
Wyznaczyć stałe kinetyczne.
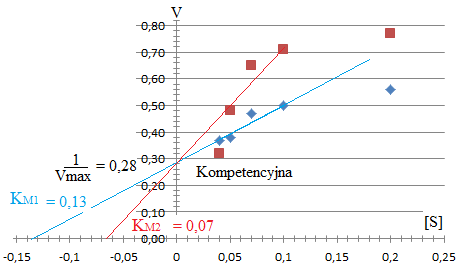
Określić rodzaj inhibicji - kompetencyjna
Podać w jaki sposób można cofnąć działanie inhibitora.
Stężenie |
|
|
sacharozy [S] |
[V0] |
|
0,10 |
0,98/5=0,196 |
|
0,05 |
0,70/5=0,14 |
|
0,025 |
0,58/5=0,116 |
|
0,0125 |
0,37/5=0,074 |
|
Szybkość początkowa wynosi 0,074 min-1 |
||
Stężenie sacharozy [M] |
[V0] |
1 [S] |
1 [V0] |
|
0,100 |
0,98/5=0,196 |
5 |
10 |
|
0,050 |
0,70/5=0,14 |
0,98 |
1,71 |
|
0,025 |
0,58/5=0,116 |
0,70 |
1,38 |
|
0,0125 |
0,37/5=0,074 |
0,58 |
1,08 |
|
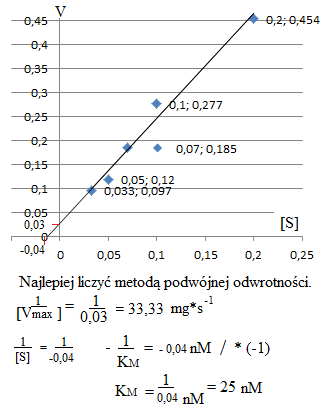
Zadanie 6.
Oznaczono szybkości początkowe Vo dla reakcji enzymatycznej przy różnych stężeniach substratu:
Początkowe stężenie substratu [mM] [S] |
Szybkość początkowa Vo [mg,s'l] [v] |
Gdy nie mamy V max. |
|
|
|
1 [S] |
1 [V0] |
5 10 15 20 30 |
2,2 3,6 5,4 8,3 10,3 |
1 : 5 = 0,20 1 : 10 = 0,10 1 : 15 = 0,07 1 : 20 = 0,05 1 : 30 = 0,033 |
1 : 2,2 = 0,454 1 : 3,6 = 0,277 1 : 5,4 = 0,185 1 : 8,3 = 0,120 1 : 10,3 = 0,097 |
|
|
||
Wartość szybkości maksymalnej V max = 132 mg·s-1. Obliczyć KM oraz podać dla jakiego stężenia substratu szybkość reakcji osiąganie wartości maksymalną.
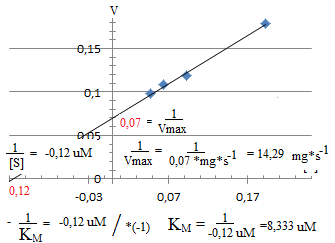
Zadanie 7.
Po 5 min reakcji przereagowała połowa substratu o początkowym stężeniu 4 . 10.5 mol·dm-3. Szybkość maksymalna reakcji wynosiła 2,04 *10-5 M·min-1. Obliczyć KM oraz stężenie produktu po 10 min.
Stężenie produktu po 10 min?
zamiana miejscami
stężenie substratu po 10 min
4 * 10-5 -x = 1,038 * 10-5
x = 4 * 10-5 - 1,038*10-5
x= 2,962*10-5
Po 10 min powstało 2,962*10-5 mol.*dm3 produktu.
Zadanie 8.
Stała Michaelisa w reakcji hydrolizy peptydu wynosi 4 . 10-3 M. Przy stężeniu początkowym substratu 8 . 10-5 M, po 2 minutach zhydrolizowało 10% peptydu. Obliczyć stałą szybkości reakcji oraz szybkość maksymalną Vmax
zhydrolizowało 10% peptydu to pozostało 90%.
[S2] = (a-x) 90% z 8 = 0,9 * 8 * 10-5 = 7,02 * 10-5
KM = 4*10-3 M
[S] = 8*10-5
k = ?
v = ?
Zadanie 9. Określono szybkości początkowe działania enzymu na substrat przy różnych stężeniach substratu:
Początkowe stężenie substratu [µM] |
Vo [mg·s·l] |
1 [S] |
1 [Vo} |
5,2 10,8 15,6 20,8 |
5,6 8,4 9,3 10,3 |
0,192 0,093 0,064 0,048 |
0,179 0,119 0,108 0,098 |
|
|
|
|
Czynniki wpływające na szybkość reakcji.
Zadanie 2. W wyniku działania dwóch różnych enzymów na substrat o zmiennym stężeniu określono szybkości początkowe:
Początkowe stężenie substratu [μM] |
enzym A |
enzym B |
|
v0 |
v0 |
50 100 156 208 |
5,6 8,4 9,3 10,3 |
11,2 14,9 16,8 18,7 |
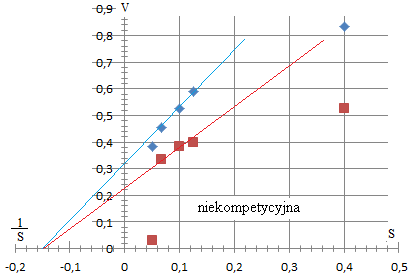
Zadanie 3.
Zmierzono szybkości początkowe przy różnym stężeniu substratu dla reakcji katalizowanej przez trypsynę niemodyfikowaną i modyfikowaną:
Początkowe stężenie substratu [μM] |
enzym niemodyfikowany |
enzym modyfikowany |
|
E nie mod. |
E mod |
|
v0 |
v0 |
1 S |
1 V0 |
1 V0 |
4 8 10 15 20 |
1,2 1,7 1,9 2,2 2,6 |
1,9 2,5 2,6 3,0 3,2 |
0,4 0,125 0,1 0,067 0,05 |
0,833 0,588 0,526 0,454 0,384 |
0,526 0,4 0,384 0,333 0,0312 |
|
|
|
|
||
odp - KM się nie zmienia, nie ma wpływu na stęrzenie.
Odp: modyfikacja trypsyny wywołała modyfikację niekompetycyjną.
Zadanie 4.
Oznaczono szybkości początkowe reakcji bez i z dodatkiem inhibitora. Otrzymano:
Początkowe stężenie substratu [μM] |
bez inhibitora |
działanie inhibitora |
|
E mod |
E nie mod. |
|
v0 |
v0 |
1 V0 |
1 V0 |
1 V0 |
5 10 15 20 26 |
1,8 2,0 2,4 2,6 2,7 |
1,3 1,4 1,8 2,1 3,1 |
0,2 0,1 0,07 0,05 0,04 |
0,56 0,50 0,47 0,38 0,37 |
0,77 0,71 0,65 0,48 0,32 |
|
|
|
|
||
Jeśli mamy inhibicję kompetencyjną to przeciwdziałamy dodając substrat.
Jeśli mamy inhibicję niekompetencyjną to dodając drobnocząsteczkowy substrat wiążąc inhibitor.
9
Wyszukiwarka
Podobne podstrony:
zadania3-wplyw temperatury na szybkosc reakcji
zadania3 wplyw temperatury na szybkosc reakcji
02 3 Szybkość reakcji chemicznych zadania do lekcji nr 2
02 3 FOLIA Szybkość reakcji chemicznych zadania do lekcji nr 1
BADANIE WP YWU ST ENIA NA SZYBKO REAKCJI CHEMICZNYCH
zaleznosc stalej szybkosci reakcji od temp
Stała szybkości reakcji jodowania acetonu, Magdalena Jabłońska
pytania z katalizy, Poda˙ wymiar sta˙ych szybko˙ci reakcji w r˙wnaniu szybko˙ci:
chemia, SZYBKO~1, Szybkość reakcji można zdefiniować jako stosunek ubytku stężenia substratu lub jak
szybkość reakcji
Szybkość reakcji, Szkoła, penek, Przedmioty, Chemia, Laboratoria
Wpływ aktywatorów i inhibitorów na szybkość reakcji enzymatycznej
zaliczenie wyk-adu 1, Poda˙ wymiar sta˙ych szybko˙ci reakcji w r˙wnaniu szybko˙ci:
SZYBKOŚĆ REAKCJI JONOWYCH W ZALEŻNOŚCIOD SIŁY JONOWEJ s jonowe
05 Szybkośc reakcji chemicznych instrukcja
05 Szybkośc reakcji chemicznych II sprawozdanie
5.Badanie wpływu stężenia substancji reagujących na szybkość reakcji chemicznej., Państwowa Wyższa S
WPŁYW TEMPERATURY NA SZYBKOŚĆ REAKCJI, NAUKA, chemia, lab
więcej podobnych podstron