Mol i masa molowa, objętość molowa gazów,
obliczenia stechiometryczne
kl. I c grupa 1
imię i nazwisko: .....................................................................................................
Zdefiniuj pojęcia: (2p)
prawo zachowania masy ..........................................................................
..................................................................................................................warunki normalne ...................................................................................
.................................................................................................................
Podaj wzór związku, w którym stosunek molowy pierwiastków wynosi: (2p)
nCu : nP : nO = 2:2:7 wzór: ..............................
nP : nCl = 1:5 wzór: ..............................
Podaj stosunek molowy pierwiastków w następujących związkach: (2p)
Ca3(PO4)2 SnO2
nCa : nP : nO nSn : nO
...... : ..... : ....... ....... : .......
Podaj stosunek molowy reagentów w następującej reakcji chemicznej: (1p)
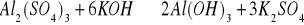
nAl2(SO4)3 : nKOH : nAl(OH)3 : nK2SO4
...................... : ............. : ................. : ...............
Równanie następującej reakcji można zinterpretować: (1p)
![]()
1 mol N2O5 reaguje z 1 molem H2O tworząc 2 cząsteczki HNO3
1 mol N2O5 reaguje z 1 cząsteczką H2O tworząc 2 cząsteczki HNO3
1 cząsteczka N2O5 reaguje z 1 molem H2O tworząc 2 mole HNO3
1 mol N2O5 reaguje z 1 molem H2O tworząc 2 mole HNO3
Stosunek masowy reagentów w następującej reakcji chemicznej wynosi: (2p)
![]()
mCO2 : mNaOH : mNa2CO3 : mH2O
.............. : ................. : ................ : ...............
Dobierz współczynniki następującej reakcji: (2p)
![]()
Oblicz, ile moli FeCl3 należy użyć do reakcji z 12 molami NaOH.
Obliczenia:
Uzupełnij tabelkę: (4,5p)
Substancja |
Liczba |
|||
|
moli cząsteczek |
cząsteczek |
moli atomów tlenu |
atomów tlenu |
HNO3 |
1 |
|
|
|
FeO |
|
|
0,5 |
|
CO2 |
|
|
|
24,088∙1023 |
Oblicz zawartość procentową bromu w tlenku bromu(I). (1p)
Obliczenia:
Zapisz równanie reakcji tlenku potasu z wodą, której produktem jest (3p)
wodorotlenek potasu. Oblicz masę powstałego wodorotlenku, jeśli do
reakcji użyto 24 g tlenku potasu (K2O).
Obliczenia:
Do spalenia 4 dm3 gazowego węglowodoru zużyto 14 dm3 tlenu, (3p)
otrzymując 8 dm3 tlenku węgla(IV) i 12 dm3 pary wodnej.
Podane objętości substancji odmierzono w takich samych warunkach
ciśnienia i temperatury.
Ustal wzór elementarny i rzeczywisty spalonego węglowodoru.
Obliczenia:
wzór elementarny: ......................... wzór rzeczywisty: .........................
Oblicz objętość 102,4 g jodowodoru (HI) (warunki normalne) (1p)
Obliczenia:
Do reakcji sodu z chlorem użyto 10 g sodu i 5,6 dm3 chloru (war. norm.) (3p)
Oblicz:
masę powstałego chlorku sodu
którego substratu i w jakiej ilości użyto w nadmiarze.
Obliczenia:
Oblicz masę 12 dm3 NO2 w temperaturze 303 K i pod ciśnieniem 920 hPa. (2,5p)
Obliczenia:
Oblicz objętość azotu, jaką użyto do reakcji z wodorem, jeśli otrzymano (3p)
3,8 m3 amoniaku (warunki normalne). Wydajność reakcji wynosi 70%.
Obliczenia:
3 g stopu glinu z cynkiem roztworzono w kwasie solnym i otrzymano (3p)
2,38 dm3 wodoru (warunki normalne). Oblicz skład procentowy stopu.
Mol i masa molowa, objętość molowa gazów,
obliczenia stechiometryczne
kl. I c grupa 2
imię i nazwisko: .....................................................................................................
Zdefiniuj pojęcia: (2p)
prawo stałości składu ................................................................................
.....................................................…..........................................................masa molowa ............................................................................................
...................................................................................................................
Podaj wzór związku, w którym stosunek molowy pierwiastków wynosi: (2p)
nNa : nS : nO = 2:2:3 wzór: ..............................
nS : nF = 1:6 wzór: ..............................
Podaj stosunek molowy pierwiastków w następujących związkach: (2p)
Al2(SO4)3 FeBr3
nAl : nS : nO nFe : nBr
...... : .... : ...... ...... : .......
Podaj stosunek molowy reagentów w następującej reakcji chemicznej: (1p)
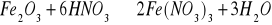
nFe2O3 : nHNO3 : nFe(NO3)3 : nH2O
................ : ............... : .................. : ...............
Równanie następującej reakcji można zinterpretować: (1p)
![]()
2 cząsteczki SO2 reagują z 1 cząsteczką O2 tworząc 2 mole SO3
2 cząsteczki SO2 reagują z 1 molem O2 tworząc 2 mole SO3
2 mole SO2 reagują z 1 molem O2 tworząc 2 mole SO3
2 mole SO2 reagują z 1 molem O2 tworząc 2 cząsteczki SO3
Stosunek masowy reagentów w następującej reakcji chemicznej wynosi: (2p)
![]()
mSO3 : mKOH : mK2SO4 : mH2O
................ : ................. : ................. : ................
Dobierz współczynniki następującej reakcji: (2p)
![]()
Oblicz, ile moli Cu(OH)2 należy użyć do reakcji z 5 molami HNO3.
Obliczenia:
Uzupełnij tabelkę: (4,5p)
Substancja |
Liczba |
|||
|
moli cząsteczek |
cząsteczek |
moli atomów wodoru |
atomów wodoru |
H2SO4 |
|
12,044∙1023 |
|
|
HCl |
1 |
|
|
|
NH3 |
|
|
9 |
|
Oblicz zawartość procentową sodu w tlenku sodu. (1p)
Obliczenia:
Zapisz równanie reakcji termicznego rozkładu wodorotlenku żelaza(III), (3p)
której produktem jest tlenek żelaza(III) i woda. Oblicz masę powstałego
tlenku (Fe2O3), jeśli uległo rozkładowi 45 g wodorotlenku.
Obliczenia:
Do spalenia 4 dm3 gazowego węglowodoru zużyto 22 dm3 tlenu, (3p)
otrzymując 16 dm3 tlenku węgla(IV) i 12 dm3 pary wodnej.
Podane objętości substancji odmierzono w takich samych warunkach
ciśnienia i temperatury.
Ustal wzór elementarny i rzeczywisty spalonego węglowodoru.
Obliczenia:
wzór elementarny: ......................... wzór rzeczywisty: .........................
Oblicz objętość 202,5 g bromowodoru (HBr) (warunki normalne). (1p)
Obliczenia:
Do reakcji wapnia z tlenem użyto 20 g wapnia i 6,72 dm3 tlenu (w. norm.). (3p)
Oblicz:
masę powstałego tlenku wapnia
którego substratu i w jakiej ilości użyto w nadmiarze.
Obliczenia:
Oblicz masę 10 dm3 SO2 w temperaturze 298 K i pod ciśnieniem 980 hPa. (2,5p)
Obliczenia:
Oblicz objętość tlenu, jaką użyto do reakcji z tlenkiem azotu(II), jeśli (3p)
otrzymano 10,3 m3 tlenku azotu(IV) w warunkach normalnych.
Wydajność reakcji wynosi 90%.
Obliczenia:
5 g stopu glinu z krzemem roztworzono w kwasie solnym i otrzymano (3p)
5,6 dm3 wodoru (warunki normalne). Oblicz skład procentowy stopu.
Wyszukiwarka
Podobne podstrony:
stechiometria zadania, AdrianM, LO, CHEMIA, ZADANIA
chemia zadania 2 id 113035 Nieznany
Chemia zadania D
Chemia zadania 1
Chemia zadania, doświadczenia
alkohole - zadania, Matura, Chemia, zadania z organicznej
powtórka 2 zadania, Chemia zadania
zbior zadan z chemmiii, chemia, zadania
Chemia pomoce naukowe, Chemia zadania sciaga, Chemia zadania
Chemia pomoce naukowe, Chemia zadania sciaga, Chemia zadania
Chemia Zadania pH
Chemia zadania 5
zadania dodatkowe - dyfuzja i gestość, chemia, zadania dodatkowe
zadania dodatkowe - wiazania i izotopy, chemia, zadania dodatkowe
zadania dodatkowe - wzory, chemia, zadania dodatkowe
zadania na cp, chemia-zadania
CHEMIA ZADANIA MOLOWE, TEST CHEMIA: MOLE
więcej podobnych podstron