ĆWICZENIE NR 1
KALORYMETRIA-WYZNACZANIE CIEPŁA NEUTRALIZACJI KWASU ZASADĄ
Celem ćwiczenia jest wyznaczenie ciepła neutralizacji silnego kwasu silną zasadą
1.Wyniki pomiarów:
Rgrzałki = 49,3Ω
τgrzałki = 3minuty
I = 126,8 mA
Vkwasu = 5 cm3 Ckwasu = 0,5M
Vzasady = 190 cm3 Czasady = 0,1M
Bieg układu reakcyjnego: |
Bieg układu kalorymetrycznego |
||
t (s) U [mV] |
U [mV] |
t (s) |
|
0 |
0,00 |
0 |
0,00 |
30 |
0,04 |
30 |
0,04 |
60 |
0,09 |
60 |
0,09 |
90 |
0,13 |
90 |
0,13 |
120 |
0,16 |
120 |
0,19 |
150 |
0,21 |
150 |
0,22 |
180 |
0,28 |
180 |
0,27 |
210 |
0,30 |
210 |
0,31 |
240 |
0,35 |
240 |
0,37 |
270 |
0,37 |
270 |
0,41 |
300 |
0,40 |
300 |
0,47 |
330 |
0,47 |
330 |
0,52 |
360 |
0,49 |
360 |
0,57 |
390 |
0,51 |
390 |
0,61 |
420 |
0,54 |
420 |
0,65 |
450 |
0,59 |
450 |
0,71 |
480 |
0,64 |
480 |
0,77 |
510 |
0,65 |
510 |
0,82 |
540 |
0,69 |
540 |
0,88 |
570 |
0,75 |
570 |
0,90 |
600 |
0,80 |
600 |
0,98 |
630 |
4,59 |
630 |
1,20 |
660 |
6,10 |
660 |
1,97 |
690 |
6,36 |
690 |
2,89 |
720 |
6,43 |
720 |
3,81 |
750 |
6,50 |
750 |
4,81 |
780 |
6,58 |
780 |
5,68 |
810 |
6,63 |
810 |
6,55 |
840 |
6,67 |
840 |
6,63 |
870 |
6,70 |
870 |
6,68 |
900 |
6,74 |
900 |
6,75 |
930 |
6,76 |
930 |
6,81 |
960 |
6,81 |
960 |
6,86 |
990 |
6,84 |
990 |
6,90 |
1020 |
6,88 |
1020 |
6,96 |
1050 |
6,91 |
1050 |
6,99 |
1080 |
6,94 |
1080 |
7,03 |
1110 |
6,97 |
1110 |
7,10 |
1140 |
7,04 |
1140 |
7,13 |
1170 |
7,07 |
1170 |
7,20 |
1200 |
7,11 |
1200 |
7,22 |
2.Obliczenia:
Na podstawie powyższych danych sporządzam wykresy zależności U= f(t) celem określenia wartości ΔU dla układu kalorymetrycznego jak i dla reakcji:
ΔU dla układu kalorymetrycznego: 6,25-1,1=5,15[mV]
ΔU dla reakcji : 6,26-0,9= 5,36[mV]
a) pojemności cieplnej K układu kalorymetrycznego
Pojemność cieplną kalorymetru dla każdego z pomiarów kalibracyjnych obliczamy ze wzoru:
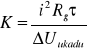
K=![]()
ilości ciepła jaka wydzieliła się podczas reakcji
Ilość ciepła jaka wydzieliła się podczas reakcji obliczamy z wzoru:
![]()
![]()
Ujemna wartość ciepła reakcji świadczy o tym, że reakcja neutralizacji kwasu zasadą jest reakcją egzotermiczną.
c) wyznaczenie molowego ciepła reakcji w kalorymetrze
Obliczamy liczbę moli kwasu:
![]()
ciepło molowe reakcji w kalorymetrze na mol kwasu:
![]()
wykres Q= f(C)
Wartości literaturowe ciepła rozpuszczania HCl dla 1mola kwasu w zależności od liczby moli wody :
Liczba moli wody [mol] |
Ciepło rozpuszczania kwasu
|
Objętość wody [dm3] |
Stężenie |
1600 |
-73,43 |
28,80 |
0,035 |
400 |
-73,091 |
7,200 |
0,140 |
100 |
-72,492 |
1,800 |
0,556 |
25 |
-71,028 |
0,45 |
2,222 |
15 |
-69,77 |
0,27 |
3,704 |
10 |
-68,18 |
0,18 |
5,556 |
5 |
-62,95 |
0,09 |
11,111 |
Obliczenia :
objętość wody
np.
nH2O=1600moli
MH2O=18![]()
dH2O=1![]()
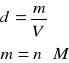
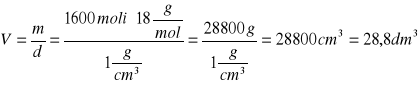
stężenie
nHCl=1 mol ![]()
V=28,8 dm3
dla nieskończonej ilości moli wody = -73,769 kJ/mol. Na podstawie danych literaturowych sporządzam wykres Q=f(C).Zależność tę można przyjąć za liniową.Za pomocą równania opisującego wykres obliczam wartość ciepła rozpuszczania dla wartości początkowej stężenia
stężenie początkowe kwasu : Cp=0,5M
stężenie końcowe kwasu: Ck=0
Ciepło rozpuszczania kwasu dla stężenia początkowego: ![]()
Ciepło rozpuszczenia kwasu dla stężenia końcowego: ![]()
e) Obliczenie wartości ciepła rozpuszczania kwasu ( Q1)
Ciepło rozpuszczania kwasu: ![]()
f) Ciepło neutralizacji kwasu:
Qn = Q - Q1
![]()
Dane literaturowe: ![]()
Błąd względny wyznaczenia ciepła neutralizacji kwasu:
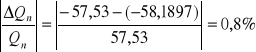
Dyskusja błędu:
podczas doświadczenia dokonujemy następujących błędów pomiaru:
błędu wyznaczenia oporności grzałki
błąd pomiaru czasu
TECHNOLOGIA CHEMICZNA,IIrok
Wyszukiwarka
Podobne podstrony:
Sprawka Lab, Bomba Kalorymetryczna - spr, Ćwiczenie nr:
cwiczenie nr 1 2011 10 02 13 35 22
02 Kalorymetria, Kalorymetria 8, Monika Wiśniewska, grupa 1
02 Kalorymetria, Kalorymetria 8, Monika Wiśniewska, grupa 1
Cwiczenie nr 02 Sprzet i technika pracy laboratoryjnej
Cwiczenie nr 02 Sprzet i technika pracy laboratoryjnej
InstrukcjeĆw.2009 2010, Cw.3.M-01,M-02.Równia pochyła.Wahadło, Laboratorium Fizyki; ćwiczenie Nr 1
02, Ćwiczenie nr 2, Ćwiczenie nr 2
02 Kalorymetria, Kalorymetria 4, Marchewicz Tomasz
sprawko bomba kalorymetryczna ćw nr 7
ĆWICZENIE NR 02 Wyznaczanie gęstości właściwej i objętościowej szkieletu gruntowego oraz gęstości o
Kształcenie ruchowe – ćwiczenia nr 1 (21 02 12r ) i ćwiczenianr 2 (28 02 12r )
Ćwiczenia nr 6 (2) prezentacja
cwiczenie nr 7F
cwiczenie nr 2
Ćwiczenie nr 4
więcej podobnych podstron