Marek Dąbrowski IM sem. IV
MIARECZKOWANIE KONDUKTOMETRYCZNE
1. Miareczkowanie mocnego kwasu mocną zasadą.
Podczas miareczkowania roztworu kwasu solnego roztworem wodorotlenku sodu zachodzi reakcja:
![]()
W miarę dodawania titranta ruchliwe jony wodorowe obecne w roztworze kwasu solnego zostają związane elektrycznie neutralne, nieprzewodzące prądu elektrycznego cząsteczki wody. Na miejsce tych jonów do roztworu zostają wprowadzone mniej ruchliwe jony sodowe i przewodność elektrolityczna roztworu, początkowo dość duża, stopniowo, w miarę dodawania roztworu zasady, maleje. W momencie osiągnięcia punktu równoważnikowego ilość moli dodanego podczas miareczkowania wodorotlenku sodu jest równa ilości kwasu solnego obecnego początkowo w badanym roztworze. Od tego momentu obserwuje się znaczny wzrost przewodności elektrolitycznej wynikający z dodawania nadmiaru titranta, czyli wprowadzania ruchliwych jonów OH-. Wzrost ten nie jest tak wyraźny jak obserwowany uprzednio spadek. Wynika z tego, że odpowiedzialne za ten efekt jony są mniej ruchliwe niż jony H+.
Liczbę moli kwasu solnego oblicza się z wzoru:
![]()
; ![]()
; ![]()
; ![]()
Stężenie jodu w próbce obliczamy ze wzoru:
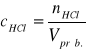
; ![]()
; ![]()
2.Miareczkowanie słabego kwasu mocną zasadą.
Podczas miareczkowania kwasu octowego roztworem wodorotlenku sodu zachodzi reakcja:
![]()
W wyniku, której powstaje mocny elektrolit, czyli dobrze dysocjowany octan sodu. Efekt tej przemiany jest wyraźny, stopniowy wzrost przewodności elektrolitycznej roztworu i tym samym mierzonego przewodnictwa. Po punktu równoważnikowego następuje silny wzrost przewodnictwa związany ze wzrastającym stężeniem obdarzonych dużą przewodnością molową jonów OH-. W bezpośrednim sąsiedztwie punktu równoważnikowego linie proste obrazujące wzrost przewodności ulegają zakrzywieniu.
Liczbę moli kwasu octowego oblicza się z wzoru:
![]()
; ![]()
; ![]()
; ![]()
Stężenie jodu w próbce obliczamy ze wzoru:
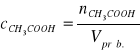
; ![]()
; ![]()
3.Miareczkowanie kwasów dwuzasadowych.
Podczas miareczkowania kwasu szczawiowego zachodzą dwie reakcje:
Pierwsza opadająca część krzywej miareczkowania konduktometrycznego opisuje reakcja:
![]()
Druga część krzywej miareczkowania konduktometrycznego opisuje reakcja:
![]()
Podstawową właściwością kwasów dwuzasadowych jest to, że ulegają stopniowej dysocjacji. Stała dysocjacji pierwszego stopnia jest znacznie wyższa od stałej dysocjacji drugiego stopnia, K1>K2, i roztwór takiego kwasu można traktować jako roztwór kwasu o średniej mocy. Pierwsza, opadająca część krzywej miareczkowania konduktometrycznego odpowiada reakcji pierwszej. Obserwowane w miarę, postępu miareczkowania zmniejszenie się przewodności elektrolitycznej związane jest z wiązaniem jonów wodorowych, czyli zobojętnieniem względnie silnego kwasu. Druga lekko wznosząca się część krzywej miareczkowania konduktometrycznego, odpowiada odmiareczkowaniu drugiej grupy karboksylowej, czyli tej, która ma znacznie słabsze własności kwasowe. Ostatni odcinek krzywej miareczkowania konduktometrycznego pokazuje wyraźny wzrost przewodności elektrolitycznej, związany z wzrastającym nadmiarem titranta. Na krzywej znajdują się dwa punkty załamania, odpowiadające kolejno pierwszej i drugiej grupy karboksylowej. Objętość dodanego roztworu NaOH odpowiadająca pierwszemu załamaniu równa jest objętości roztworu dodanego między pierwszym a drugim załamaniem.
Liczbę moli kwasu szczawiowego oblicza się z wzoru:
![]()
; ![]()
;
![]()
; ![]()
; ![]()
Stężenie jodu w próbce obliczamy ze wzoru:
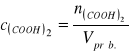
; ![]()
; ![]()
4. Źródła błędów
Źródłem błędów podczas wykonywania pomiarów mogły być wahania temperatury, źle odczytywane wartości dodawanego titranta. Odczytywane wartości przewodności elektrolitycznej są również błędem.
Wyszukiwarka
Podobne podstrony:
05 Konduktometria, naoh,nh3h2o,ch3cooh, Marek Mokrzycki IM sem
Miareczkowanie konduktometryczne kwasu solnego, Studia - IŚ - materiały, Semestr 05, Ochrona powietr
podrecznik 2 18 03 05
regul praw stan wyjątk 05
05 Badanie diagnostyczneid 5649 ppt
Podstawy zarządzania wykład rozdział 05
05 Odwzorowanie podstawowych obiektów rysunkowych
05 Instrukcje warunkoweid 5533 ppt
05 K5Z7
05 GEOLOGIA jezior iatr morza
05 IG 4id 5703 ppt
05 xml domid 5979 ppt
Świecie 14 05 2005
Wykł 05 Ruch drgający
TD 05
więcej podobnych podstron