Tyrozynaza
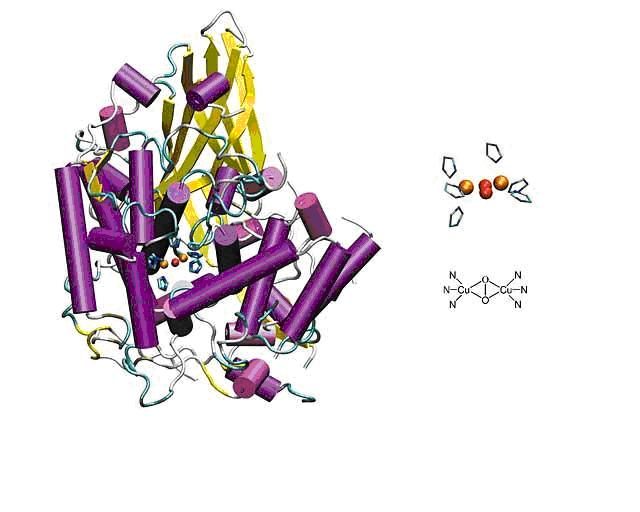
Głównym enzymem uczestniczącym w szlaku syntezy melanin jest tyrozynaza, należąca do klasy oksydoreduktaz (EC 1.14.18.1) i nazywana oksydazą polifenolową lub oksydazą o- difenolową. O specyficznej aktywności enzymu decydują dwa atomy miedzi w centrum aktywnym, które mogą zmieniać swój stopień utlenienia, co decyduje o zdolnościach enzymu do przeprowadzania reakcji redoks i utleniania oraz redukcji substratów.(5) Tyrozynaza wykazuje szereg aktywności, tj. aktywność difenolazy, co wiąże się z przenoszeniem dwóch elektronów na substrat oraz generowaniem cząsteczek nadtlenku wodoru, aktywność fenolazy, która decyduje o przeniesieniu czterech elektronów, bez jednoczesnego powstania nadtlenku wodoru.
Kolejną aktywnością enzymu jest aktywność peroksydazy oraz katalazy, dzięki którym tyrozynaza może unieszkodliwiać nadtlenek wodoru, który powstał we wcześniejszych etapach przemian.(6)
Optymalne pH do działania tyrozynazy to 6.8, natomiast punkt izoelektryczny białka to 6.95. Enzym jest wrażliwy na działanie cyjanków, w przypadku ich obecności ulega on inhibicji.
Tyrozynaza znajduje się wewnątrz melanosomów , przede wszystkim jej część z centrum aktywnym, natomiast fragment enzymu jest zlokalizowany w poprzek pojedynczej błony fosfolipidowej, a kolejny jest wystawiony do cytoplazmy, jego zadaniem jest odbieranie sygnałów i przekazywanie ich do wnętrza melanosomów, tak, aby przyspieszyć, lub zahamować syntezę melanin.
Ważnym dla szlaku biosyntezy melanin enzymem jest również białko zależne od tyrozynazy 1, należy ono do klasy oksydoreduktaz i do rodziny tyrozynaz, w jego centrum aktywnym również znajdują się dwa atomy miedzi. Białko to jest, podobnie jak tyrozynaza, białkiem transbłonowym: jego cząsteczka przenika przez błonę fosfolipidową melanosomu
Wyszukiwarka
Podobne podstrony:
Oddychanie komorkowe i fosforylacja oksydacyjna
polifenole systematyka
12 Biochemia fosforylacja oksydacyjna nowa
Transport elektronów i fosforylacja oksydacyjna, biochemia
Stres oksydacyjny
Inhibitory oksydazy cytochromowej
PRZYGODA ODYSEUSZA Z POLIFEM
w09 Reakcje oksydacyjno -, In˙ynieria Ruchu Morskiego, rok I, gr
Stres oksydacyjny
OZNACZANIE POLIFENOLI OGÓŁEM(2) NIE
moje sprawozdania, polifenole ogółem
(3wysł) polifenole, aldehydy, ketony,kwasy,mydła 2010 11(1)
6a WYKŁAD Fosforylacja oksydacyjna
Ćwiczenie 1 oksydaza glukozowa
FOSFORYLACJA OKSYDACYJNA
FOSFORYLACJA OKSYDACYJNA - PREZENTACJA, Weterynaria rok 1, Biochemia
biologia, NAPRAWA DNA, Mechanizmy naprawy oksydacyjnych uszkodzeń DNA
Łańcuch oddechowy, fosforylacja oksydacyjna
więcej podobnych podstron