
SPRAWOZDANIE 2
twardość wody
agresywny dwutlenek węgla
oznaczenia siarczanów
Monika Zając
Barbara Zamojska
WIŚ, BUDOWNICTWO, GRUPA 5C
26.10.2011r.
1a. TWARDOŚĆ WODY
Twardość wody powodują rozpuszczone w niej sole wapnia, magnezu i metali wielowartościowych. Rozróżnia
się następujące rodzaje twardości wody:
twardość węglanowa (Tw
w
)
twardość niewęglanowa zwana stałą (Tw
NW
)
twardość ogólna lub całkowita (Tw
o
)
Twardość węglanowa (Tw
W
)
Twardość niewęglanowa (Tw
NW
)
Twardość ogólna (Tw
o
)
zwana też przemijającą
spowodowana jest obecnością
kwaśnych węglanów wapnia i
magnezu. Twardość tę można
usunąć przez zagotowanie wody.
Ca(HCO
3
)
2
-->CaCO
3
+ H
2
O + CO
2
Mg(HCO
3
) -->MgCO
3
+ H
2
O + CO
2
spowodowana jest zawartością w wodzie
chlorków, azotanów, siarczanów, krzemianów
i innych rozpuszczalnych soli wapnia i magnezu.
twardość wapniowa (Tw
Ca
)
twardość magnezowa (Tw
Mg
)
jest sumą twardości
węglanowej i
niewęglanowej:
(Tw
o
) = (Tw
w
) + (Tw
NW
)
Twardość wody wyraża się w następujących jednostkach:
1 mval/dm
3
– 2,8
◦
tw
1 mval/dm
3
- 50 mg CaCO
3
/dm
3
1 mval/dm
3
- 20 mg Ca
2+
/dm
3
1 mval/dm
3
– 12 mg Mg
2+
/dm
3
Twardość wód naturalnych, w zależności od ich pochodzenia, zawiera się w granicach od 8 do 30◦tw. Typowa
twardość wody użytkowej (kranowej) wynosi ok. 10 °n. Twardość wody pitnej wg norm polskich powinna
wynosić 60–500 mg CaCO
3
/dm
3
Nadmierna twardość wody jest zjawiskiem niepożądanym zarówno w procesach przemysłowych (kotły parowe,
układy chłodnicze, przemysł włókienniczy), jak i dla celów konsumpcyjnych. Podczas ogrzewania na ściankach
garnków, kotłów itp. powstaje kamień kotłowy, który pogarsza przewodnictwo cieplne, co w konsekwencji
powoduje straty energetyczne, jak również może być przyczyną poważnych awarii.
W gospodarstwie domowym nadmierna twardość wody powoduje większe zużycie środków piorących. W tym
wypadku jony wapnia i magnezu wiążą się z resztą kwasu tłuszczowego i wytrącają się w postaci trudno
rozpuszczalnych soli wyższych kwasów tłuszczowych.
2(C
15
H
31
COO
-
) + Ca
2+
--> (C
15
H
31
COO)
2
Ca (osad)
Skąd bierze się twardośc wody? Sole wodorowęglanowe wapnia i magnezu dostają się do wody w wyniku
kontaktu rozpuszczonego w niej CO
2
z glebą i skałami mającymi w skłądzie wapienie i magnezyty. Trudno
rozpuszczalne w wodzie wapienie i magnezyty zostają przekształcone w dobrze rozpuszczalne w wodzie
wodorowęglany wapnia i magnezu (chemicznym wietrzeniem wapieni). Reakcje wyglądają następująco:
CaCO
3
+ CO
2
+ H
2
O <-> Ca(HCO
3
)
2
MgCO
3
+ CO
2
+ H
2
O <-> Mg(HCO
3
)
2
1b. Przebieg ćwiczenia
Badanie twardości ogólnej (T
o
) przebiega następująco:
1. Odmierzamy pipetą 100 cm3 badanej wody i przelewamy ją do kolby stożkowej.
2. Dodajemy taką objętość 0,1n HCl z biurety, jaką użyto do wcześniej wykonanego oznaczenia
zasadowości tej próbki (tu 1,9ml).
3. Dodajemy 1 cm
3
buforu amoniakalnego oraz odrobinę czerni eriochromowej do uzyskania barwy
różowo-fioletowej i mieszamy.
4. Miareczkujemy standardowym roztworem wersenianu sodu do zmiany barwy na niebieską.
Odczytujemy objętość wersenianu zużytego do miareczkowania próbki.
5. Miareczkowanie powtarzamy jeszcze 2-krotnie, a jako wynik przyjmujemy średnią wartość objętości
zużytego wersenianu.
1c. Obliczanie wyników:
Tw
W
= zasadowość
=
∙ ∙
[
]
=
1,9 ∙ 0,1 ∙ 1000
100
= 1,9 [
mval
dm
]
Twardość niewęglanową (Tw
NW
) obliczamy ze wzoru: Tw
NW
= Tw
o
– Tw
Twardość ogólną (Tw
o
) obliczamy ze wzoru: Tw
o
=
∙ , ∙
[°
]
a – ilość cm3 roztworu wersenianu sodu zużytego do zmiareczkowania próbki,
V - objętość badanej próbki, użytej do oznaczenia (cm3).
Tw
o
= x =
,
∙ , ∙
=
= 5,27 [°tw]
Tw
o
= x’ =
,
∙ , ∙
∙ ,
=
≈ 1,88 [mval/dm ]
Tw
o
= x’’ =
,
∙ , ∙
∙ ,
∙ 50 =
≈
≈ 94,11 [mg CaCO /dm ]
Tw
Ca
= y =
,
∙ , ∙
=
= 4,2 [°tw]
Tw
Ca
= y’ =
,
∙ , ∙
∙ ,
= = 1,5 [mval/dm ]
Tw
Ca
= y’’ =
,
∙ , ∙
∙ ,
∙ 50 =
= 75 [mg Ca /dm ]
[mval/dm ]
[°tw]
[mg CaCO /dm ]
Tw
o
1,88
5,27
94,11
Tw
Ca
1,5
4,2
75
30 [mg Ca /dm ]
Tw
Mg
0,4
1,1
19,1
4,8 [mg Mg /dm ]
Tw
w
1,9
5,32
95
Tw
NW
0 (bo ujemne)
0
0
Ujemne wartości twardości stałej (Tw
NW
) wskazują iż najprawdopodobniej miareczkowanie zostało wykonane
mało dokładnie. Spowodowane to może być m.in. poprzez dość umowną granicę zmiany barwy roztworu (przy
różnej wartości zużycia HCL lub wersenianu sodowego podczas procesu miareczkowania).
TW. OGÓLNA
5,4ml
5,1ml
5,3ml
TW. WAPNIOWA
4,1ml
4,2ml
4,3ml
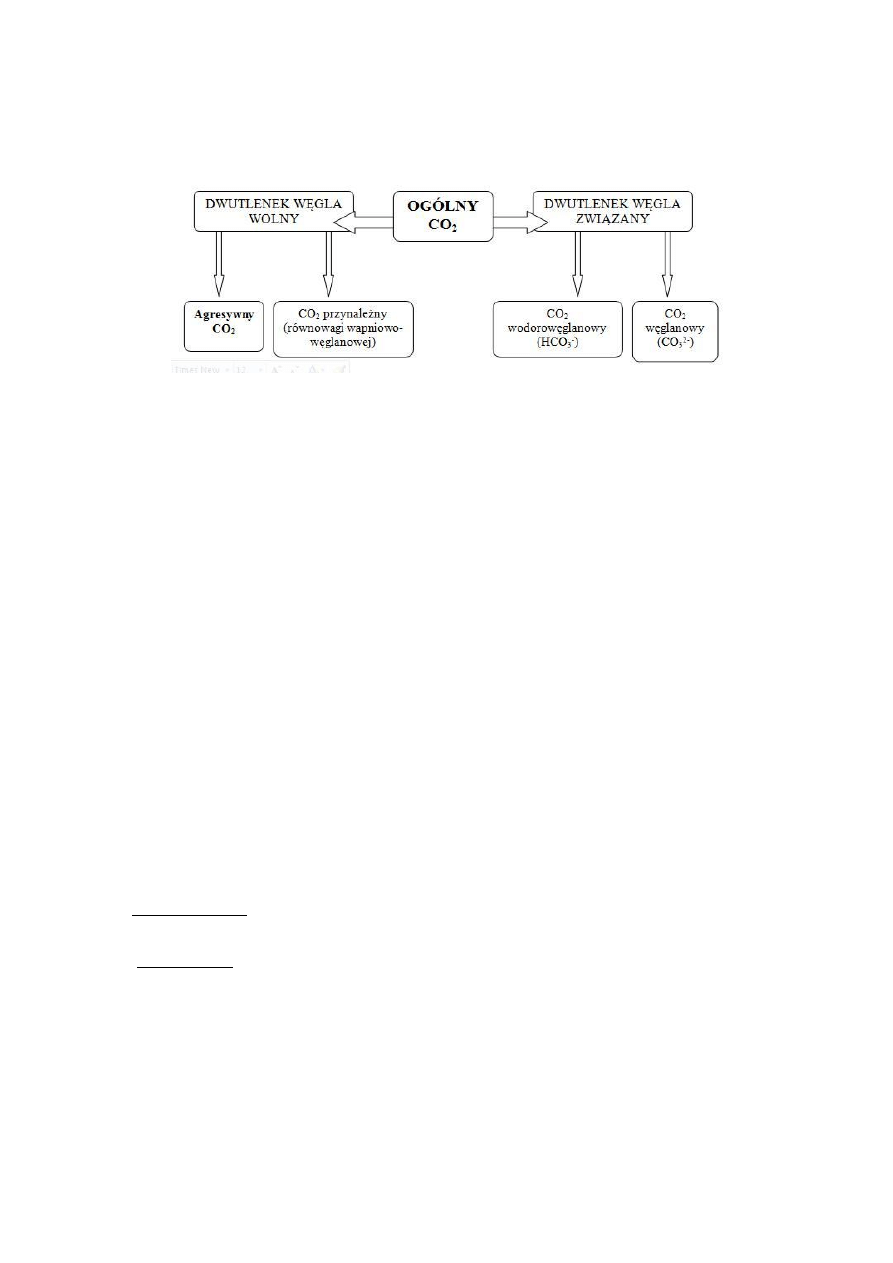
2a. AGRESYWNY DWUTLENEK WĘGLA
Dwutlenek węgla może występować w wodzie pod różnymi postaciami:
Część rozpuszczonego w wodzie gazowego dwutlenku węgla przekraczająca stężenie CO
2
nieodzowne
dla utrzymania się w stanie rozpuszczonym występujących w wodzie wodorowęglanów. Agresywny
dwutlenek węgla wykazuje działanie agresywne w stosunku do ośrodka skalnego, betonu i metali.
Obecność dwutlenku węgla w wodach naturalnych stwarza poważne problemy gospodarcze i
techniczne ze względu na powodowanie korozji urządzeń metalowych i betonowych. Zasada
oznaczenia polega na reakcji agresywnego dwutlenku węgla
z dodanym do wody marmurem (CaCO
3
). Tworzy się rozpuszczalny wodorowęglan wapniowy, który
powoduje wzrost zasadowości wody.
Oznaczanie agresywnego dwutlenku węgla wykonuje się w próbie z marmurem, gdyz agresywny
dwutlenek węgla reaguje z marmurem w myśl równania:
CO
2
+ CaCO
3
+ H
2
O = Ca(HCO
3
)
2
Powstaje wówczas rozpuszczalny wodorowęglan wapniowy Ca(HCO
3
)
2
, który powoduje przyrost
zasadowości wody.
2b. Przebieg ćwiczenia
Oznaczanie agresywnego dwutlenku węgla polega na określeniu o ile wzrosła zasadowość wody, do
której dodano marmur, w stosunku do zasadowości pierwotnej (bez marmuru).
CaCO
3
+ CO
2
+ H
2
O → Ca(HCO
3
)
2
RÓWNANIE ROWNOWAGI CHEMICZNEJ
2HCO
3
→←CO
3
2-
+ CO
2
+ H
2
O
[ Ca
2+
+ 2HCO
3
-
→← CaCO
3
+ CO
2
+ H
2
O ]
K =
[
]
[
][
][
]
K
r
=
[
]
[
]
I: Woda naturalna jest w równowadze węglanowo – wapniowej:
wolny CO
2
= przynależny CO
2,
a agresywny = 0.
II: zawartość wolnego CO
2
>przynależnego CO
2
=> wolny CO
2
–przynależny
CO
2
=agresywny
CO
2
III: zawartość wolnego CO
2
< przynależnego CO
2
Wykonanie ćwiczenia:
W badanej cieczy oznaczamy zasadowość M (wobec ORANŻU METYLOWEGO).

Do butelki o pojemności 125 cm3 z nasypanym wcześniej CaCO3
(„marmurkiem”) wlewamy do pełna badaną ciecz tak, aby po zamknięciu butelki
korkiem szklanym, nie znajdował się w niej pęcherzyk powietrza.
Podpisaną butelkę odstawiamy na 7 dni. Po 7 dniach zawartość butelki przesączamy przez
odpowiedni sączek.
Odmierzamy 100 cm3 przesączu do kolby stożkowej. Dodajemy 3 krople ORANŻU
METYLOWEGO i miareczkujemy 0,1n KWASEM
SOLNYM (HCl) do pierwszej zmiany zabarwienia z żółtej na łososiową.
Odczytujemy objętość HCl zużytego do zmiareczkowania próbki.
2c. Obliczanie wyników:
=
(
)∙ , ∙
[mgCO2/ dm3]
gdzie:
X – stężenie agresywnego dwutlenku węgla,
a – objętość 0,1n HCl zużytego do oznaczenia zasadowości na początku oznaczenia
(pierwszego dnia),
b - objętość 0,1n HCl zużytego do oznaczenia zasadowości po 7 dniach,
V- objętość badanej próbki, użytej do miareczkowania (cm3)
=
,
,
∙ , ∙
mgCO2/ dm3 = 13,2 mgCO2/ dm3
UWAGA!
Metoda ta daje dobre wyniki, gdy zasadowość wody wynosi powyżej 1mval/dm
3
. Gdy SA niższe
zasadowości, otrzymuje się wyniki zbyt wysokie, gdyż rozpuszczalność węglanu wapniowego w
wodzie destylowanej, wolnej od dwutlenku węgla, wynosi około 14mg/dm
3
, co odpowiada 6,8
mg/dm
3
agresywnego CO
2
.
3a. OZNACZENIA SIARCZANÓW
Siarczany, czyli sole kwasu siarkowego występują w wodach naturalnych od kilku do kilku tysięcy
miligramów/dm
3
. Są anionem powszechnie występującym w wodach. Siarczany dostają się do wody
na skutek wymywania skał osadowych, w skład, których wchodzi gips(CaSO
4
*2H
2
O), wyługowania
gleby oraz niekiedy podczas utleniania siarczków metali ciężkich powstają siarczany tych metali i
kwas siarkowy według następujących reakcji:
PbS+2O
2
=PbSO
4
2FeS
4
+7O
2
+2H
2
O=2FeSO
4
+2H
2
SO
4
Tworzący się przy tym kwas siarkowy reaguje następnie z otaczającym złożem, głównie z CaCO
3
, dając
gips i dwutlenek węgla.
Wody powierzchniowe mogą być zanieczyszczone ściekami miejskimi lub przemysłowymi
zawierającymi siarczany z produkcji kwasu siarkowego, nawozów fosforowych, farbiarni, fabryk
akumulatorów, produkcji materiałów wybuchowych, przemysłu metalowego. Ponadto źródłem
siarczanów mogą być wody kopalniane, w których siarczany występują w dużych ilościach. Zawartość
jonu siarczanowego w silnie mineralizowanych wodach kopalnianych może wynosić do kilkudziesięciu
gramów w 1 dm
3
, szczególnie, gdy w wodzie znajduje się dobrze rozpuszczalny siarczan sodowy.
Zawartość siarczanów w wodach rzek i jezior wynosi 10-60 g/m
3
, w płytkich wodach
podziemnych100g/m
3
i więcej. W wodach wgłębnych, źródlanych lub kopalnianych do 24 kg/m
3
(w
wodzie morskiej 2,7 kg/m
3
).
Wody naturalne pozbawione siarczanów spotyka się rzadko, są to głównie wody charakterystyczne
dla złóż ropy naftowej, w których zachodzi biochemiczna redukcja siarczanów do siarkowodoru.
Obecność CaSO
4
i MgSO
4
nadaje wodzie twardość niewęglanową. Toksyczność siarczanów zależy od
rodzaju kationów. Dopuszczalna ilość siarczanów w wodzie do picia nie większa niż 250 mg/dm
3
.
Wody o stężeniu siarczanów większym niż 250mg/dm
3
SO
4
2-
są korozyjne w stosunku do betonu i
konstrukcji żelbetonowych(korozja siarczanowa).
3b. Wykonanie oznaczenia:
Numer użytej do doświadczenia wody: 3
1. Do kolby stożkowej odmierzamy 100 ml badanej cieczy.
2. Dodajemy:
-3 krople oranżu metylowego
-kwas solny aż do zmiany zabarwienia na różowy i dodatkowo 3 cm
3
(jako nadmiar)
3. Otrzymany roztwór doprowadzić do wrzenia w płaszczu grzewczym.
4. Podczas wrzenia roztworu dodać kroplami 5cm
3
chlorku barowego(BaCl
2
),po czym ogrzewać
go na łaźni wodnej przez 30 minut.
5. Następnie przesączyć próbę na gorąco przez twardy, bezpopiołowy, sączek i przemyć gorącą
wodą destylowaną do zaniku reakcji na obecność jonów chlorkowych (Cl
-
) w przesączu.
6. Sączek z osadem umieścić w porcelanowym tyglu. Sączek suszymy, a następnie prażymy 800
0
C.
Po wystudzeniu ważymy tygiel.
3c. Obliczanie zawartości siarczanów:
2
4
3
/
1000
4114
,
0
SO
dm
mg
V
a
X
a – masa zważonego osadu [mg], 0,4114 – współczynnik przeliczeniowy BaSO
4
na SO
4
2-
V – objętość próbki wody użytej do oznaczenia [ml]
Wyszukiwarka
Podobne podstrony:
zagadnienia chemia wody, Politechnika Wrocławska, Inżynieria Środowiska, II rok, Chemia wody
chemia drugi spr część 2
biłyk,Chemia wody, Eutrofizacja wód
Chemia wody egzamin
temat 12, chemia wody-w-
UBOCZNE PRODUKTY, Chemia wody - (A. Biłyk)
instrukcja cw 1, II rok, II semestr, Chemia wody i powietrza
chemia wody zaliczenie
kwicińska,CHEMIA WODY I POWIETRZA,OZNACZENIE TLENU W WODZIE
kwicińska,CHEMIA WODY I POWIETRZA,OZNACZANIE CHLORKÓW I SIARCZANÓW
biłyk,Chemia wody, opracowanie zagadnień
kwicińska,CHEMIA WODY I POWIETRZA,ODCZYN
Biłyk,chemia wody, Właściwości chemiczne wody
Chemia wody pytania cz
Chemia wody i powietrza sprawozdanie 2
Chemia wody pytania cz11
CHEMIA WODY opracowanie notatek
więcej podobnych podstron