
ANALIZA JAKOŚCIOWA
Opracowanie: Krystyna Moskwa, Emil Zieliński
IV grupa analityczna kationów.
Odczynnik grupowy: (NH
4
)
2
CO
3
w obecności NH
4
Cl i NH
4
OH.
Kationy: Ba
2+
, Ca
2+
, Sr
2+
(wszystkie bezbarwne).
Do czwartej grupy analitycznej należą kationy, które nie dają osadów z odczynnikami poprzednich grup.
Wytrącają się one w postaci węglanów ze zalkalizowanych amoniakiem roztworów w obecności NH
4
Cl.
Ponieważ metale te leżą w drugiej grupie układu okresowego, ich własności są bardzo podobne. Ich sole
są na ogół nierozpuszczalne w wodzie poza azotanami i chlorkami.
Iloczyny rozpuszczalności niektórych soli tej grupy ilustruje następujące zestawienie:
kation
węglany siarczany
chromiany
Ba
2+
4,8.10
-9
1,1.10
-10
2,4.10
-10
Sr
2+
1,6.10
-9
2,8.10
-7
3,5.10
-5
Ca
2+
1.10
-8
6,1.10
-5
2,3.10
-2
Z zestawienia widać, że iloczyny rozpuszczalności węglanów są prawie równe, a iloczyny
rozpuszczalności siarczanów i chromianów maleją ze wzrostem masy atomowej. Stanowi to doskonałą
ilustrację zmian własności pierwiastków w układzie okresowym.
1. Reakcje kationu Ba2+.
1. Kwas solny, siarkowodór, siarczek amonu nie wytrącają osadu z roztworów soli baru.
2. Węglan amonu wytrąca z alkalicznych roztworów soli baru biały osad węglanu baru:
Ba(NO
3
)
2
+ (NH
4
)
2
CO
3
= BaCO
3
↓
+ 2NH
4
NO
3
lub jonowo: Ba
2+
+ CO
3
2-
= BaCO
3
↓
Osad ten łatwo roztwarza się w kwasach z wydzieleniem dwutlenku węgla:
BaCO
3
+ 2HCl = BaCl
2
+ H
2
O + CO
2
↑
3. Kwas siarkowy(VI) i siarczany(VI) wytrącają z roztworów soli baru biały krystaliczny osad BaSO
4
:
Ba2+ + SO42- = BaSO4
↓
4. Nasycony roztwór siarczanu(VI) wapnia, tzw. woda gipsowa, wytrąca z roztworów soli baru natychmiast
biały osad siarczanu(VI) baru.
BaCl
2
+ CaSO
4
= BaSO
4
↓
+ CaCl
2
5. Szczawian amonu wytrąca z roztworów soli baru biały osad szczawianu baru:
Ba(NO
3
)
2
+ (NH
4
)
2
C
2
O
4
= BaC
2
O
4
↓
+ 2NH
4
NO
3
lub jonowo: Ba
2+
+ C
2
O
4
2-
= BaC
2
O
4
↓
Osad szczawianu baru roztwarza się w kwasie octowym.
6. Chromian(VI) potasu wytrąca z roztworów soli baru żółty osad chromianu(VI) baru rozpuszczalny w
kwasach mineralnych, a nierozpuszczalny w kwasie octowym.
Ba(NO
3
)
2
+ K
2
CrO
4
= BaCrO
4
↓
+ 2KNO
3
lub jonowo: Ba
2+
+ CrO
4
2-
= BaCrO4
↓
7. Sole baru barwią płomień palnika na kolor zielony.
2. Reakcje kationu Sr2+.
1. Kwas solny, siarkowodór, siarczek amonu nie wytrącają osadu z roztworów soli strontu.
2. Węglan amonu wytrąca z alkalicznych roztworów soli strontu biały osad węglanu strontu:
SrCl
2
+ (NH
4
)
2
CO
3
= SrCO
3
↓
+ 2NH
4
Cl lub jonowo: Sr
2+
+ CO
3
2-
= SrCO
3
↓
Osad ten roztwarza się w kwasach.

3. Kwas siarkowy(VI) i siarczany(VI) strącają z roztworów soli strontu biały galaretowaty osad SrSO
4
:
Sr2+ + SO42- = SrSO4
↓
4. Woda gipsowa strąca po chwili z roztworów soli strontu biały osad siarczanu strontu.
SrCl
2
+ CaSO
4
= SrSO
4
↓
+ CaCl
2
W reakcji tej początkowo pojawia się zmętnienie, a po pewnym czasie wytrąca się osad. Ogrzewanie
przyspiesza zajście reakcji.
5. Szczawian amonu wytrąca z roztworów soli strontu biały osad szczawianu strontu:
Sr(NO
3
)
2
+ (NH
4
)
2
C
2
O
4
= SrC
2
O
4
↓
+ 2NH
4
NO
3
lub jonowo: Sr
2+
+ C
2
O
4
2-
= SrC
2
O
4
↓
Osad ten, podobnie jak osad szczawianu baru, roztwarza się w kwasie octowym, co pozwala odróżnić
jony Sr
2+
i Ba
2+
od jonów Ca
2+
. Szczawian wapnia nie roztwarza się w kwasie octowym.
6. Sole strontu barwią płomień palnika na kolor karminowo czerwony.
3. Reakcje kationu Ca2+.
1. Kwas solny, siarkowodór, siarczek amonu nie wytrącają osadu z roztworów soli wapnia.
2. Węglan amonu wytrąca z aklalicznych roztworów soli wapnia biały osad węglanu wapnia:
CaCl
2
+ (NH
4
)
2
CO
3
= CaCO
3
↓
+ 2NH
4
Cl lub jonowo: Ca
2+
+ CO
3
2-
= CaCO
3
↓
Osad ten roztwarza się w rozcieńczonych kwasach z wydzieleniem dwutlenku węgla.
3. Kwas siarkowy(VI) lub roztwory łatwo rozpuszczalnych siarczanów(VI) np. Na2SO4, wytrącają ze
stężonych roztworów soli wapnia biały, krystaliczny osad siarczanu(VI) wapnia.
Ca2+ + SO42- = CaSO4
↓
Z rozcieńczonych roztworów soli wapnia kwas siarkowy(VI) nie wytrąca osadu.
4. Woda gipsowa nie wytrąca osadu z roztworów soli wapnia.
5. Chromian (VI) potasu nie wytrąca osadu z roztworów soli wapnia.
6. Szczawian amonu (NH
4
)
2
C
2
O
4
strąca z roztworów soli wapnia biały krystaliczny osad szczawianu
wapnia:
Ca(NO
3
)
2
+ (NH
4
)
2
C
2
O
4
= CaC
2
O
4
↓
+ 2NH
4
NO
3
lub jonowo: Ca
2+
+ C
2
O
4
2-
= CaC
2
O
4
↓
CaC
2
O
4
nie roztwarza się w kwasie octowym (pozwala to odróżnić jony wapnia od jonów baru i strontu)
7. Sole wapnia barwią płomień palnika na kolor ceglasty.
V grupa analityczna kationów.
Kationy: Mg2+, NH4+, K+, Na+ - wszystkie bezbarwne w roztworach wodnych.
Do piątej grupy analitycznej należą kationy, króre z żadnym ze stosowanych kolejno odczynników
grupowych nie dają osadów. Poza jonem Mg
2+
wszystkie są jednowartościowe. Iloczyn rozpuszczalności
węglanu magnezu jest na tyle duży, że wytrącenie osadu tej soli węglanem amonu w obecności NH
4
Cl i
NH
4
OH nie następuje. Ortofosforan (V) magnezu jest trudno rozpuszczalny w wodzie, podobnie jak
fosforany kationów IV grupy analitycznej.
Węglany i fosforany (V) sodu, potasu i amonu rozpuszczają się w wodzie dobrze. Kation amonu jest
pod względem rozpuszczalności soli podobny do kationów metali alkalicznych.

1. Reakcje kationu Mg2+.
1. Odczynniki grupowe nie dają osadów z roztworami soli magnezu.
2. Wodoroortofosforan(V) sodu Na
2
HPO
4
w obecności NH
4
OH i soli amonu wytrąca z roztworów soli
magnezu biały krystaliczny osad fosforanu(V) amonu i magnezu:
MgCl
2
+ Na
2
HPO
4
+ NH
4
OH = MgNH
4
PO
4
↓
+ 2NaCl + H
2
O
lub jonowo: Mg2+ + HPO42- + NH4OH = MgNH4PO4
↓
+ H2O
3. Wodorotlenek sodu lub potasu wytrąca z roztworów soli magnezu biały galaretowaty osad
wodorotlenku magnezu, nierozpuszczalny w nadmiarze NaOH:
Mg2+ + 2OH- = Mg(OH)2
↓
4. Wodorotlenek amonu wytrąca z roztworów soli magnezu białe zmętnienie wodorotlenku magnezu.
MgCl
2
+ 2NH
4
OH = Mg(OH)
2
+ 2NH
4
Cl
lub jonowo: Mg
2+
+ 2OH
-
= Mg(OH)
2
2. Reakcje kationu NH4+.
1. Odczynniki grupowe nie dają osadów z roztworami soli amonu.
2. Sole amonu ogrzewane z wodorotlenkiem sodu wydzielają amoniak, gaz o charakterystycznej woni:
NH
4
Cl + NaOH = NH
4
OH + NaCl
NH
4
OH
→
NH
3
+ H
2
O
Rozpuszczalność NH4OH w wodzie maleje w podwyższonej temperaturze. Jeżeli wprowadzi się do próbki
pręcik szklany zwilżony kwasem solnym, to można zauważyć obfite białe dymy powstającego salmiaku
(chlorku amonu) , co wskazuje niezawodnie na obecność soli amonu.
3. Odczynnik Nesslera (czterojodortêcian(II) potasu) str¹ca z roztworów soli amonu żółty lub żółto-
brunatny osad:
2HgI42- + 4OH- + NH4+ = OHg2NH2I + 3H2O + 7I-
Odczynnik Nesslera przygotowuje się następująco: kilka kropli soli rtęci (II) zadaje się kroplami roztworu
jodku potasu KI aż do rozpuszczenia czerwonego osadu jodku, a nastęnie dodaje kilka kropli NaOH.
3. Reakcje kationu K+.
1. Odczynniki grupowe nie dają osadów z roztworami soli potasu.
2. Kwas winowy wytrąca z roztworów soli potasu biały drobnokrystaliczny osad wodorowinianu potasu:
COOH COOK
CHOH CHOH
CHOH + KCl =
CHOH + HCl
COOH COOH
Wodorowinian potasu ma skłonność do tworzenia roztworu przesyconego. Stan przesycenia można
usunąć przez pocieranie ścianek próbówki pręcikiem szklanym.
3. Sole potasowe barwią płomień palnika na fioletowo.
4. Reakcje kationu Na+.
Sole sodu są na ogół dobrze rozpuszczalne w wodzie i nie dają z odczynnikami, używanymi zwykle w
pracowni, żadnych osadów. Jedyną możliwością rozpoznania jonów sodu jest długotrwałe żółte
zabarwienie płomienia palnika.

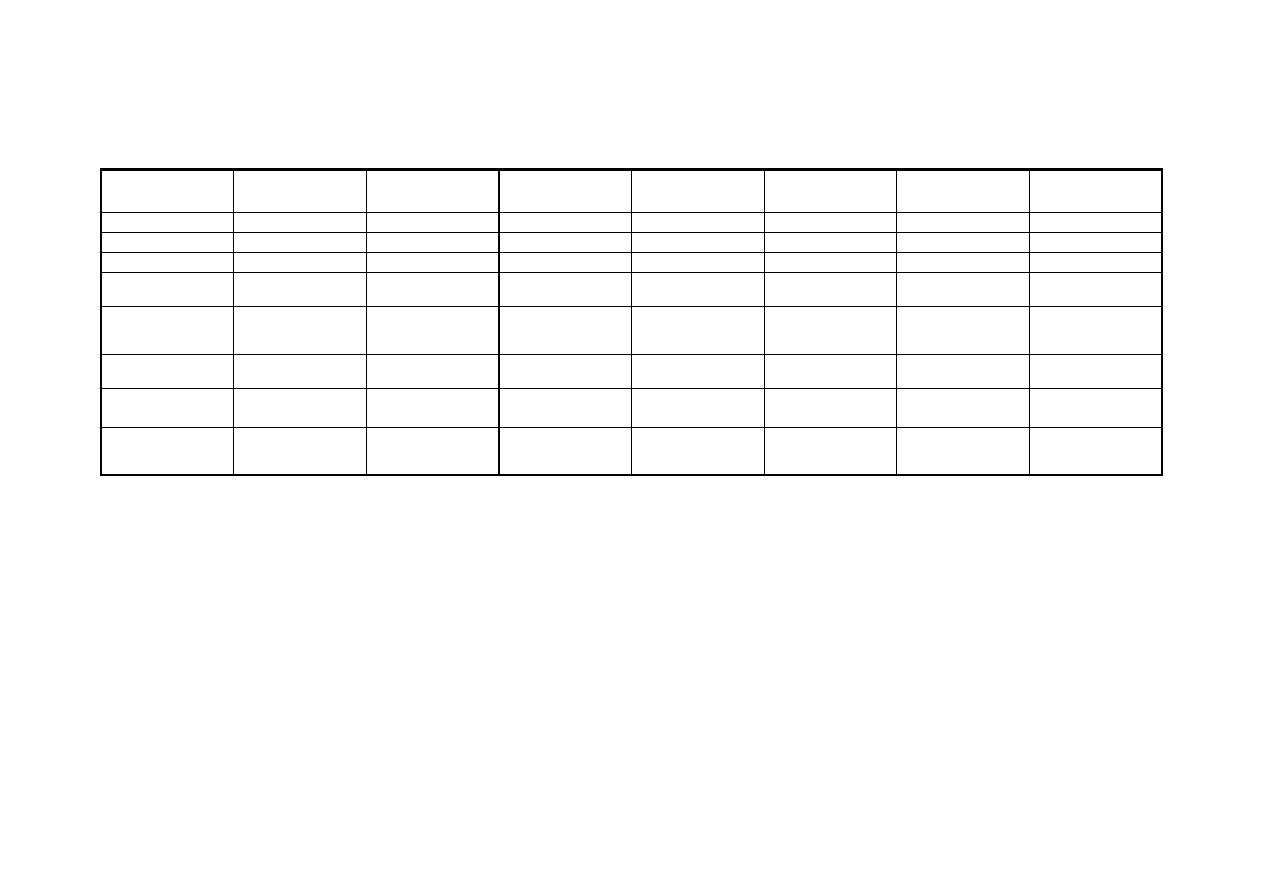
Tabela
Zestawienie reakcji kationów IV i V grupy analitycznej z podstawowymi odczynnikami
Ca
2+
Sr
2+
Ba
2+
Mg
2+
Na
+
K
+
NH
4
+
(NH
4
)
2
CO
3
↓
CaCO
3
biały
↓
SrCO
3
biały
↓
BaCO
3
biały
NaOH
↓
Ca(OH)
2
biały
↓
Sr(OH)
2
biały
↓
Ba(OH)
2
biały
↓
Mg(OH)
2
biały
NH
4
OH
↓
Mg(OH)
2
biały
Na
2
HPO
4
↓
Ca
3
(PO
4
)
2
biały
↓
Sr
3
(PO
4
)
2
biały
↓
Ba
3
(PO
4
)
2
biały
↓
Mg
3
(PO
4
)
2
⋅
H
2
O
biały
CaSO
4
(nasyc.)
↓
SrSO
4
biały,
reakcję przyspiesza
ogrzanie
↓
BaSO
4
biały
H
2
SO
4
(rozc.)
↓
SrSO
4
biały
galaretowaty
↓
BaSO
4
biały
krystaliczny
Zabarwienie
płomienia
ceglasto czerwone
karminowo
czerwone
żółto zielone
żółte różowo fioletowe
Inne charakt.
reakcje
w reakcji z K
2
CrO
4
→
żółty
↓
BaCrO
4
reakcja z kwasem
winowym
reakcja z
odczynnikiem
Nesslera
↓
strzałka pionowa obok wzoru oznacza, że związek jest nierozpuszczalny w wodzie
→
strzałka pozioma oznacza, że związek przechodzi w inną postać
Wyszukiwarka
Podobne podstrony:
OK Analiza jako poczštek i podstawa zmian w systemie
W03 analiza jako~ciowa kationcw
ANALIZA JAKOŚCIOWAREAKCJE ANIONÓW
ANALIZA JAKOŚCIOWAREAKCJE ANIONÓW
CHEMICZNA ANALIZA JAKO
Analiza moliwoci wykorzystania pyt gipsowo kartonowych jako materiau wykoczeniowego w budownictwie d
3 Analiza modelu dynamiki statku jako wielo
Analiza strategiczna jako etap zarządzania strategicznego
Analiza rysunku rodziny jako źródło
Analiza rysunku rodziny jako źródło(1), Arteterapia
analiza finansowa jako podstawa oceny sytuacji finansowej przedsiębiorstwa BMRNLYGLD7NSA246BAQTYCOJP
Motywacja jako przedmiot sądowej analizy psychologiczej
Analiza śladów genetycznych jako dowód w procesie karnym – cz II
Analiza rysunku rodziny jako źródło
Analiza Algorytmów Genetycznych jako Ukladow Dynamicznych 08 Kotowski PhD p72
7. ANALIZA WYCHOWANIA JAKO ZJAWISKA SPOŁECZNEGO, Przygotowanie Pedagogiczne, Teoria Wychowania
więcej podobnych podstron