
Charakterystyka DNA: oznaczanie stężenia, ciężaru cząsteczkowego i form
konformacyjnych DNA przez elektroforezę w żelu agarozowym.
Elektroforeza w żelach agarozowych i poliakrylamidowych jest techniką używaną do
rozdziału, oznaczania i oczyszczania kwasów nukleinowych i białek.
Rozdział polega na migracji rozdzielanych substancji pod wpływem przyłożonego prądu
elektrycznego. W obojętnym pH DNA ma ładunek ujemny i wędruje do anody.
Stosowane techniki różnią się od siebie zdolnością rozdzielczą i zakresem rozdziału.
Żele poliakrylamidowe są najbardziej efektywne, rozdzielają cząsteczki DNA o
wielkości od 5 do 500 pz, a w pewnych warunkach można rozdzielić fragmenty DNA
różniące się jednym nukleotydem. Można również rozdzielić dwa łańcuchy DNA o takiej
samej długości jeśli różnią się one sekwencją nukleotydów.
W żelach agarozowych można rozdzielić fragmenty od 200pz do 50000pz, ale ich
zdolność rozdzielcza jest niższa.
W elektroforezie w żelach agarozowych szybkość migracji liniowych cząstek DNA
jest odwrotnie proporcjonalna do log
10
z ilości par zasad. Duże cząsteczki migrują wolniej,
gdyż większa jest siła tarcia podczas migracji. Liniowe cząsteczki DNA zostają zorientowane
przez pole elektryczne i migrują równolegle do lini pola.
Na szybkość migracji fragmentów w żelu wpływa:
wielkość fragmentów DNA - mniejsze fragmenty wędrują szybciej
stężenie żelu:
-wzrost stężenia żelu obniża szybkość migracji
-wzrost stężenia żelu wpływa również na zakres rozdziału cząsteczek DNA
Stężenie żelu
Wielkość fragmentów efektywnie rozdzielanych
0,3%
5-60kpz
0,6%
1-20kpz
0,9%
0,5-7kpz
1,2%
0,4-6kpz
1,5%
0,2-3kpz
2%
0,1-2kpz
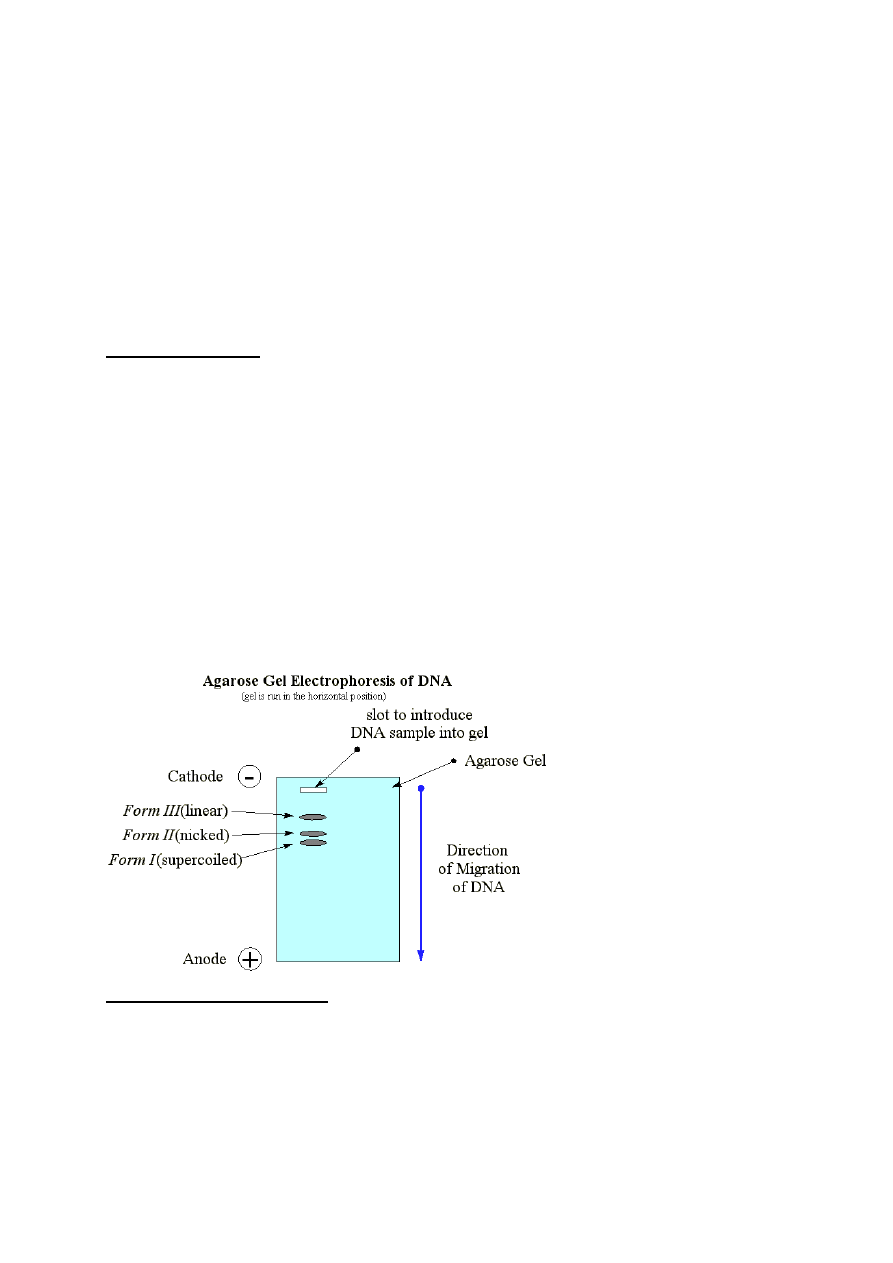
konformacja DNA
3 formy konformacyjne plazmidowego DNA, superspiralna kolista (CCC), otwarta
kolista (OC) i liniowa (L) wędrują przez żel z różną szybkością. Zwykle najszybciej wędruje
forma CCC, następnie forma L, a najwolniej forma OC. Czasami jednak w zależności od
stężenia żelu, wartości przyłożonego prądu i siły jonowej buforu forma liniowa wyprzedza
formę CCC. By określić który prążek jest cząsteczką DNA o formie CCC można
przeprowadzić doświadczenie polegające na elektroforezie próbki w żelach zawierających
różne stężenia bromku etydyny (EtBr). Bromek etydyny rozwija superspiralne skręty DNA i
powoduje, że forma CCC migruje wolniej.
napięcie prądu
Przy niskich napięciach szybkość migracji jest proporcjonalna do przyłożonego
napięcia. Jeśli napięcie wzrasta to szybkość migracji cząstek DNA wzrasta w zależności od
wielkości. Najlepsze rozdziały elektoforetyczne są otrzymywane przy zastosowaniu prądu ok.
5V/cm odległości pomiędzy elektrodami.
Żele agarozowe używane są zwykle do horyzontalnej elektroforezy zanurzeniowej
określanej jako "submarine electrophoresis", gdyż żel jest całkowicie zatopiony w buforze w
którym wykonywana jest elektroforeza.
Używane są trzy rodzaje buforów:
boranowy (Tris Borate Electrophoretic buffer - TBE)
octanowy (Tris Acetate Electrophoretic buffer - TAE)
fosforanowy (Tris Phosphate Electrophoretic buffer - TPE)
Bufory różnią się siłą jonową i pojemnością buforową. Najczęściej używany jest bufor
boranowy-TBE. Przygotowany 10x stężony roztwór wyjściowy jest rozcieńczany do roztworu
roboczego (1x) przed przygotowaniem żelu.
Przygotowanie żelu.
Żele agarozowe są przygotowywane na płytkach szklanych lub w tzw. rynienkach.
Przed wylaniem żelu na rynienkę należy zakleić plastrem jej boczne krawędzie lub umieścić
rynienkę w aparacie do wylewania żeli. Objętość przygotowanego żelu zależy od pojemności
płytki.
W celu przygotowania żelu należy do odważonej agarozy dodać odpowiednią
objętość buforu do elektroforezy np. TBE. Taką zawiesinę należy gotować do całkowitego
rozpuszczenia agarozy, a następnie ochłodzić do temperatury ok. 45
C. Żel wylać na
uprzednio przygotowaną płytkę szklaną lub rynienkę i ustawić grzebień. Grzebień powinien
być ustawiony równolegle do krawędzi żelu, a jego zęby powinny się znajdować w
odległości ok. 0,5-1 mm od dolnej powierzchni. Żel krzepnie ok. 20 min. w zależności od
temperatury otoczenia. Żele zawierające mniej niż 0,7% agarozy są przygotowywane w
chłodni w temperaturze 4
C. Po zastygnięciu żelu należy ostrożnie wyjąć grzebień
przytrzymując delikatnie powierzchnię żelu. Przygotowany żel należy umieścić w aparacie do
elektroforezy i zalać buforem 1 x TBE.
Przygotowanie próbek DNA.
Do sprawdzenia ilości wyizolowanego DNA używany jest zwykle 1
l roztworu DNA.
Dla zwiększenia objętości i ograniczenia strat przy nakładaniu do próbki dodajemy 4
l buforu
TC lub wody. Do tak przygotowanej próbki dodajemy 1
l 6x stężonego buforu
obciążającego. Bufor obciążający służy do zagęszczenia próbki DNA tak by umożliwić jej
nałożenie do studzienki w żelu. Bufor obciążający zawiera jeden lub dwa barwniki do
elektroforezy tj. ksylen cyjanol (0,25%) i błękit bromofenolowy (0,25%) oraz 40% sacharozę
lub 30% glicerol. Barwniki elektroforetyczne mirują w żelu razem z cząsteczkami DNA.

Błękit bromofenolowy migruje ok. 2,2 razy szybciej niż ksylen cyjanol. Szybkość migracji
błękitu bromofenolowego odpowiada szybkości migracji liniowej cząsteczki dsDNA
(dwuniciowe DNA) o wielkości 300pz, podczas gdy ksylen cyjanol migruje z szybkością
równą fragmentom dsDNA o wielkości 4000pz.
Po nałożeniu próbek na żel i podłączeniu do zasilacza ustawiamy napięcie na ok. 120-
140V. Elektroforezę prowadzimy do momentu, gdy błękit bromofenolowy osiągnie 3/4
długości żelu. Po odłączeniu napięcia żel przenosimy do naczynia zawierającego roztwór
bromku etydyny. Bromek etydyny jest silnym mutagenem, dlatego czynności te należy
wykonywać w rękawiczkach.
Bromek etydyny
Bromek etydyny jako barwnik akrydynowy wnika pomiędzy nici DNA specyficznie
wybarwiając żel. Po oświetleniu żelu lampą UV 260 nm DNA świeci na czerwono. Również
niezwiązany z DNA bromek świeci na czerwono. Dla odpłukania niespecyficznie związanego
z żelem bromku, żel zostawiamy na kilka godzin w wodzie destylowanej. Czasami bromek
etydyny jest dodawany bezpośrednio do żelu. W czasie elektroforezy bromek wędruje w
przeciwnym kierunku niż DNA i jest usuwany z żelu wybarwiając specyficznie DNA.
Elektroforeza w zmiennym polu elektrycznym
W elektroforezie w żelu agarozowym można rozdzielić efektywnie fragmenty DNA o
wielkości do kilkudziesięciu tysięcy par zasad. Rozdziały takie można uzyskać w
niskoprocentowych żelach (0,2%-0,35%), ale takie żele są bardzo nietrwałe i wymagają
specjalnej obróbki. Rozdział dużych fragmentów rzędu kilkuset kpz uzyskuje się przez
elektroforezę w zmiennym polu elektrycznym. Duże cząsteczki DNA są uwięzione w żelu i
przy zmianie biegunów pola elektrycznego duże fragmenty wymagają dłuższego czasu na
zmianę orientacji podczas, gdy krótsze fragmenty szybciej zmieniają orientację i szybciej
migrują. W oryginalnie opisanej metodzie uzyskano rozdziały fragmentów o wielkości 2Mpz
(mega par zasad), a dalsze usprawnienia metody umożliwiają rozdział 5Mpz DNA.
Wyszukiwarka
Podobne podstrony:
Finanse publiczne cw 4 E S id 1 Nieznany
Poetyka material na egzamin id Nieznany
Materialy dla uczestnikow K id Nieznany
Bachanek Nieweglowska cw 1 id 7 Nieznany (2)
Materialy dydaktyczne FIZYKA id Nieznany
materialy wykladowe wyk13 d id Nieznany
Finanse publiczne cw 2 E S id 1 Nieznany
materialy wykladowe wyk9 d id 7 Nieznany
materialy do wykladow 1 i 2 id Nieznany
Czujniki dodatkowe Czujniki id Nieznany
Jezyk Obcy 3 Materialy na cw 28 Nieznany
1 Tablice (materialy ITA 104)id Nieznany (2)
Materialy dla prowadzacego id 2 Nieznany
materialy wykladowe wyk11 d id Nieznany
Materialy szkoleniowe OTWP id 2 Nieznany
materialy FUTURA EDUKACJA 2 id Nieznany
Materialy dodatkowe do spawania Nieznany
materiały dodatkowe cw 3 i 4a
materialy do wykladu 1 i 2 id 2 Nieznany
więcej podobnych podstron