
WF – ćw.7
1
Ćwiczenie 7
Badanie aktywności enzymów z klasy oksydoreduktaz.
Oznaczenie witaminy C
A. Badanie aktywności enzymów z klasy oksydoreduktaz.
Odczynniki :
- 3% roztwór H
2
O
2
,
- roztwór KCN,
- roztwór benzydyny w kwasie octowym,
- roztwór fenolu
- roztwór pirogallolu
- odczynnik NADI (przygotować
bezpośrednio przed Użyciem, mieszając p-fenyleno-diaminę
z
α-naftolem w stosunku 1 : 1 (1 ml + 1 ml),
- bufor fosforanowy o pH 7,4,
- roztwór pirokatechiny
UWAGA!!! KCN jest silna trucizną !!!
!!!Wylewać tylko do specjalnie oznaczonego pojemnika !!!
S
PORZĄDZANIE WYCIĄGU ZIEMNIACZANEGO
Umyty i obrany ziemniak utrzeć na tarce. Miazgę włożyć do złożonej potrójnie gazy i zanurzyć w zlewce
zawierającej 200 cm
3
wody destylowanej. Zawartość zlewki łagodnie mieszać przez kilka minut. Otrzymuje się
wodny wyciąg z ziemniaka, zawierający enzymy oraz wypłukana skrobię. Po pewnym czasie, gdy skrobia opadnie
na dno zlewki, płyn należy zdekantować znad osadu i przesączyć. Część nadsączu (około 50 cm
3
) wlać do zlewki i
zagotować.
1. W
YKRYWANIE AKTYWNOŚCI KATALAZY
Katalazy, obecne we wszystkich organizmach tlenowych, są metaloproteinami zawierającymi w swojej
cząsteczce żelazo. Katalizują rozkład H
2
O
2
. do wody i tlenu cząsteczkowego. Jest to szczególny przypadek reakcji
hydroperoksydazowej, w której H
2
O
2
jest jednocześnie donorem i akceptorem wodoru.
2H
2
O
2
→ 2H
2
O + O
2
Zasada wykrywania katalazy
Tlen uwolniony w reakcji dysproporcjowania H
2
O
2
katalizowanej przez katalazę wydzielając się z
roztworu powoduje jego silne pienienie.
WF – ćw.7
2
Wykonanie
Do trzech probówek napipetować po około 2 ml :
a - ekstraktu z ziemniaka ,
b - zagotowanego ekstraktu z ziemniaka
c - ekstraktu z ziemniaka z dwoma kroplami roztworu KCN.
Do każdej z prób dodać 5 kropli 3% nadtlenku wodoru. Gwałtownie wydzielające się pęcherzyki
tlenu są świadectwem prawidłowo przebiegającej reakcji.
2. W
YKRYWANIE AKTYWNOŚCI PEROKSYDAZ
Peroksydazy katalizują reakcję utleniania niektórych związków organicznych np. fenoli z równoczesną redukcją
nadtlenku wodoru
H
2
O
2
+ fenole → 2H
2
O + chinony
Enzymy tej grupy są odporne na temperaturę. Nie denaturują w temperaturze 70°C, inaktywują się
dopiero po ogrzaniu we wrzącej łaźni wodnej. Bogatym ich źródłem jest sok chrzanowy, a w tkankach
zwierzęcych wątroba i leukocyty.
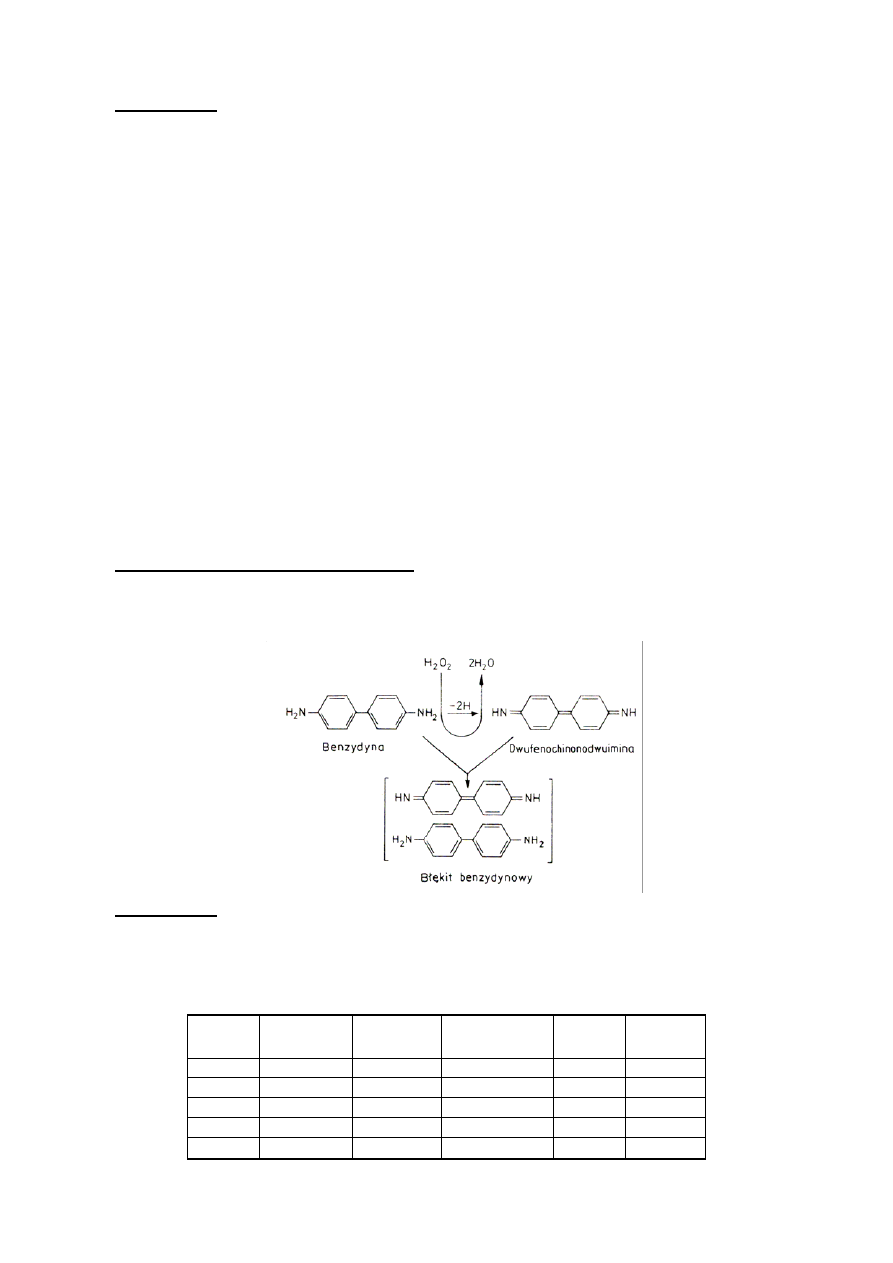
Zasada wykrywania peroksydazy
Benzydyna w obecności H
2
O
2
ulega utlenieniu przez peroksydazę do błękitu benzydynowego, zgodnie z
poniższym równaniem reakcji
Wykonanie
Do 5 probówek odmierzyć podaną w tabeli objętość ekstraktu z ziemniaka, benzydyny, H
2
O
2
, KCN i H
2
O. Do
probówki nr 4 dodać zagotowany ekstrakt. Zawartość probówek wymieszać i postawić na 20 min. w temperaturze
pokojowej. Obserwować zachodzące zmiany i zanotować wyniki.
Próba
nr
Wyciąg
(ml)
Woda
(ml)
Benzydyna
(ml)
KCN
H
2
O
2
(ml)
1 2,5 0
0,1 0 0,1
2 2,5 0,1
0 0 0,1
3 2,5 0
0,1
2
krople
0,1
4 2,5 0
0,1 0 0,1
5 2,5 0,1 0,1 0 0

WF – ćw.7
3
3. W
YKRYWANIE AKTYWNOŚCI OKSYDAZY CYTOCHROMOWEJ
Oksydaza cytochromowa jest enzymem występującym w wewnętrznej błonie mitochondrialnej, stanowi końcowy
element łańcucha oddechowego w komórce. Jej podstawowym zadaniem jest przeniesienie elektronów na tlen w
celu jego aktywacji. Enzym ten jest hemoproteiną zawierającą również atomy miedzi.
Zasada wykrywania aktywności oksydazy cytochromowej
Obecność oksydazy cytochromowej w ekstrakcie tkankowym można wykazać w reakcji, w której wykorzystywany
jest odczynnik NADI. W skład odczynnika wchodzą:
α-naftol i p-fenylenodiamina zmieszane w stosunku 1:1. W
wyniku nieenzymatycznej redukcji zawartego w mitochondriach cytochromu c przez
p-fenylenodiaminę powstaje p-fenylenodiimina, która w obecności
α -naftolu przechodzi w barwny, niebieski
kompleks.
Wykonanie
Do 4 probówek odmierzyć podane w tabeli objętości poszczególnych roztworów; do probówki nr 4 dodać
zagotowany nadsącz. Próby starannie wymieszać i pozostawić na 30 min w temperaturze pokojowej. Obserwować
powstanie niebieskiej barwy. Wyniki zapisać w tabeli.
Próba
nr
Wyciąg
(ml)
Woda
(ml)
Bufor pH 7,4
(ml)
KCN
NADI
(ml)
1 1 0
1 0 0,1
2 1 0
1
1
kropla
0,1
3 1 0,1 1 0 0
4 1 0
1 0 0,1
4. W
YKRYWANIE AKTYWNOŚCI OKSYDAZY POLIFENOLOWEJ
Oksydazy katalizują odrywanie się elektronów od utlenianego substratu i dwu- lub czteroelektronową redukcję
cząsteczki tlenu. Produktami reakcji katalizowanych przez te enzymy jest woda lub nadtlenek wodoru. Substratem
w reakcjach utleniania mogą być m.in. o- i p-difenole. Powstają chinony, a w wyniku ich kondensacji tworzą się
barwne pochodne. Oksydaza fenolowa, zwana również oksydazą polifenolową, tyrozynazą lub katecholazą, jest
metaloproteiną i zawiera miedź, która przyjmuje elektrony od difenoli i przekazuje na tlen cząsteczkowy.
Zasada wykrywania oksydazy polifenolowej
Oksydaza polifenolowa utlenia pirokatechinę do chinonów, które kondensując dają ciemnobrunatne zabarwienie.
WF – ćw.7
4
Wykonanie
Do 5 probówek odmierzyć podane w tabeli objętości ekstraktu z ziemniaka, wody, buforu, pirokatechiny
i 4% roztworu KCN. Do probówki nr 4 dodać ekstrakt zawierający termicznie denaturowane białka. Zawartość
wszystkich probówek starannie wymieszać, zanotować czas i pozostawić w temperaturze pokojowej. W celu
lepszego dostępu tlenu, próby od 1-4 co pewien czas wstrząsnąć. Po 20 min zanotować wyniki reakcji.
Próba
nr
Wyciąg
(ml)
Woda
(ml)
Bufor pH 7,4
(ml)
KCN
Pirokatechina
(ml)
1 1 0
1 0 0,1
2 1 0,1 1 0 0
3 1 0
1
2
krople
0,1
4 1 0
1 0 0,1
5 1 0
1 0 0,1
Do 2 probówek wlać po 5 cm
3
wyciągu ziemniaczanego. Następnie do probówek wprowadzić kolejno:
do pierwszej – 10 kropli 1% roztworu fenolu,
do drugiej – 10 kropli 1% roztworu pirogallolu.
Zawartość probówek zmieszać i obserwować zmianę zabarwienia.
UWAGA: Podobny efekt obserwuje się bez powyższych odczynników, np. na obranym ziemniaku, który po
pewnym czasie sinieje, ponieważ obecne w nim związki typu o-difenoli ulegają utlenieniu.
5. Wrażliwość peroksydaz i oksydaz na temperaturę
Do trzech probówek odmierzyć po 5 cm
3
wyciągu ziemniaczanego. Wszystkie probówki ogrzewać na łaźni wodnej
o temperaturze 70°C przez 10 min. Następnie dodać:
do pierwszej probówki 10 kropli 1% roztworu pirokatechiny,
do drugiej probówki 10 kropli 1% roztworu pirokatechiny i 3% roztworu nadtlenku wodoru.
Zanotować wyniki reakcji.
B. Oznaczanie witaminy C
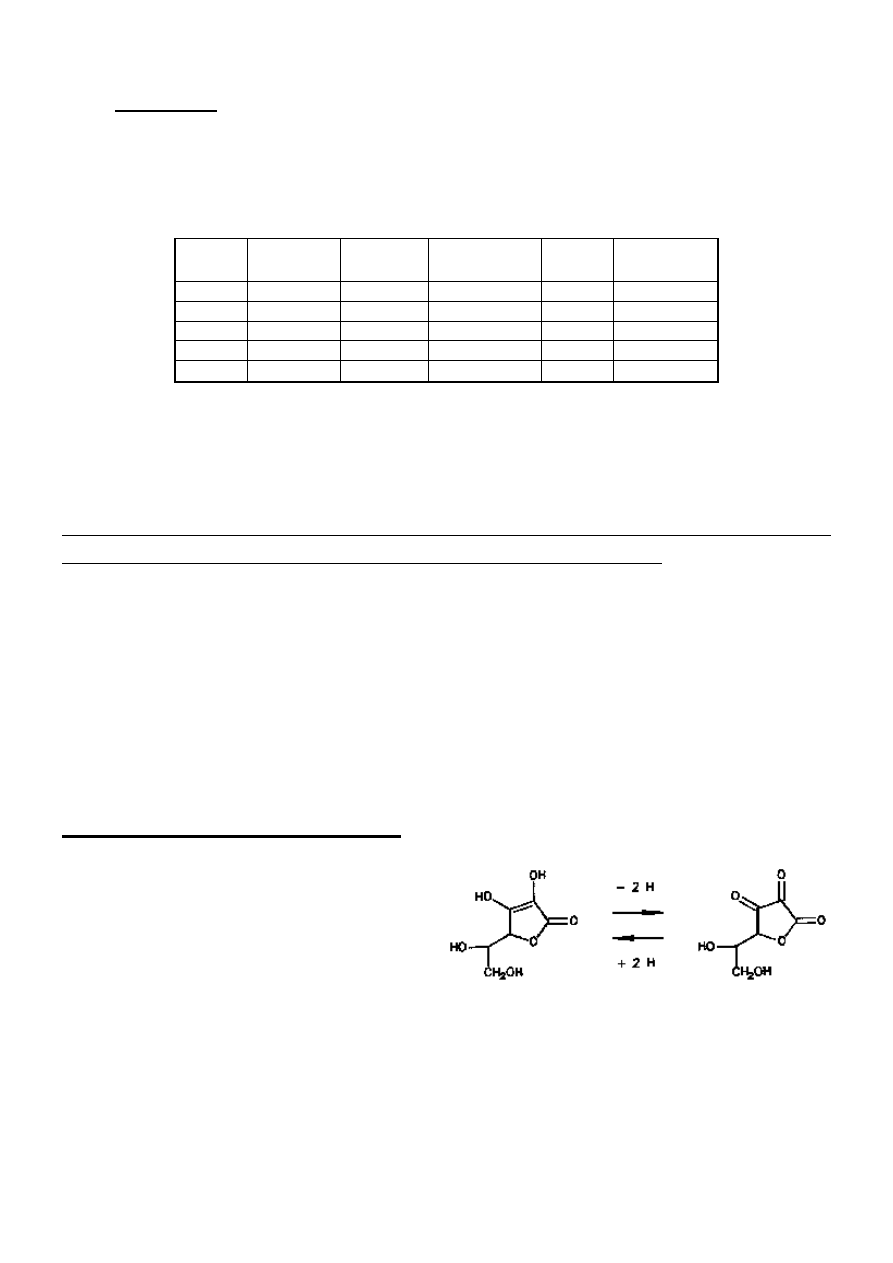
Kwas L-askorbinowy (witamina C) jest
związkiem krystalicznym, dobrze rozpuszczalnym
w wodzie a jego roztwory mają kwaśny smak.
Wykazuje właściwości redukujące. Jego forma
utleniona to kwas dehydroaskorbinowy.
Układ oksydoredukcyjny kwas askorbinowy ↔ kwas dehydroaskorbinowy może uczestniczyć
w regulowaniu potencjału oksydoredukcyjnego w komórce i brać udział w transporcie elektronów.
Ponieważ witamina C występuje w znacznych ilościach w gruczołach nadnercza, przypuszcza się, że
uczestniczy ona w syntezie hormonów sterydowych. Witamina C uczestniczy w produkcji kolagenu
i podstawowych białek w całym organizmie (kości, chrząstki, ścięgna, więzadła). Jako jeden

WF – ćw.7
5
z najważniejszych przeciwutleniaczy pełni także istotną funkcję w reakcjach odtruwania i odporności
organizmu chroniąc go przed procesami utleniania, uczestniczy w metabolizmie tłuszczów, cholesterolu
i kwasów żółciowych.
Wśród metod oznaczania witaminy C można wyróżnić
metody fizykochemiczne: chromatografia
cieczowa, metoda spektrofotometryczna i metoda potencjometryczna oraz metody chemiczne.
Odczynniki:
- r-r 2,6-dichlorofenolindofenolu (
2,6-DPIP)
- 1%
FeCl
3
- 1%
K
3
Fe(CN)
6
- 1% witamina C
- 1% i 2% kwas szczawiowy
- 10% kwas trichlorooctowy (TCA)
- 2%
H
2
SO
4
- 10%
NaOH
- odczynnik
Folina
- 10%
HCl
1. Reakcja z żelazicyjankiem potasu
Przygotować dwie próbówki. Do pierwszej dodać 5 kropli 1% r-ru witaminy C, a do drugiej 5 kropli
wody. Następnie do obydwu próbówek dodać 1 kroplę 10% NaOH i 1 kroplę 1% żelazicyjanku potasu.
Zawartość probówki wymieszać, a następnie dodać 3 krople 10% HCl i 1 kroplę 1% FeCl
3
. Obserwacje
zanotować w zeszycie.
2. Oznaczanie witaminy C metodą Folina
Zasada oznaczenia
W obecności kwasu askorbinowego kwas fosfomolibdenowy (VII) ulega redukcji do mieszaniny
niższych tlenków molibdenu – błękitu molibdenowego. Odczynnik ten jest również specyficznie
redukowany przez kwas askorbinowy w pH 1-7. W tym zakresie pH i poza witaminą C inne reduktory
obecne w płynach ustrojowych i tkankach nie redukują go.
Wykonanie
1. Otrzymanie homogenatu
Każdy 1 g tkanki zalać 1 cm
3
10% TCA, a następnie homogenizować przez 5 minut. Osad
odwirować przy 3000 obr./min
2. Przygotowanie krzywej wzorcowej
WF – ćw.7
6
Przygotować krzywą standardową poprzez wykonanie szeregu rozcieńczeń roztworu wzorcowego
kwasu askorbinowego o stężeniu 0,1mg / cm
3
według tabeli :
Stężenie kwasu
askorbinowego
0
μ
g/ml 2,5
μ
g/ml 5
μ
g/ml 12,5
μ
g/ml 25
μ
g/ml 35
μ
g/ml
R-r wzorcowy [ml]
0 0,05 0,1 0,25 0,5 0,7
10% TCA [ml]
2,0 1,95 1,9 1,75 1,5 1,3
Do przygotowanych prób dodać po 0,2 ml odczynnika Folina i natychmiast po dodaniu energicznie
zamieszać.
3. Oznaczenie witaminy C w materiale biologicznym
Do oznaczeń pobrać 0,2-0,5 ml supernatantu. Objętość prób uzupełnić do 2 ml 10% TCA,
a następnie dodać 0,2 ml odczynnika Folina i energicznie zamieszać
Absorbancję mierzyć przy długości fali 750 nm względem próby zerowej. Obliczyć ilość witaminy C
w badanym materiale biologicznym. Obliczyć ilość materiału biologicznego, który zaspokajałby
dzienne zapotrzebowanie dorosłego człowieka na tę witaminę.
Badany materiał biologiczny
Ilość zaspokajająca dzienne zapotrzebowanie na wit. C
dorosłego człowieka [g]
3. Oznaczanie witaminy C metodą Tillmansa
Zasada oznaczenia
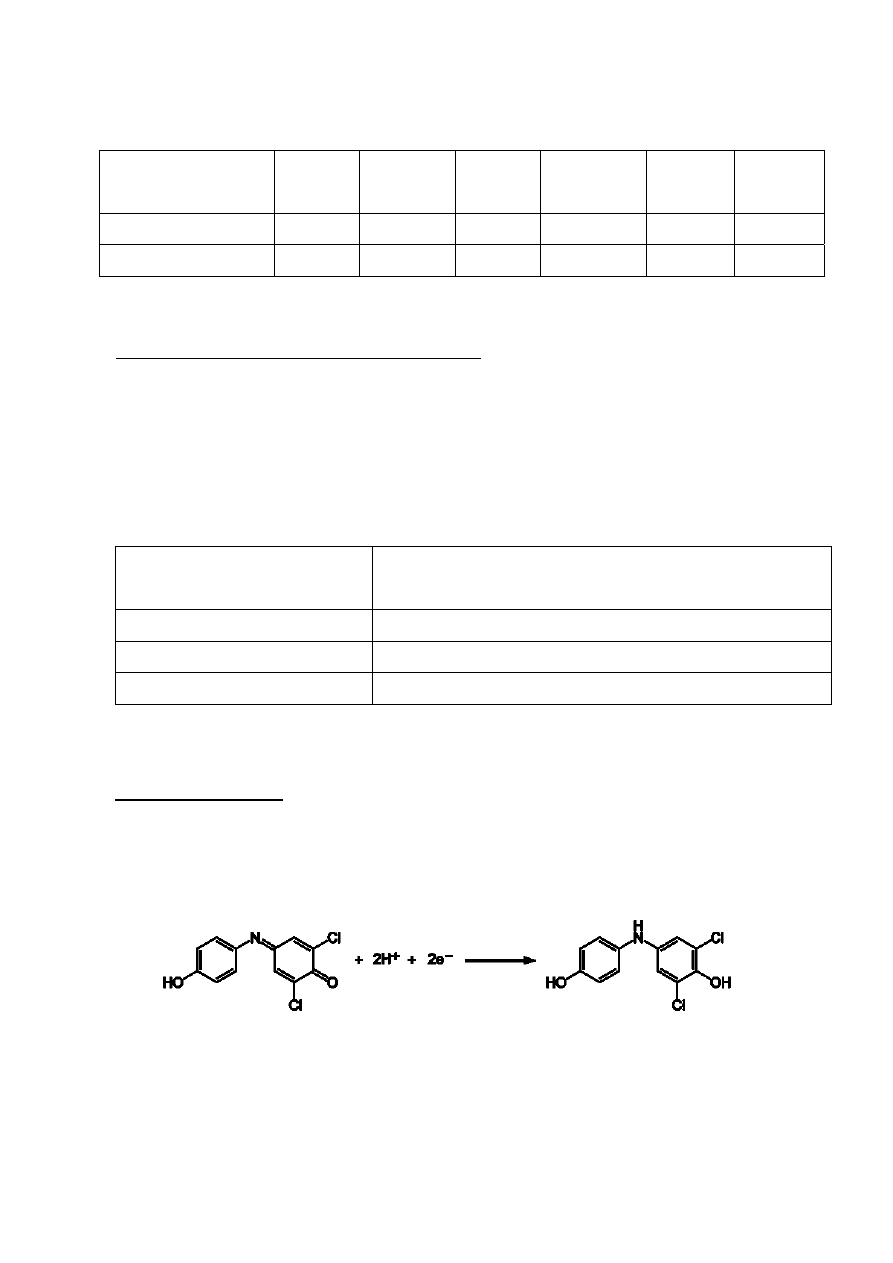
Metoda Tillmansa oparta jest na redukcji barwnika 2,6-dichlorofenoloindofenolu przez kwas
askorbinowy. Utleniony DCIP jest niebieski, zredukowany bezbarwny. Reakcja przebiega według
równania:
Oznaczanie kwasu askorbinowego polega na miareczkowaniu próby badanej w kwaśnym
środowisku (zapobiega to samoutlenieniu kwasu askorbinowego tlenem z powietrza oraz chroni przed
działaniem oksydaz). Barwnik jest zarazem indykatorem, po wyczerpaniu kwasu askorbinowego zabarwia
on próbę miareczkowaną na kolor różowy. Wiadomo, że większość
surowców roślinnych zawiera
barwniki antocyjanowe, które nadają
ekstraktom witaminy C różowe zabarwienie, a także mają

WF – ćw.7
7
właściwości redukujące. Ponadto w produktach, w których oznaczany witaminę
C, występują inne
związki ulegające utlenieniu podczas miareczkowania odczynnikiem Tillmansa. Należą
do nich reduktony
– związki obdarzone silnymi właściwościami redukującymi, które należy przypisywać
obecności
ugrupowania endiolowego. W przypadku oznaczania witaminy C w owocach i warzywach oraz ich
przetworach mamy do czynienia z reduktonami białkowymi (aminokwasy lub białka zawierające grupy
sulfhydrylowe, które są
utleniane przez odczynnik Tillmansa do wiązań disulfidowych) oraz cukrowymi
(pochodne cukrów, które powstają
podczas obróbki termicznej).
Wykonanie
1. Wyznaczanie miana roztworu 2,6-dichlorofenolindofenolu (2,6-DPIP)
Pobrać 25 ml wzorcowego roztworu kwasu askorbinowego (4 mg kwasu w 100 ml 2% kwasu
siarkowego) i zmiareczkować roztworem 2,6-dichlorofenolindofenolu do jasnoróżowego
zabarwienia utrzymującego się przez 30 sek.
2. Oznaczanie zawartości witaminy C w badanych próbkach
2-3 g jabłka, zhomogenizować z 20 ml 1% kwasu szczawiowego. Po homogenizacji roztwór
uzupełnić do objętości 100 ml 1% kwasem szczawiowymi przesączyć. 25 ml klarownego
przesączu miareczkować w kolbie stożkowej mianowanym roztworem 2,6-
dichlorofenoloindofenolu do uzyskania różowego zabarwienia utrzymującego się przez 30 sekund.
Z równania reakcji kwasu askorbinowego z 2,6-DPIP wynika, że 1 ml roztworu barwnika odpowiada
0,5 μmola kwasu tj, 0,088 mg. Korzystając z tej zależności oraz znając dokładne stężenie roztworu
barwnika należy wyliczyć ilość witaminy C w badanej próbce. Wynik podać w miligramach
przypadających na 100 g materiału roślinnego. Otrzymane dane porównać z wartościami literaturowymi.
Document Outline
- A. Badanie aktywności enzymów z klasy oksydoreduktaz.
- Sporządzanie wyciągu ziemniaczanego
- 1. Wykrywanie aktywności katalazy
- Katalazy, obecne we wszystkich organizmach tlenowych, są metaloproteinami zawierającymi w swojej cząsteczce żelazo. Katalizują rozkład H2O2. do wody i tlenu cząsteczkowego. Jest to szczególny przypadek reakcji hydroperoksydazowej, w której H2O2 jest jednocześnie donorem i akceptorem wodoru.
- Zasada wykrywania katalazy
- Wykonanie
- Do trzech probówek napipetować po około 2 ml :
- a - ekstraktu z ziemniaka ,
- b - zagotowanego ekstraktu z ziemniaka
- c - ekstraktu z ziemniaka z dwoma kroplami roztworu KCN.
- 2. Wykrywanie aktywności peroksydaz
- 3. Wykrywanie aktywności oksydazy cytochromowej
- 4. Wykrywanie aktywności oksydazy polifenolowej
- 5. Wrażliwość peroksydaz i oksydaz na temperaturę
- 1. Reakcja z żelazicyjankiem potasu
- 2. Oznaczanie witaminy C metodą Folina
- 3. Oznaczanie witaminy C metodą Tillmansa
Wyszukiwarka
Podobne podstrony:
aktywnosc enzymoteczna id 54407 Nieznany
AKTYWNOŚĆ ENZYMÓW PRZECIWUTLENIAJĄCYCH!
Naklejka na teczke 2 1 II 3 id Nieznany
9) Oznaczanie aktywności enzymów amylolitycznych
patela,swiatlowody II, pytania Nieznany
Oznaczanie aktywności enzymów lipolitycznych
(), biochemia L, Wpływ temperatury na aktywność enzymów (ćw E)
MWB plan studiow stopien II id Nieznany
Inhibicja enzymow id 214405 Nieznany
GRUPY GALAKTYK W PANNIE II id 1 Nieznany
Automatyzacja zadania cz II id Nieznany
47 A 1945 1948 r po II wojni Nieznany
OTWP Gimanzjum 2012 Gruba II id Nieznany
filtry aktywne wemif id 171041 Nieznany
Lab06 Aktywnosc enzymow I, Lekarski WLK SUM, lekarski, biochemia, enzymy
biochemia III, Czynniki warunkujące aktywność enzymów
Aktywność enzymów przy niedoborze żelaza
więcej podobnych podstron