
Inhibicja enzymów
Konrad Botor
Krzysztof Polański

Inhibicja
Inhibitor
– związek spowalniający bądź
zahamowujący reakcję chemiczną.
Inhibitor enzymu
– cząsteczka wiążąca się z
enzymem i obniżająca jego aktywność.

Inhibicja
Rodzaje inhibicji enzymów:
Kompetycyjna
Niekompetycyjna (allosteryczna)
Inny podział (ze względu na trwałość
powstałego kompleksu):
Odwracalna
Nieodwracalna (inaktywacja)

Inhibicja odwracalna
kompetycyjna
Zjawisko to polega na związaniu się
inhibitora z miejscem aktywnym enzymu.
Charakteryzuje je szybka dysocjacja
kompleksu enzym
– inhibitor (w obecności
cząstek o większym powinowactwie do
inhibitora niż enzym).
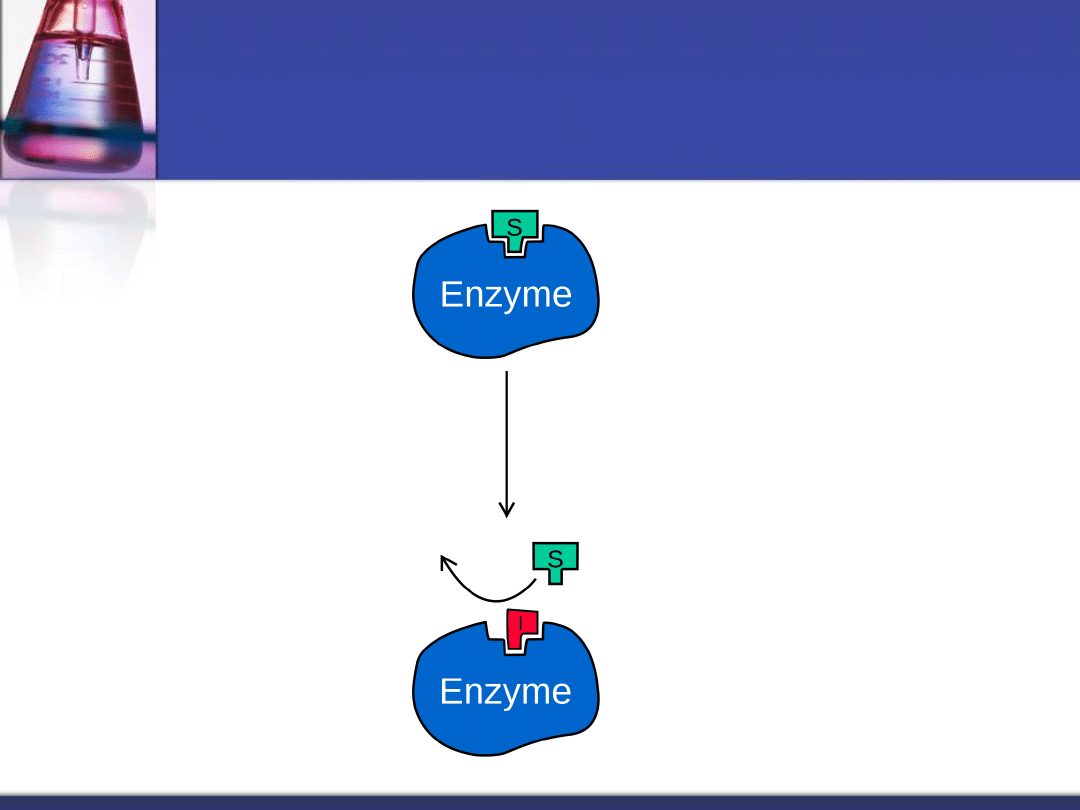
Inhibicja odwracalna
kompetycyjna
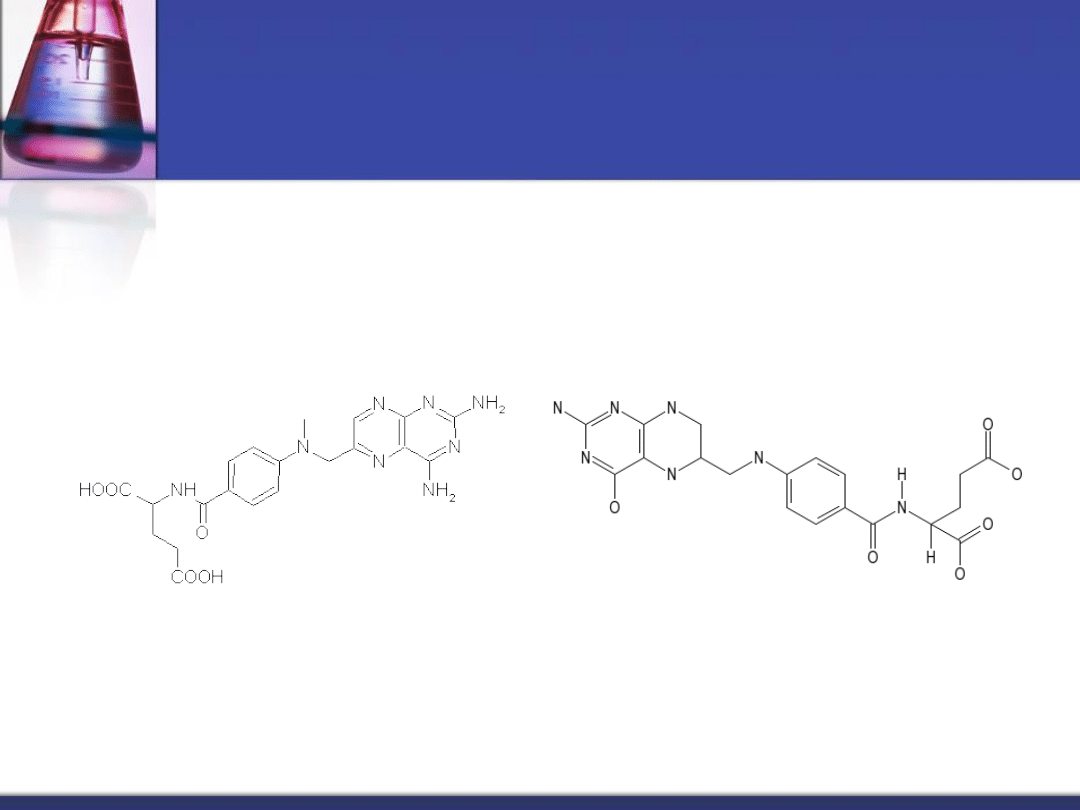
Inhibicja odwracalna
kompetycyjna
Metotreksat
Tetrahydrofolian

Inhibicja odwracalna
niekompetycyjna
Proces, w którym inhibitor nie wiąże się z
centrum aktywnym, ale z inna częścią
enzymu. Wskutek tego zmienia się
konfiguracja przestrzenna enzymu i reakcja
z właściwym substratem staje się
utrudniona.
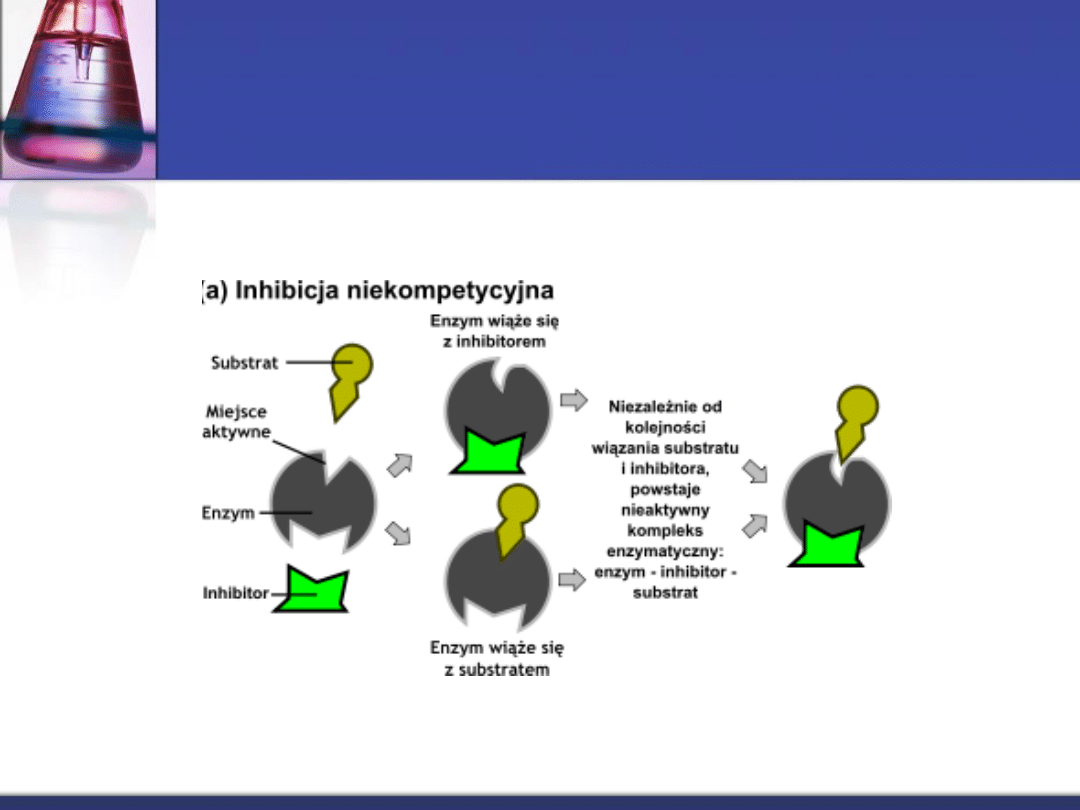
Inhibicja odwracalna
niekompetycyjna

Inhibicja odwracalna
niekompetycyjna
Zajebisty przykład

Inhibicja nieodwracalna
Zasadniczą różnicą między tym typem
inhibicji, a poprzednio omówionymi jest
trwałość wiązania inhibitora. Wytworzony
kompleks enzym
– inhibitor nie może ulec
rozpadowi.

Inhibicja nieodwracalna
Kompetycyjna
Naturalnymi substratami
chymotrypsyny są
polipeptydy zawierające
fenyloalaninę. Związek o
nazwie TPCK również ją
zawiera, ale jest w stanie
wytworzyć wiązanie
kowalencyjne z istotną
resztą histydyny.
Niekompetycyjna
DIPF modyfikuje jedną z
28 reszt serynowych
chymotrypsyny,
przyłączając się do niej,
co całkowicie
uniemożliwia działanie
enzymu.
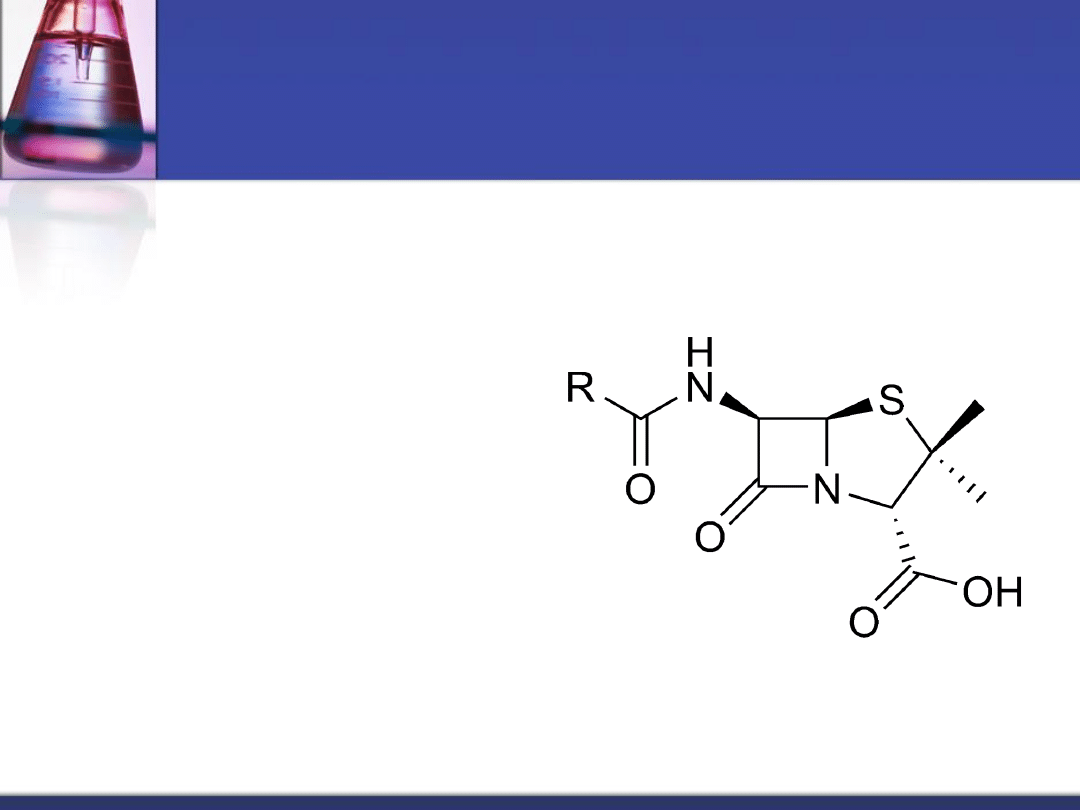
Penicyliny
Penicylina to antybiotyk
β-
laktamowy otrzymywany
przy użyciu pleśni
Penicillium
. Została
odkryta przez Sir
Alexandra Fleminga w
1928 roku. W swej
strukturze chemicznej
zawiera pierścień
tiozolidynowy
sprzężony z
pierścieniem β-
laktamowym.

Penicyliny
Penicylina jest podobna do naturalnego
substratu transpeptydazy glikopeptydowej
(R-D-Ala-D-Ala
), jednakże zawiera wysoce
nietrwały pierścień β-laktamowy, który
reaguje z resztą serynową miejsca
aktywnego. W wyniku tej reakcji powstaje
tzw. kompleks penicyloiloenzym.

Dziękujemy za uwagę
Wyszukiwarka
Podobne podstrony:
Inhibitory kinaz id 214425 Nieznany
Klasyfikacja enzymow id 235847 Nieznany
aktywnosc enzymoteczna id 54407 Nieznany
inhibitory id 214408 Nieznany
Enzymologia Skrypt I id 162159 Nieznany
enzymologia cw 2 id 162154 Nieznany
Enzymologia Skrypt II id 162160 Nieznany
Enzymologia Skrypt III id 16216 Nieznany
inhibitory id 214408 Nieznany
Abolicja podatkowa id 50334 Nieznany (2)
4 LIDER MENEDZER id 37733 Nieznany (2)
katechezy MB id 233498 Nieznany
metro sciaga id 296943 Nieznany
perf id 354744 Nieznany
interbase id 92028 Nieznany
Mbaku id 289860 Nieznany
Probiotyki antybiotyki id 66316 Nieznany
miedziowanie cz 2 id 113259 Nieznany
LTC1729 id 273494 Nieznany
więcej podobnych podstron