
Aseptyka
1.Wiadomości ogólne
W wielu dziedzinach życia i działalności człowieka (medycyna, weterynaria,
przemysł farmaceutyczny, spożywczy, kosmetyczny, elektroniczny i inne.)
niezbędne jest przeprowadzanie zabiegów mających na celu usuwanie
drobnoustrojów z różnych środowisk lub obniżanie ich liczby do bezpiecznego
poziomu. W tym celu stosuje się następujące metody:
wyjaławianie (sterylizacja) - proces niszczenia wszystkich form życia
drobnoustrojów (form wegetatywnych i przetrwalnych)
dezynfekcja (odkażanie) - proces zmierzający do maksymalnego
zmniejszenia liczby drobnoustrojów lecz nie zawsze przetrwalników; proces
zmierzający do usuwania drobnoustrojów za pomocą środków chemicznych
ze skóry, błon śluzowych i ran to antyseptyka
sanityzacja - zmniejszanie liczby drobnoustrojów za pomocą środków
myjących i czyszczących na przedmiotach i w środowisku
konserwowanie - hamowanie wzrostu i rozmnażania drobnoustrojów za
pomocą schładzania i/lub środków konserwujących oraz podwyższonego
ciśnienia osmotycznego
aseptyka - postępowanie mające na celu zapobieganie zakażeniom i
skażeniom drobnoustrojami
W profilaktyce i zwalczaniu zakażeń szpitalnych dezynfekcja i sterylizacja
zmniejszają ryzyko przeniesienia drobnoustrojów ze źródła lub chronią wrażliwy
organizm.
2.Dezynfekcja
Dezynfekcja jest procesem, w wyniku którego następuje zabicie
drobnoustrojów (z wyjątkiem spór bakterii) znajdujących się na przedmiotach,
powierzchniach lub rękach. Jest to proces złożony, którego przebieg zależy od:
właściwości czynnika dezynfekcyjnego - rodzaj czynnika (w zależności od
rodzaju środki dezynfekcyjne wykazują różną aktywność bójczą: od
podstawowego zakresu bakteriobójczego, po szeroki prątkobójczy,
grzybobójczy i wirusobójczy); zastosowane parametry
czynnika biologicznego: rodzaju drobnoustrojów, ich wrażliwości na czynniki
dezynfekcyjne i ich liczby (prawdopodobieństwo skutecznej dezynfekcji
jest tym większe, im mniejsza liczba drobnoustrojów znajduje się na
odkażanym przedmiocie)
warunków środowiska: temperatury i pH, które mogą oddziaływać
zarówno na komórki, jak i na właściwości środka dezynfekcyjnego oraz
obecności substancji organicznych lub innych zanieczyszczeń, które mogą
zmniejszać stężenie środka w roztworze albo uniemożliwiać dotarcie
czynnika dezynfekującego do komórki drobnoustroju.
Duże znaczenie ma również „czynnik ludzki", ponieważ to personel musi
wybrać odpowiednią metodę i prawidłowo przeprowadzić dezynfekcję. Zmiana
parametrów, np. obniżenie stężenia, temperatury, skrócenie czasu dezynfekcji,
niekorzystnie wpływa na końcowy efekt procesu.
Czynnikami dezynfekcyjnymi są środki chemiczne, ciepło, promieniowanie
nadfioletowe. Dezynfekcję chemiczną przeprowadza się przy użyciu związków
wykazujących działanie przeciwdrobnousfrojowe. Aktywność preparatów
chemicznych zależy od składu: rodzaju substancji aktywnych i wspomagających.
Główne substancje aktywne to: związki zawierające aktywny chlor,
czwartorzędowe sole amonowe, alkohole, aldehydy, związki nadtlenowe oraz
pochodne fenolowe. Środki, które znalazły zastosowanie w środowisku
nieożywionym noszą nazwę dezynfekcyjnych. Te, które stosuje się na żywe
powierzchnie to antyseptyki.
Skuteczność środków odkażających ocenia się mikrobiologicznymi
metodami laboratoryjnymi in vitro. Dodatkowo w badaniach antyseptyków stosuje się
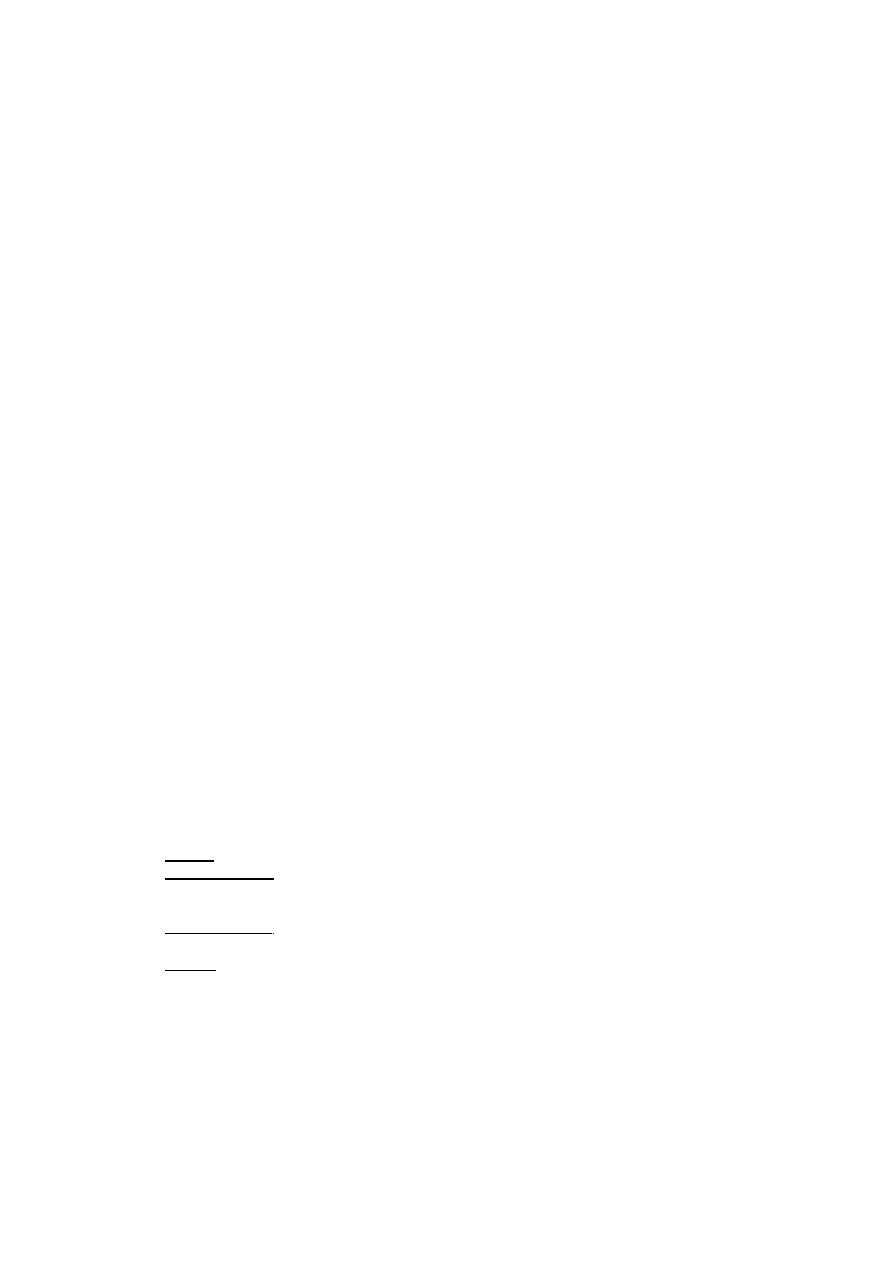
również metody in vivo.
Badania in vitro wykonywane są na wzorcowych szczepach drobnoustrojów o
znanej wrażliwości na związki przeciwdrobnoustrojowe. Są to przedstawiciele
bakterii Gram-dodatnich (np. S. aureus), Gram-ujemnych <np. E. coli, Ps.
aeruginosa), grzybów (np. Candida albicans). W zależności od specyfiki
zastosowania preparatu lista szczepów może być rozszerzona o przedstawicieli
innych gatunków (np. Mycobacterium). Poza tym określa się działanie sporobójcze
(np. przetrwalniki B. subtili), wirusobójcze. Badania in vitro mają na celu ustalenie
efektywnych stężeń lub oczekiwanego stopnia redukcji liczby drobnoustrojów w
określonym czasie kontaktu preparatu z drobnoustrojem.
W niektórych, uzasadnionych przypadkach wykonuje się również badanie
łatwości wytwarzania form opornych (czwartorzędowe związki amoniowe) oraz
trwałości środków odkażających.
Ogólne zasady i metody oceny środków odkażających są regulowane zarówno
przepisami w poszczególnych krajach, jak i w instytucjach międzynarodowych np. w
obrębie Unii Europejskiej. W Polsce jednostką regulującą kryteria oceny preparatów
dezynfekcyjne jest Państwowy Zakład Higieny (PZH). Wg materiałów
metodycznych PZH ocenę chemicznych środków dezynfekcyjnych przeprowadza się
poprzez określenie:
aktywności bakteriostatycznej - granicznego stężenia preparatu
dezynfekcyjnego, które hamuje wzrost drobnoustrojów testowych w podłożu.
aktywności bakteriobójczej metodą zawiesinową - najniższego stężenia
preparatu działającego bakteriobójczo w środowisku wodnym na zawiesinę
drobnoustrojów testowych.
aktywności bakteriobójczej metodą nośnikową - wartości stężenia roztworu
preparatu dezynfekcyjnego działającego bakteriobójczo w oznaczonym
czasie na drobnoustroje testowe naniesione na nośniki (stężenie
użytkowe).
zmiany oporności bakterii na działanie chemicznych preparatów
dezynfekcyjnych – drobnoustroje pasażuje się w podłożu płynnym,
zawierającym preparat dezynfekcyjny w stopniowo podwyższanych
stężeniach; metoda pozwala na stwierdzenie, czy bakterie mają zdolność
nabywania oporności na działanie preparatu oraz na ustalenie, wobec jak
wysokich stężeń preparatu bakterie mogą przeżywać i rozmnażać się.
trwałości bakteriobójczego działania roztworów użytkowych - badanie
utrzymywania się aktywności bakteriobójczej preparatów dezynfekcyjnych w
roztworach o stężeniu użytkowym, przechowywanych w warunkach zbliżonych
do warunków praktycznych.
Ocenę preparatów dezynfekcyjnych według norm Europejskiego Komitetu
Normalizacji - CEN (normy obowiązujące w krajach Unii Europejskiej)
przeprowadza się w kilku fazach:
faza 1
- testy zawiesinowe dotyczące podstawowej aktywności
faza 2 etap 1
- testy zawiesinowe przeprowadzane w warunkach
odpowiadających ich praktycznemu stosowaniu np. ocena aktywności
przeciwprątkowej
faza 2 etap 2
- inne testy laboratoryjne np. badanie działanie antyseptyków
na drobnoustroje sztucznie naniesione na opuszki palców
faza 3
- testy przeprowadzane w warunkach praktycznych
Wg powyższych norm preparaty dezynfekcyjne ocenia się na podstawie
wielkości wyznaczonego w badaniach współczynnika redukcji liczby komórek
drobnoustrojów. Oceniany w fazie 1 związek odkażający powinien spowodować w
warunkach przeprowadzonego doświadczenia redukcję inoculum bakteryjnego w
99,999%, co równa się redukcji log 5 (np. przy inoculum 10
7
/ml liczba komórek
bakteryjnych powinna obniżyć się co najmniej do 10
2
/ml)
Metody termiczne
Dezynfekcja parą wodną w temperaturze 105 - 110°C, nadciśnienie-* 0,45
- 0,50 atm. - stosowana do dezynfekcji sprzętu poddanego wcześniej
czyszczeniu oraz do odkażania bielizny, odzieży, pościeli i inne., a także
do unieszkodliwiania odpadów medycznych; para wodna pod normalnym
ciśnieniem stosowana jest do dezynfekcji wyposażenia sanitarnego
Dezynfekcja gorącą wodą - głównie stosowana w urządzeniach myjąco-

dezynfekujących
Dezynfekcja chemiczno-termiczna - skojarzone działanie ciepła (do 60°C) i
środków chemicznych; stosowana do dezynfekcji sprzętu wrażliwego na działanie
wysokich temperatur.
Dezynfekcja promieniami nadfioletowymi - promieniowanie UV o długości 256
nm redukuje liczbę drobnoustrojów na czystych powierzchniach lub w powietrzu.
Mała zdolność penetracji ogranicza zastosowanie tego czynnika do dezynfekcji.
3. Sterylizacja
Sterylizacja jest procesem mającym na celu zabicie wszystkich form
drobnoustrojów, w tym także spór bakterii. Wyjaławianiu można poddawać ciała
stałe, płynne i gazowe. W zależności od właściwości materiałów stosuje się różne
sposoby wyjaławiania.
Jest wiadomym, że żadna metoda nie zapewnia całkowitej jałowości. Wynika
to z faktu, że niezależnie od wielkości dawki jałowiącej, zawsze istnieje
określona wartość prawdopodobieństwa przeżycia drobnoustrojów w danej
populacji. Z tego powodu przyjęto, że za jałowy w praktyce uznaje się materiał, dla
którego prawdopodobieństwo przeżycia pojedynczych mikroorganizmów jest
mniejsze niż umowna wartość 10"
6
, co znaczy, iż przy milionie jałowionych jednostek
jedna może być nie jałowa.
Gwarancję sterylności materiałów uzyskuje się przez: zachowanie właściwego
toku postępowania z materiałem przed sterylizacją (czyszczenie i dezynfekcja,
pakowanie), prawidłowo przeprowadzony proces sterylizacji i suszenia, prawidłowo
przeprowadzoną kontrolę °procesu 6 - 0,50 0 oraz właściwe postępowanie z
materiałem po sterylizacji (transport, przechowywanie, otwieranie). Niezbędnym
warunkiem prawidłowego przebiegu sterylizacji jest gruntowne oczyszczenie
przedmiotu. Liczba drobnoustrojów znajdująca się na przedmiocie przed sterylizacją
stanowi punkt wyjścia do określenia wyniku sterylizacji. Pewność uzyskania
jałowego produktu jest definiowana za pomocą stopnia redukcji liczby
drobnoustrojów, który powinien być nie mniejszy niż 99,9999%.
Sterylizacja osiąga pełny efekt jeżeli czynnik sterylizujący oddziałuje na
cały sterylizowany materiał (wszystkie powierzchnie) przez ściśle określony czas.
Sterylizację możemy prowadzić metodami fizycznymi i chemicznymi. Każda ze
znanych metod ma swoje zalety i ograniczenia i każda może być metodą z wyboru
dla jałowienia określonego materiału. Przy wyborze metody sterylizacji należy
taką, której zalety przewyższają wady i jest odpowiednia dla sterylizowanego
sprzętu. W sterylizacji obowiązuje zasada, że dla materiału, który można
wyjaławiać parą wodną pod ciśnieniem nie należy stosować innej metody
sterylizacji.
W sterylizacji parowej czynnikiem sterylizującym jest nasycona para wodna
w temperaturze 121°C (nadciśnienie 1 atm.) lub w temperaturze 134°C
(nadciśnienie 2 atm.).
Proces sterylizacji można podzielić na trzy fazy: 1) odpowietrzanie komory
(aparaty przelotowe) i przeznaczonego do sterylizacji materiały lub wytworzenie
próżni w komorze (aparaty próżniowe); 2) właściwa sterylizacja - ekspozycja; 3)
obróbka końcowa - suszenie. Czas sterylizacji ulega zmianie w zależności od
temperatury i rodzaju opakowania.
Czas sterylizacji składa się z: 110°Czas sterylizacji = a + b + c
a)
czasu wyrównania temperatur - zależy od rodzaju opakowania, ciężaru, stopnia
załadowania i wielkości sterylizatora, jest on ustalany przez producenta i osobę
odpowiedzialną za sterylizację; w trudniejszych przypadkach można go
wyznaczyć doświadczalnie na podstawie pomiaru temperatur termosondą;
b)
czas zabicia - (jest on określony dla poszczególnych szczepów
drobnoustrojów) wyznacza się doświadczalnie dla różnych bakterii i ich spor;
c) zapas bezpieczeństwa - ustalany jest przez producenta i osobę
odpowiedzialną za sterylizację
Drugim termicznym czynnikiem sterylizującym jest suche gorące powietrze o
temperaturze 160-180°C. Z innych czynników fizycznych w procesie sterylizacji
wykorzystywane jest promieniowanie jonizują
(promieniowanie gamma i strumień elektronów o dawce 2,5-5 Mrad) głównie na
skalę przemysłową (np. do jałowienia sprzętu jednorazowego użytku,
przeszczepów kostnych, kosmetyków).
Sterylizację gazową można przeprowadzać tlenkiem etylenu lub

formaldehydem. Sterylizacje można przeprowadzać również za pomocą
roztworów preparatów chemicznych takich jak: aldehyd glutarowy, aldehyd
mrówkowy, nadtlenek wodoru, kwas nadoctowy. W związku z nowymi
technologiami stosowanymi w medycynie nastąpiła intensyfikacja badań w celu
znalezienia nowych metod niskotemperaturowych.
Metoda filtracji stosowana jest do wyjaławiania płynów oraz powietrza i innych
gazów.
Jedną z metod ostatnio wprowadzonych do stosowania jest sterylizacja
plazmowa. Plazma jest czwartym stanem skupienia materii. Cząsteczki gazu w
próżni wzbudzane energią w polu elektromagnetycznym przechodzą w stan
plazmy. Obecnie istnieją dwa systemy sterylizacji plazmowej. W pierwszym plazma
wytwarzana jest bezpośrednio w komorze sterylizatora. W drugim plazma
wytworzona poza komorą sterylizatora wprowadzana jest do komory.
Do uzyskania plazmy wykorzystywany jest np. nadtlenek wodoru. Po
wytworzeniu próżni w komorze sterylizatora następuje wtrysk H
2
O
2
, jego parowanie
1 dyfuzja. Cząsteczki H
2
O
2
osiadają na wyjaławianym materiale. Jest to pierwsza
faza biobójcza. Następnie włączane jest źródło energii o wysokiej częstotliwości i z
H
2
O
2
wytwarzana jest plazma - druga faza biobójcza (trwa ona 10-15 min w temp.
max. 44°C). na koniec następuje faza wentylacji i wyrównania ciśnień. Cały cykl
trwa ok. 75 min w temperaturze ok. 40°C. Sterylizowany materiał nie wymaga
degazacji, a po procesie powstają H
2
O i O
2
związki przyjazne dla środowiska.
Metodą tą nie można sterylizować materiałów zawierających celulozę, materiałów
porowatych oraz płynów. Materiał przygotowany do sterylizacji powinien być
idealnie suchy. Nie można sterylizować sprzętu o zamkniętych przewodach. Sprzęt
o średnicy poniżej 3 mm i długości powyżej 30 cm wymaga zastosowania
dodatkowego ładunku H
2
O
2
. Należy stosować specjalny materiał opakowaniowy.
Metody kontroli procesu sterylizacji
Kontrolę procesu sterylizacji przeprowadza się za pomocą wskaźników
fizycznych, chemicznych i biologicznych
Wskaźniki fizyczne - termometry, manometry, zegary, mierniki wilgotności,
mierniki zawartości gazu i inne przyrządy wmontowane do urządzenia
sterylizującego informują o stanie technicznym sterylizatora. Mierzą punktowo dany
parametr. Oprócz obserwacji wskazań tych przyrządów coraz częściej stosuje się
system rejestracji podstawowych parametrów fizycznych w postaci wydruków,
wykresów lub raportów.
Wskaźniki chemiczne, w których substancja chemiczna poddana procesom
fizycznym i chemicznym wystarczającym do zabicia spór w procesie sterylizacji
trwale, wyraźnie i jednoznacznie zmienia swoje właściwości fizyczne (np. barwę).
Wskaźniki chemiczne informują jedynie czy w danym cyklu pracy zostały osiągnięte
warunki sterylizacji, nie dają one gwarancji, że poddany sterylizacji materiał został
wyjałowiony
Wskaźniki chemiczne można podzielić na:
sprawdziany sterylizacji - przeznaczone głównie do użycia zewnętrznego,
które wykazują jedynie, że materiał został poddany procesowi sterylizacji;
zmiana barwy następuje pod wpływem osiągnięcia jednego z parametrów
sterylizacji np. temperatury (nie wykazują jak długo ta temperatura się
utrzymywała); pozwalają na wizualne odróżnienie materiału, który był poddany
sterylizacji od sprzętu nie wyjałowionego (np. taśmy kontrolne samoprzylepne)
wskaźniki wieloparametrowe - wkładane do wnętrza pakietu, wykazują, że
wewnątrz ładunku zostały osiągnięte wartości wszystkich lub kilku
(przynajmniej dwóch) 9999%.krytycznych parametrów procesu sterylizacji;
informują o prawidłowości przebiegu procesu (np. Zintegrowany Test TST,
Rurka Brown'a typ 5)
Wskaźniki biologiczne -zawierają określone liczby żywych, zdolnych do przejścia
w formy wegetatywne, opornych na dany rodzaj czynnika wyjaławiającego
przetrwalników bakteryjnych:
Bacillus subtilis - suche gorące powietrze, tlenek etylenu
Bacillus stearothermophilus - gorąca nasycona para wodna pod ciśnieniem
Bacillus pumilis - promieniowanie jonizujące;
informują o fakcie zabicia drobnoustrojów (spór wyselekcjonowanych szczepów
bakterii wysoce opornych na dany czynnik sterylizacyjny). Wskaźniki biologiczne
dają gwarancję jałowości - jeżeli użyte w teście przetrwalniki zostały zabite oznacza
to, iż zostały zabite wszystkie bardziej wrażliwe drobnoustroje zanieczyszczające

sterylizowany materiał.
Dla uzyskania pełnej informacji niezbędne jest monitorowanie procesu sterylizacji
za pomocą wszystkich trzech metod. Wskaźniki fizyczne określają bowiem stan
techniczny-urządzenia, chemiczne - warunki procesu informując o jego
nieprawidłowościach, pozwalając na ich korygowanie zanim uzyska się wyniki
kontroli przy użyciu testów biologicznych. Jedynie wskaźniki biologiczne informują
o bójczym działaniu procesu i dają pełną gwarancję jałowości.
Skuteczność sterylizacji powinna być kontrolowana:
okresowo - przy użyciu wskaźników biologicznych
kontrola zewnętrzna - wykonywana przez stacje sanitarno-epidemiologiczną -
każdy sterylizator raz na kwartał
kontrola wewnętrzna - prowadzona przez użytkownika - co najmniej raz na
miesiąc, w miarę potrzeb i możliwości częściej
na bieżąco - przy użyciu wskaźników chemicznych - użytkownik ma
obowiązek kontroli każdego procesu sterylizacji
Kontrola aparatów do filtracji - testy integralności filtrów
a) Metody fizyczne
Metoda pęcherzykowa
Metoda pęcherzykowa (tzw. bubble point) polega na pomiarze ciśnienia,
przy którym ciśnienie kapilarne cieczy znajdującej się we wnętrzu sączka
zostanie pokonane.
Metoda szybkości dyfuzji
Metoda pomiaru szybkości dyfuzji polega na ocenie czasu przepływu
gazu przez mokry sączek pod wpływem określonego ciśnienia.
b) Metoda biologiczna
Polegają na sączeniu zawiesiny kultur bakteryjnych o wielkości komórek do 0,3
μm, o odpowiedniej gęstości inoculum i ocenie jałowości przesączu. Zazwyczaj
stosuje się inoculum szczepu Pseudomonas diminuta o gęstości 10
7
komórek
na każdy centymetr kwadratowy sączka. W badaniu testowym stosuje się sączki
o deklarowanej wielkości porów 0,22 μm.
4. Antyseptyka skóry rąk
Zwykłe mycie rąk (socjalne) to zabieg polegający głównie na zmyciu z
powierzchni skóry rąk
zanieczyszczeń organicznych i brudu oraz na częściowej eliminacji ze skóry rąk
flory przejściowej i stałej.
W celu przeprowadzenia higienicznego mycia rąk, nanosi się na dłonie
odpowiednią ilość mydła. Czas mycia powinien wynosić nie mniej niż 30 sek.
Po dokładnym umyciu ręce spłukuje się i osusza jednorazowym ręcznikiem.
Przy myciu można stosować rutynową technikę mycia rąk wg Ayliffe
Kiedy należy myć ręce?
przed rozpoczęciem dnia pracy i po dłuższych przerwach w pracy
po wyjściu z toalety
po wykonanych pracach porządkowych i
czystościowych.
Najczęściej popełniane błędy podczas mycia rąk:
zbyt krótki czas mycia
niedokładne mycie rąk
pozostawienie na dłoniach biżuterii czy zegarka
używanie "wspólnego" mydła w kostce lub mydła w płynie zanieczyszczonego
mikrobiologicznie
wytarcie rąk po umyciu ręcznikiem wspólnego i wielokrotnego użycia
używanie zbyt gorącej wody, zbyt częste mycie rąk, zaraz po
przeprowadzonej dezynfekcji rąk preparatem alkoholowym (takie
postępowanie obniża poziom wrażliwości skóry na środki myjące i powoduje
jej wysuszanie i uszkodzenia).
Dezynfekcja higieniczna składa się z mycia zwykłego (etap I - brudny) i dezynfekcji
(etap II - czysty) Dezynfekcję higieniczną przeprowadza się stosując antyseptyk na
czystą, pozbawioną zanieczyszczeń organicznych i brudu skórę rąk (aktywność

alkoholowych preparatów spada znacznie w obecności obciążenia organicznego,
podobny wpływ mogą mieć niektóre kremy pielęgnacyjne i zanieczyszczenia
innego pochodzenia niż organiczne). Skóra rąk po umyciu musi być dokładnie
osuszona jednorazowym ręcznikiem (preparat antyseptyczny naniesiony na mokrą
skórę ulega rozcieńczeniu i nie wykazuje dostatecznej aktywności biobójczej).
Dokładną dezynfekcję całej powierzchni dłoni zapewnia stosowanie techniki rąk wg.
Ayliffe. Przed przystąpieniem do dezynfekcji i mycia rąk należy zdjąć biżuterię i
zegarek. W celu przeprowadzenia higienicznej dezynfekcji rąk należy nanieść 3ml
alkoholowego preparatu antyseptycznego i dokładnie wcierać go w skórę aż do
momentu całkowitego wyschnięcia, tj. 30-60 sek.

Kiedy należy przeprowadzać dezynfekcje rąk?
przed i po każdym zabiegu leczniczym, badaniu, pielęgnacji
po zdjęciu rękawic ochronnych
po każdym kontakcie z pacjentem, z zanieczyszczonymi przedmiotami, z
materiałem zakaźnym, wydalinami, wydzielinami i płynami ustrojowymi
Najczęściej popełniane błędy podczas dezynfekcji rąk to:
zbyt krótko przeprowadzany zabieg dezynfekcji
stosowanie zbyt małej objętości preparatu
niedokładne przeprowadzenie dezynfekcji
pozostawienie na rękach biżuterii i zegarka
stosowanie alkoholowych preparatów dezynfekcyjnych na mokrą skórę i/lub
znacznie obciążoną tkanką organiczną i innymi zanieczyszczeniami
Celem dezynfekcja chirurgicznej rąk jest jak najdalej idąca eliminacja
drobnoustrojów flory przejściowej i stałej.
Etap I - chirurgiczne mycie rak
Przed myciem rąk należy zdjąć biżuteńę i zegarek. Wstępnie umyć ręce
(mycie zwykłe). Następnie przeprowadzić mycie chirurgiczne. Do mycia należy
używać bieżącej ciepłej wody i mydeł w płynie dozowanych ze specjalnych
dozowników ściennych wyposażonych w dźwignię do dozowania mydła za
pomocą łokcia lub pedału nożnego. Dokładne umycie całej powierzchni rąk
zapewnia stosowanie techniki mycia np. wg Ayliffe.
W celu przeprowadzenia chirurgicznego mycia rąk nanosi się na dłonie
odpowiednią ilość mydła. Czas mycia powinien wynosić ok. 2-5 min. Bardzo
dokładnemu myciu poddaje się dłonie i przedramię. Po umyciu ręce dokładnie
spłukuje się wodą i osusza jałowym ręcznikiem.
Etap II - dezynfekcja chirurgiczna
Dezynfekcję chirurgiczną przeprowadza się po uprzednim dokładnym chirurgicznym
umyciu rąk. Ręce muszą być dokładnie wytarte suchym, jałowym ręcznikiem.
Na ręce nanosi się przeważnie 5ml środka antyseptycznego i dokładnie wciera
preparat w skórę rąk i przedramienia, aż do momentu całkowitego wyschnięcia
preparatu, tj. ok. 2,5 minuty. Czynność należy powtórzyć dwukrotnie zwracając
szczególną uwagę na czubki palców i obrąbek naskórkowy paznokcia.

ANEKS
Ocena aktywności bakteriobójczej preparatów dezynfekcyjnych metodą
zawiesinową (MBC)
Zasada metody: określenie najniższego stężenia preparatu działającego
bakteriobójczo w środowisku
wodnym na zawiesinę drobnoustrojów testowych.
W badaniu używa się standardowe szczepy wzorcowe drobnoustrojów z kolekcji
międzynarodowych.
Wykonanie badania
W kolbach miarowych przygotować wyjściowe roztwory badanego preparatu oraz
preparatu wzorcowego. Z roztworu wyjściowego przygotować serię roztworów do
badań w kolbach lub bezpośrednio w probówkach (średn. 35 mm, wys. 100 mm).
Każda probówka powinna zawierać 5 ml roztworu, wszystkie probówki z
roztworami oraz bulionową hodowlą drobnoustrojów testowych umieścić w łaźni
wodnej w temp. 20°C. Po upływie 15 min do każdego roztworu dodawać po 0,5
ml zawiesiny drobnoustrojów, uważając, aby nie dotknąć powierzchni roztworu i
nie nanieść zawiesiny na ścianę probówki (nie dotknąć pipetą i nie rozpryskać
zawiesiny). Następnie zawartość probówek wymieszać, obracając probówkę ruchem
wirowym i ponownie umieścić w łaźni wodnej.
Zawiesinę należy dodawać do kolejnych roztworów (zaczynając od
najwyższego stężenia) w takich odstępach czasu (np. 30 sek.), aby następnie
mieć możność wykonania posiewów do podłoża płynnego z każdego rozcieńczenia
dokładnie po 5,10 i 15 min ekspozycji. Przed.każdym posiewem zawartość
probówki wymieszać obracając ją ruchem wirowym. Posiewy wykonać ezą do
bulionu (lub bulionu z inaktywatorem) znajdującego się w probówkach. Inkubować
w temperaturze 37°C. Wyniki odczytać po 48 godzinach.
Wstępne badania wykonywać w szerokim zakresie stężeń, następnie
przeprowadzać oznaczenia w wąskich zakresach stężeń w granicach określonych w
badaniu wstępnym.
Interpretacja wyników
Na podstawie uzyskanych wyników oblicza się współczynnik aktywności
bakteriobójczej badanego preparatu w odniesieniu do aktywności preparatu
wzorcowego. Współczynnik aktywności jest liczbą, którą otrzymuje się przez
podzielenie najniższego stężenia preparatu wzorcowego, zabijającego
drobnoustroje w czasie 10 min, lecz nie zabijającego drobnoustroje w czasie 5
min przez najniższe stężenie badanego preparatu dające ten sam efekt.
Współczynnik aktywności wskazuje w jakim stosunku pozostaje do siebie
aktywność obu preparatów w danym układzie badań.
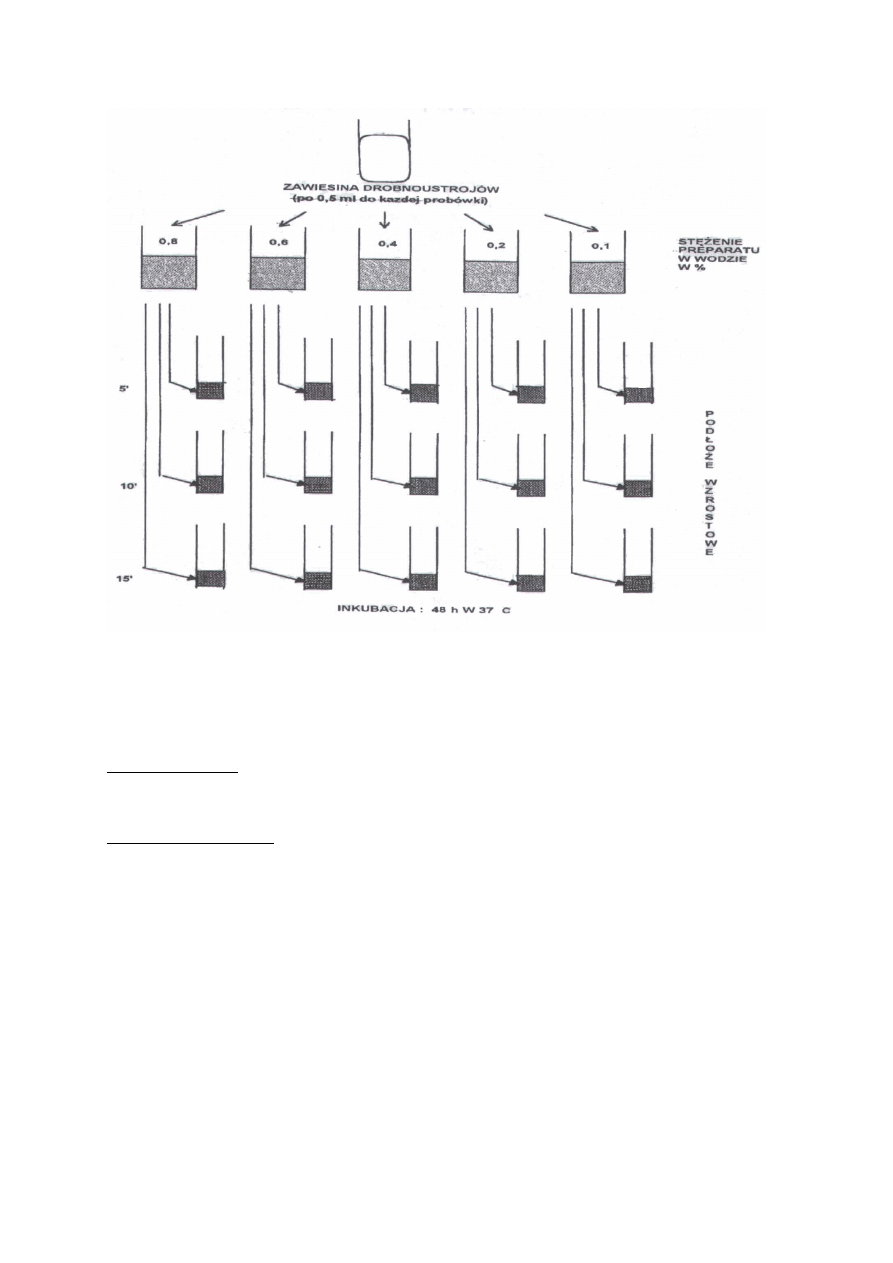
Określanie stężenia użytkowego preparatów dezynfekcyjnych metodą
zawiesinową wg PZH
Zasada metody: określenie wartości stężenia roztworu preparatu dezynfekcyjnego
działającego biobójczo w odpowiednim czasie na drobnoustroje testowe
umieszczone na nośnikach
Wykonanie badania Do jednego badania używano:
13 cylinderków
11 probówek zawierających po 10 ml badango preparatu
11 probówek zawierających po 10 ml inaktywatora
12 probówek zawierających po 10 ml podłoża
Statywy z probówkami umieszczano w łaźni wodnej o temp. 20°C.
Jeden jałowy nośnik przeniesiono do jałowej probówki. Do pozostałych 12 dodano
12 ml zawiesiny drobnoustrojów testowych. Po 15 min. kontaktu nośniki
przenoszono do płytki Petriego wyłożonej podwójną warstwą bibuły filtracyjnej
ustawiając je w pozycji pionowej. Nośniki suszono w temp. 37°C w lekko uchylonej
płytce przez 50-60 min. Suche nośniki przenoszono pojedynczo w 60-
sekundowych odstępach do uprzednio przygotowanych probówek z preparatem
dezynfekcyjnym, wstrząsając trzykrotnie ruchem wirowym. Po 15 min. nośniki
przenoszono do roztworu inaktywatora zachowując tę samą kolejność i ten sam
odstęp czasu jak poprzednio. Następnie cylinderki przenoszono (zachowując te
same warunki) do 10 probówek z podłożem wzrostowym. Dodatkowo, przy
każdym badaniu wykonano dwie kontrole: a} kontrola wzrostu: 1 nośnik
zanieczyszczony zawiesiną szczepów testowych lecz nie poddany działaniu
preparatu i inaktywatora umieszczano w probówce z podłożem wzrostowym, b) 0
kontrola działania bakteriostatycznego preparatu w podłożu: w tym celu 1
nośnik eksponowany w roztworze preparatu i inaktywatora (warunki ekspozycji
jak poprzednio) umieszczano w probówce z podłożem. W tej samej probówce 7°
umieszczono 1 nośnik zanieczyszczony zawiesiną szczepów testowych, lecz nie
poddany działaniu preparatu i inaktywatora. Próby inkubowano 48h w 37°C
Interpretacja wyników:
Roztwór w badanym stężeniu uznaje się za skuteczny, jeżeli:
nie obserwuje się wzrostu drobnoustrojów testowych w żadnej probówce z
podłożem wzrostowym, w przypadku zastosowania 50 nośników
nie obserwuje się wzrostu drobnoustrojów testowych w co najmniej 59
probówkach z podłożem wzrostowym, w przypadku zastosowania 60 nośników
w kontroli a i b wystąpi wzrost
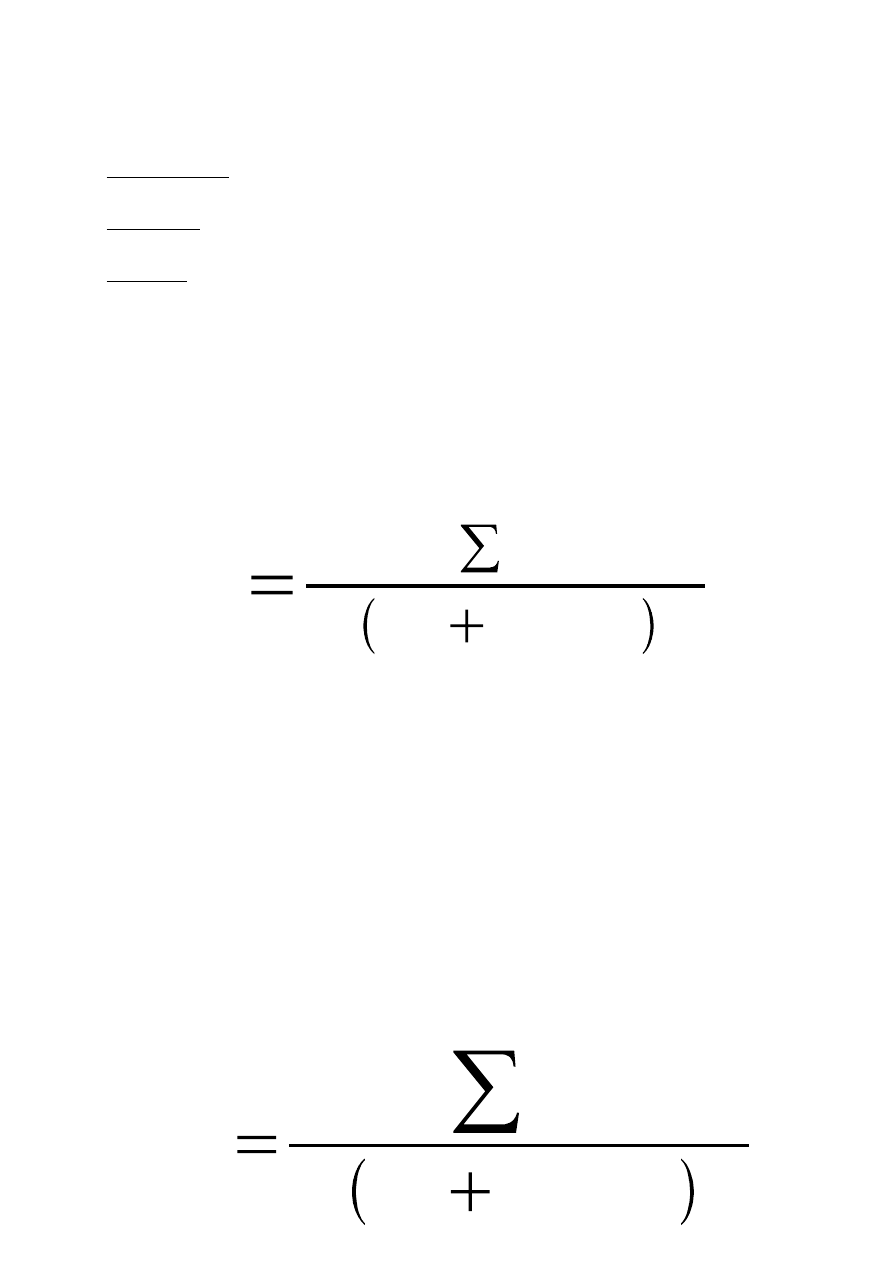
Ocena aktywności bakteriobójczej preparatów dezynfekcyjnych metodą zawiesinwą wg
norm Europejskiego Komitetu Standaryzacji(CEN) EN 1040 -faza 1
Zasada metody: określenie wielkości redukcji liczby drobnoustrojów za pomocą
badanego preparatu
dezynfekcyjnego w określonym stężeniu i czasie - wyznaczenie współczynnika redukcji
Wymagania: preparat powinien obniżać o co najmniej 10
5
liczbę żywych komórek szczepów
testowych
bakterii - Pseudomonas aeruginosa i Staphylococcus aureus.
Wykonanie
Przygotować zawiesinę drobnoustrojów testowych (N) o gęstości 1,5 x 10
8
do 5,0 x 10
8
.
Liczenie bakterii
wykonać metodą rozcieńczeniową. Do obliczeń brać płytki zawierające mniej niż 300 kolonii.
Zęby wynik był
wiarygodny przynajmniej jedna płytka ma zawierać 15 lub więcej kolonii; liczba komórek
powinna być
oznaczona przy użyciu przynajmniej jednej pary płytek, z których jedna lub obie zawierają
więcej niż 15
kolonii, a obie płytki zawierają mniej niż 300 kolonii. Jeśli płytki z dwóch rozcieńczeń
spełniają te kryteria
wyraź liczbę cfu/ml jako średnią ważoną, jeśli tylko z jednego rozcieńczenia -jako średnią
arytmetyczną.
gdzie:
V - objętość próby
C - suma kolonii z wszystkich płytek branych pod uwagę
n
1
n
2
- liczba płytek branych pod uwagę odpowiednio przy pierwszym i drugim rozcieńczeniu
d - współczynnik pierwszego branego do obliczeń rozcieńczenia
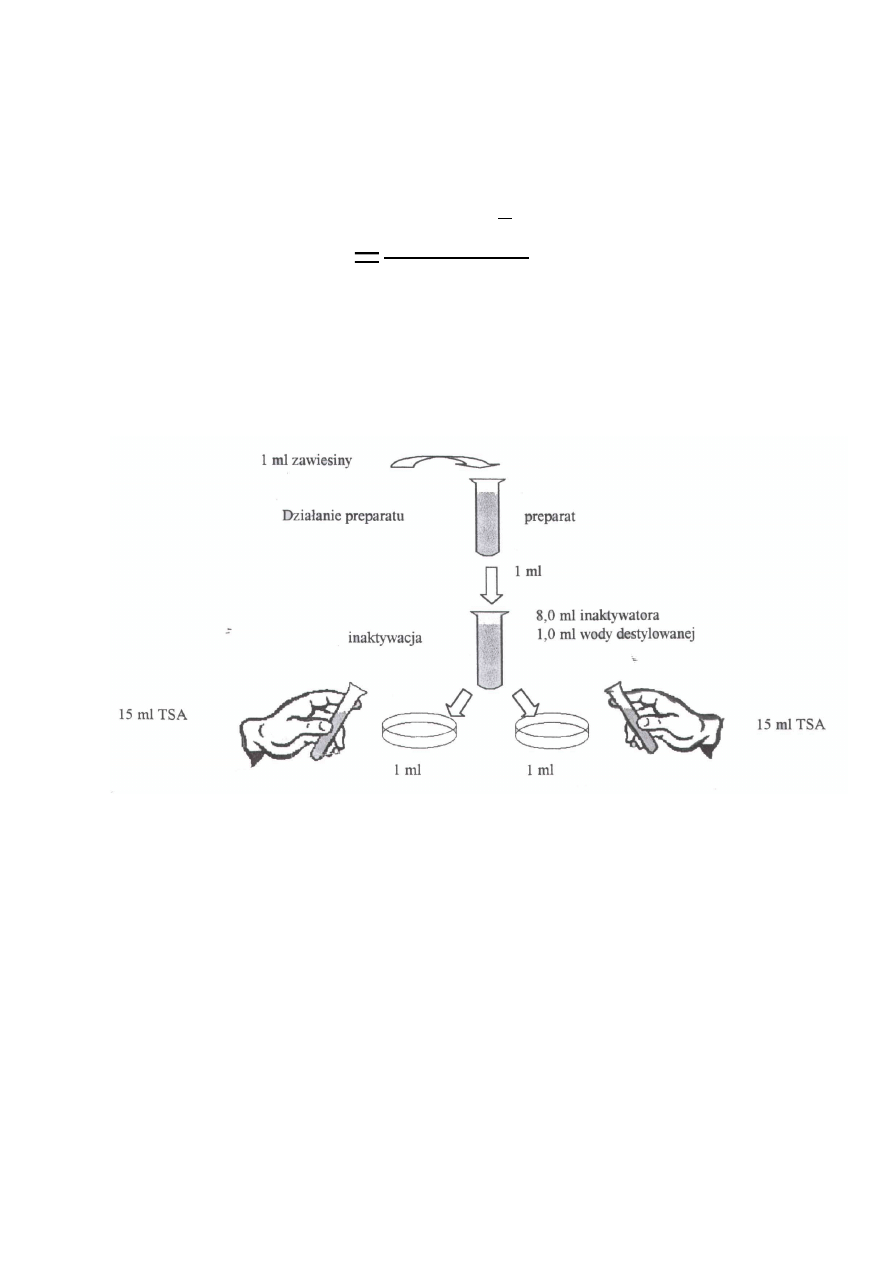
Przygotować rozcieńczenia preparatu w wodzie w stężeniu 1,25 krotnie wyższym od
wyznaczonego do badań. Do probówki zawierającej 8,0 ml rozcieńczenia preparatu
i 1,0 ml wody dodać 1,0 zawiesiny bakterii o gęstości 1,5 x 10
8
do 5,0 x 10
8
, włączyć
stoper, wymieszać i umieścić w łaźni wodnej o temp 20°C. Tuż przed upływem
wyznaczonego czasu kontaktu zawartość probówki wymieszać, a następnie w wyznaczonym
czasie przenieść 1,0 ml do probówki zawierającej 8,0 ml inaktywatora i 1,0 ml wody. Włączyć
stoper, wymieszać i umieścić w łaźni wodnej o temp 20 C. Po 5 minutach inaktywacji i
dokładnym wymieszaniu pobrać dwie próbki o objętości 1,0 ml, przenieść do płytek Petriego i
zalać 15 ml płynnego schłodzonego podłoża TSA. Próby inkubować 24 h w temp 37°C. Po
inkubacji zliczyć wyrosłe kolonie drobnoustrojów i obliczyć liczbę przeżyłych komórek wg
wzoru:
N
A
C
V n
1
0,1 n
2
d
N
C
V n
1
0,1 n
2
d
d - w tej metodzie wynosi 10
-1
Jeżeli liczba kolonii na wszystkich liczonych płytkach jes mniejsza niż 15, zapisz, że
liczba żywych komórek w mieszaninie jest mniejsza niż 1,5 x 10
1
cfu/ml, natomiast jeżeli
wynosi > 300, to zapisz, że liczba żywych komórek w mieszaninie jest większa niż 3 x
10
2
cfu/ml. Dla każdego drobnoustroju testowego oblicz współczynnik redukcji (RF) wg wzoru:
W celu uwiarygodnienia metody przed każdym badaniem należy wykonać testy
walidacyjne, które pozwalają na stwierdzenie czy: 10 w badaniach użyto zawiesinę o
odpowiedniej liczbie żywych komórek; 2) użyty w badaniach inaktywator skutecznie
inaktywował badany preparat - walidacja rozcieńczania-inaktywacji; 3) czy inaktywator
nie wykazywał działania toksycznego na badane
RF
N x 10
1
N
A
Wyszukiwarka
Podobne podstrony:
8 Receptura aseptyczna id 4675 Nieznany (2)
Abolicja podatkowa id 50334 Nieznany (2)
4 LIDER MENEDZER id 37733 Nieznany (2)
katechezy MB id 233498 Nieznany
metro sciaga id 296943 Nieznany
perf id 354744 Nieznany
interbase id 92028 Nieznany
Mbaku id 289860 Nieznany
Probiotyki antybiotyki id 66316 Nieznany
miedziowanie cz 2 id 113259 Nieznany
LTC1729 id 273494 Nieznany
D11B7AOver0400 id 130434 Nieznany
analiza ryzyka bio id 61320 Nieznany
pedagogika ogolna id 353595 Nieznany
Misc3 id 302777 Nieznany
cw med 5 id 122239 Nieznany
D20031152Lj id 130579 Nieznany
więcej podobnych podstron