
Zbiór wybranych oznaczeń fizyczno-chemicznych
zalecanych w badaniach wód naturalnych
(na podstawie Norm Polskich)
prof. dr hab. inż. Hanna Obarska-Pempkowiak
mgr inż. Elżbieta Haustein
Gdańsk, październik 2008

WSTĘP
................................................................................................................................................... 3
WODA W PRZYRODZIE ....................................................................................................................... 3
ĆWICZENIE 1
....................................................................................................................................... 4
1.1. BARWA ............................................................................................................................................. 4
1.2. O
BLICZANIE ZAWARTOŚCI AGRESYWNEGO CO
2
NA PODSTAWIE WOLNEGO CO
2
I ZASADOWOŚCI ............................................................................................................................ 5
1.3. Z
ASADOWOŚĆ MINERALNA I ZASADOWOŚĆ OGÓLNA .......................................................... 8
1.4. W
OLNY DITLENEK WĘGLA (CO
2
) ................................................................................................. 11
ĆWICZENIE 2
...................................................................................................................................... 14
2.1. T
WARDOŚĆ OGÓLNA ..................................................................................................................... 14
2.2. W
APŃ ................................................................................................................................................ 18
2.3. MAGNEZ ........................................................................................................................................... 19
2.4. K
WASOWOŚĆ I ZASADOWOŚĆ .................................................................................................... 22
ĆWICZENIE 3
...................................................................................................................................... 27
3.1. CHLORKI ........................................................................................................................................... 27
3.2. SIARCZANY (VI) - ............................................................................................................................. 28
ĆWICZENIE 4
..................................................................................................................................... 31
4.1. UTLENIALNOŚĆ (ChZT metodą nadmanganianową) ................................................................... 31

Wstęp
Woda w przyrodzie
Wody różnego rodzaju pokrywają prawie ¾ powierzchni naszego globu, z czego 97% stanowią morza i
oceany, około 2% wody lodowcowe, a resztę wody głębinowe, jeziora i rzeki oraz woda w atmosferze.
Zaniec
zyszczenia wód naturalnych można podzielić ogólnie na:
- fizyczne,
- chemiczne,
- bakteriologiczne.
Osobny rodzaj stanowi
ą zanieczyszczenia substancjami radioaktywnymi.
Szczegółowe warunki organoleptyczne i fizyczno-chemiczne, którym powinna odpowiadać woda do picia i
na potrzeby gospodarcze okre
śla:
-
Rozporz
ądzenie Ministra Zdrowia z dnia 29 marca 2007 r. w sprawie jakości wody
przeznaczonej do spo
życia przez ludzi ( Dz. U. Nr 61, poz. 417),
-
Rozporz
ądzenie Ministra Środowiska z dnia 27 listopada 2002 w sprawie wymagań, jakim
powinny odpowiada
ć wody powierzchniowe wykorzystywane do zaopatrzenia ludności w
wod
ę przeznaczoną do spożycia (Dz. U. Nr 204, poz. 1728).
O przydatno
ści wody do danego celu decyduje ocena rodzaju i stężenia zawartych w niej substancji.
Badania wody maj
ą charakter fizyczno-chemiczny oraz biologiczny. Zakres badań zależy od
przeznaczenia wody. Badaj
ąc wodę zupełnie nieznaną określa się wszystkie jej składniki, mogące mieć
wpływ na jej jakość, natomiast w badaniach kontrolnych w znanej wodzie oznacza się tylko te składniki,
które mogą ulec zmianom.
Poni
żej przedstawiono wybrane metody analizy jakości wody, ujęte w Normach Polskich, wykorzystywane
w laboratoriach technologii wody i
ścieków, w pracach analityczno-badawczych oraz w trakcie
prowadzonych
ćwiczeń dydaktycznych przewidzianych dla studentów o kierunku Inżynieria Środowiska i
Budownictwo.

Ćwiczenie 1
1.1. Barwa
Barwa jest właściwością optyczną wody, polegająca na pochłanianiu części widma promieniowania
widzialnego przez substancje rozpuszczone, koloidalne oraz cz
ąstki zawiesin obecnych w wodzie lub
ściekach
Barwa mo
że być spowodowana przez wiele czynników, takich jak:
ro
ślinność i produkty jej rozkładu,
zwi
ązki humusowe,
plankton,
jony metali (np.
żelaza, manganu),
dopływ ścieków z zakładów przemysłowych
(np. z farbiarni, galwanizerni, zakładów papierniczo-
celulozowych itp.).
W analityce rozróżnia się barwę pozorną i rzeczywistą.
Barwa pozorna spowodowana jest obecno
ścią substancji rozpuszczonych oraz drobnych cząstek
zawieszonych w wodzie. Barw
ę pozorną oznacza się bezpośrednio, bez uprzedniego sączenia lub
odwirowywania próbki.
Barwa rzeczywista jest to barwa wody pozbawionej m
ętności (poddanej sączeniu lub odwirowywaniu).
Jednostka barwy [mg Pt/dm
3
] - zabarwienie, jakie nadaje 1 mg platyny rozpuszczonej w
heksachloroplatynianie (IV) potasu - K
2
PtCl
6
w 1 dm
3
wody destylowanej z dodatkiem 0,5 mg kobaltu w
postaci chlorku kobaltu(II) - CoCl
2
2
O.
METODY OZNACZANIA
Do oznaczania barwy mo
żna wykorzystać metody:
-
porównawczą według skali platynowo-kobaltowej lub dichromianowo-kobaltowej,
- opisow
ą, przez oznaczanie liczby progowej barwy,
- instrumentaln
ą, przy wykorzystaniu spektrofotometru lub fotometru w zakresie widma widzialnego przy
długości fali od 400 do 700 nm.
Za podstaw
ę oznaczania barwy przyjęto metodę fotometryczną w oparciu o krzywą wzorcową według
skali dichromianowo-kobaltowej zgodnie z:
PN-EN ISO 7887: 2002. Jako
ść wody. Badanie i oznaczanie barwy

PN-C-04558: 1974. Woda i
ścieki. Oznaczanie barwy
Oznaczenie polega na sporz
ądzeniu krzywej wzorcowej i porównaniu próbki badanej, w sposób wizualny
lub instrumentalny (na podstawie pomiaru osłabienia absorpcji światła przy odpowiedniej długości fali).
Wykonanie oznaczenia.
W celu oznaczenia barwy pozornej lub rzeczywistej odmierzy
ć bezpośrednio 100cm
3
próbki badanej do
cylindra Nesslera (lub mniejsz
ą jej objętość rozcieńczoną wodą destylowaną do 100 cm
3
), bez/lub po
uprzednim odwirowaniu lub przes
ączeniu, jeżeli próbka wykazuje mętność. Następnie oznaczyć barwę
przez p
orównanie ze skalą wzorców lub wykorzystać jedną z metod instrumentalnych. W przypadku
zastosowania techniki instrumentalnej, jako odno
śnik należy zastosować wodę destylowaną.
Barw
ę w badanej próbce (w mg Pt/dm3), obliczyć z równania:
x = a ·1000/V
gdzie:
a
– wartość odczytana z krzywej wzorcowej, mg Pt/100 cm
3
V
– objętość próbki badanej użyta do oznaczania, cm
3
.
1.2. Obliczanie zawartości agresywnego CO
2
na podstawie wolnego CO
2
i
zasadowości
Agresywny ditlenek w
ęgla oznacza się w wodach zawierających wolny ditlenek węgla.
METODY OZNACZANIA:
W celu oznaczenia agresywnego ditlenku w
ęgla można wykorzystać metody:
z u
życiem marmuru,
pośrednią z zastosowaniem nomogramów,
pośrednią przy użyciu tablic według Lechmanna i Reussa
Wymienione metody oznaczania ditlenku w
ęgla agresywnego mają podobne ograniczenia zastosowania
jak w przypadku oznaczania wolnego ditlenku wegla, a ponadto:
metody z u
życiem marmuru nie można stosować do wód o twardości < 0,5 mmol/dm
3
tabela Lehmanna i Reussa mog
ą być stosowane tylko w tych przypadkach, gdy stosunek stężenia
jonów wodorowęglanowych (HCO
3
-
) w mval/dm
3
do st
ężenia jonów wapniowych (Ca
2+
) w
mavl/dm
3
nie b
ędzie przekraczał wartości od 0,75 do 1,25. Jeżeli stosunek ten będzie mniejszy
ni
ż 0,75 lub większy niż 1,25 to obliczanie agresywnego CO
2
na podstawie tabeli daje du
że błędy.
Metodykę oznaczania agresywnego ditlenku węgla podano zgodnie z PN-C-04547-03: 1974. Woda i

ścieki. Badania zawartości dwutlenku węgla. Oznaczanie agresywnego dwutlenku węgla w wodzie.
Zawarto
ść agresywnego ditlenku węgla w wodzie należy obliczyć na podstawie danych liczbowych
zawartych w tabeli 1 (wg. Lehmanna i Reussa), ułożonej na podstawie równowagi węglanowej, jaka
istnieje mi
ędzy zasadowością i wolnym ditlenkiem węgla.
gdzie:
S
– oznacza sumę wolnego i związanego CO
2
w mg/dm
3
G - suma zwi
ązanego i agresywnego CO
2
pomno
żoną przez współczynnik dysocjacji kwasu węglowego
(H
2
CO
3
)
Wykonanie oznaczenia
W badanej próbce oznaczyć zasadowość ogólną oraz wolny ditlenek węgla, zgodnie z
procedurami. Otrzymany wynik oznaczania zasadowo
ści ogólnej wyrazić w mg CO
2
/dm3
korzystaj
ąc z zależności:
1 mval / dm
3
= 22 mg CO
2
/dm
3
Nast
ępnie obliczyć wartość S wg wzoru:
S = a + Z
a
gdzie:
a
– zawartość wolnego ditlenku węgla, w mg CO
2
/dm
3
Z
a
– zasadowość próbki, w mg CO
2
/dm
3
Zawarto
ść agresywnego ditlenku węgla, w mg CO
2
/dm
3
obliczy
ć wg wzoru:
X
a
= G - Z
a
gdzie:
G
– wartość odczytana z tablicy 1
Z
a
– zasadowość próbki, w mg CO
2
/dm
3
.
Przykład
Badana woda zawiera 22 mg CO
2
/dm
3
wolnego, a jej zasadowo
ść ogólna wynosi M = 2 mval/dm
3
.
Nale
ży obliczyć zawartość agresywnego ditlenku węgla korzystając z tabeli Lehmanna i Reussa.
Korzystaj
ąc z tej tabeli należy zasadowość ogólną (M) wyrazić w mg CO
2
/dm
3
. W tym celu nale
ży
zasadowo
ść wyrażoną w mval/dm
3
pomno
żyć przez 22. Ponieważ S = CO
2
wolny +CO
2
zwi
ązany (w
mg/dm
3
), zatem nale
ży obliczyć ilość związanego CO
2
:
CO
2
zwi
ązany = zasadowość
3
, czyli S = 22 + 44 = 66 mg CO
2
/dm
3
.
Warto
ść S = 66 odpowiada wartości G = 60,4 odczytanej z tabeli. Wobec tego ilość agresywnego CO
2
=
60,4
– 44 = 16,4 mg/dm
3
.

TABELA 1. Według Lehmanna i Reussa
S
G
S
G
S
G
S
G
S
G
1
1
45
43,0
89
77,3
133
104,3
177
126,2
2
2
46
43,9
90
78
134
104,8
178
126,6
3
3
47
44,7
91
78,7
135
105,4
179
127,0
4
4
48
45,6
92
79,3
136
105,9
180
127,5
5
5
49
46,5
93
80,0
137
106,5
181
127,9
6
6
50
47,3
94
80,8
138
106,9
182
128,4
7
7
51
48,2
95
81,4
139
107,5
183
128,8
8
8
52
49,0
96
82,1
140
108,1
184
129,2
9
9
53
49,9
97
82,7
141
108,6
185
129,7
10
10
54
50,7
98
83,3
142
109,1
186
130,2
11
11
55
51,5
99
84,0
143
109,6
187
130,6
12
12
56
52,4
100
84,6
144
110,2
188
131,0
13
13
57
53,2
101
85,3
145
110,7
189
131,4
14
13,9
58
54,0
102
85,9
146
111,2
190
131,9
15
14,9
59
54,8
103
86,5
147
111,7
191
132,3
16
15,9
60
55,7
104
87,2
148
112,2
192
132,7
17
16,9
61
56,3
105
87,6
149
112,5
193
133,2
18
17,8
62
57,2
106
88,4
150
113,2
194
133,7
19
18,8
63
58,1
107
89,1
151
113,7
195
134,0
20
19,8
64
58,8
108
89,7
152
114,2
196
134,4
21
20,8
65
59,6
109
90,4
153
114,7
197
134,8
22
21,7
66
60,4
110
90,9
154
115,3
198
135,2
23
22,7
67
61,2
111
91,6
155
115,8
199
135,7
24
23,7
68
62,0
112
92,2
156
116,3
200
136,0
25
24,6
69
62,8
113
92,8
157
116,6
210
141,6
26
25,8
70
63,5
114
93,4
158
117,3
220
145,6
27
26,5
71
64,3
115
94,0
159
117,6
230
149,8
28
27,5
72
65,0
116
94,6
160
118,1
240
153,8
29
28,4
73
65,8
117
95,1
161
118,6
250
157,5
30
29,4
74
66,5
118
95,8
162
119,1
260
161,2
31
30,3
75
67,3
119
96,3
163
119,6
270
164,9
32
31,2
76
68,0
120
97,0
164
120,1
280
168,5
33
32,3
77
68,8
121
97,6
165
120,6
290
171,9
34
33,1
78
69,5
122
98,1
166
121,0
300
175,3
35
34,0
79
70,3
123
98,6
167
121,5
310
178,8
36
34,9
80
71,0
124
99,2
168
122,0
320
182,1
37
35,9
81
71,7
125
99,8
169
122,5
330
185,0
38
36,8
82
72,4
126
100,4
170
123,0
340
188,3
39
37,7
83
73,1
127
100,9
171
123,4
350
191,3
40
38,6
84
73,8
128
101,5
172
123,9
360
194,2
41
39,5
85
74,5
129
102,1
173
124,3
370
197,3
42
40,5
86
75,2
130
102,6
174
124,7
380
199,9
43
41,2
87
75,9
131
103,2
175
125,2
390
202,8
44
42,1
88
76,6
132
103,7
176
125,7
400
205,7
1.3. Zasadowo
ść mineralna (Z
m
) i zasadowość ogólna (Z
og
)
Zasadowo
ść jest to zdolność wody do zobojętniania mocnych kwasów mineralnych wobec
umownych wska
źników.
Właściwość tą nadają wodzie obecne w niej węglany, wodorowęglany i wodorotlenki oraz występujące
w mniejszych st
ężeniach krzemiany, borany, fosforany, amoniak, zasadowe związki organiczne oraz sole
hydrolizuj
ące z odczynem zasadowym.
OH
-
+ H
+
→ H
2
O
CO
3
2-
+ H
+
→ HCO
3
-
HCO
3
-
+ H
+
→ CO
2
+ H
2
O
Zasadowo
ść nie ma znaczenia z punktu widzenia sanitarnego, natomiast ma istotne znaczenie przy
ocenie wody do celów gospodarczych i przemysłowych. Rozróżnia się zasadowość mineralną i ogólną:
Zasadowo
ść mineralna jest ilościowym wskaźnikiem zawartości jonów wodorotlenkowych i
w
ęglanowych, oznaczanym przy miareczkowaniu próbki mocnym kwasem do pH = 8,3 wobec
fenoloftaleiny jako wska
źnika (lub potencjometrycznie).
Zasadowo
ść ogólna jest ilościowym wskaźnikiem zawartości jonów węglanowych,
wodorow
ęglanowych, wodorotlenkowych i innych anionów pochodzących z dysocjacji soli słabych
kwasów i mocnych zasad, oznaczanym przez miareczkowanie próbki mocnym kwasem do pH =
4,5 wobec oran
żu metylowego lub potencjometrycznie.
Wody naturalne w zale
żności od swego odczynu, mogą jednocześnie wykazywać zasadowość i
kwasowo
ść (rys.1). Dotyczy to głównie wód o wysokiej twardości węglanowej i dużym stężeniu CO
2
.
Kwasowo
ść tych wód powierzchniowych powodowana jest wyłącznie przez kwas węglowy. Kwasowość
wody do picia ma znaczenie bezpo
średnie w przypadkach kwasowości wywołanej przez kwasy mineralne
lub produkty hydrolizy soli (a taka kwasowo
ść w wodzie do picia nie jest dopuszczalna) lub znaczenie
po
średnie, gdyż zawarte w wodzie kwasy mogą rozpuszczać metale szkodliwe dla zdrowia i nadawać
wodzie cechy niepo
żądane (np. rozpuszczają rury żelazne, zbiorniki). Z tych tez powodów kwasowość nie
jest po
żądana w wodach do celów przemysłowych (powoduje korozje rur, zbiorników i innych urządzeń).
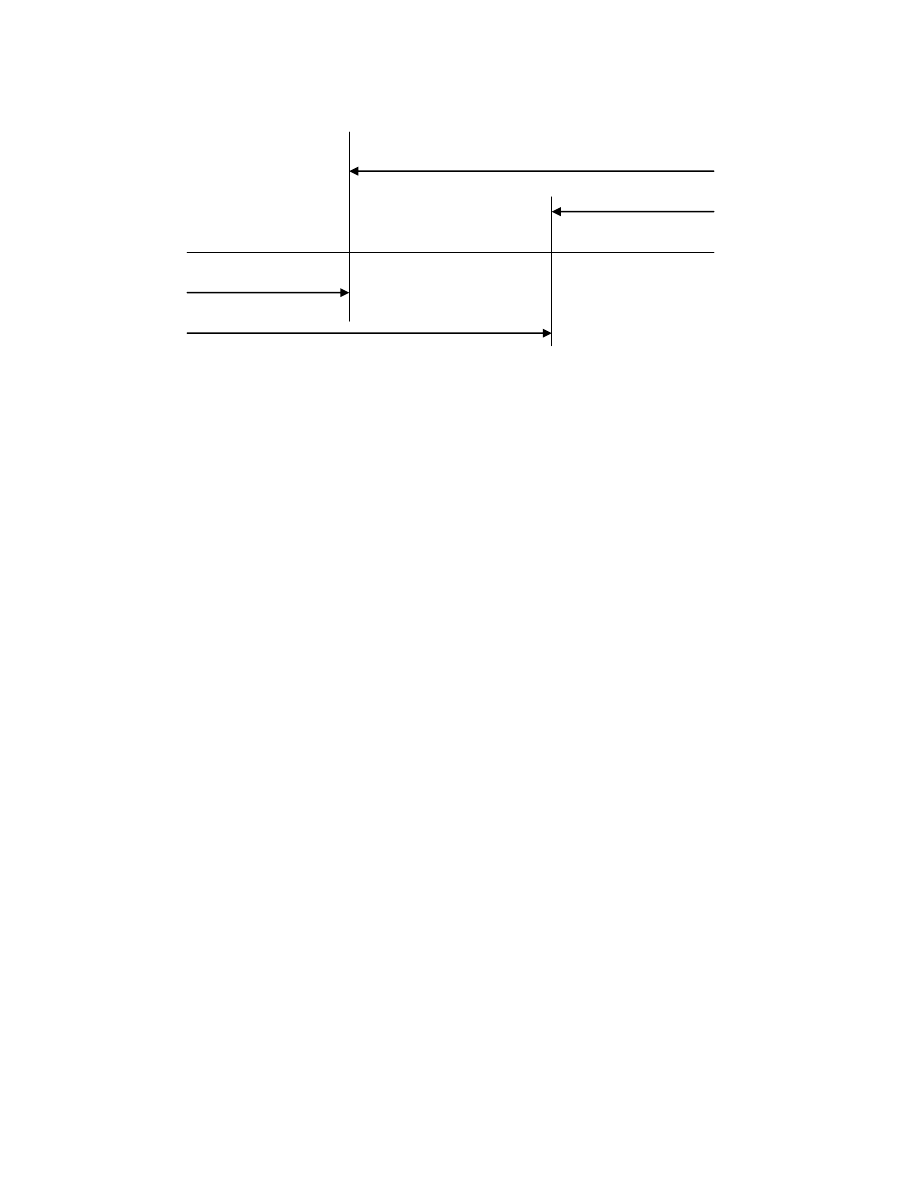
Zasadowość ogólna
Zasadowość mineralna
pH
Kwasowość mineralna
4,5
8,3
Kasowość ogólna
Rys. 1. Zakres wyst
ępowania kwasowości i zasadowości w wodach naturalnych w zależności od
pH
W zale
żności od rodzaju związków, powodujących zasadowość wody rozróżnia się:
- zasadowo
ść ogólną (Z
og
) wy
wołaną obecnością OH
-
, CO
3
2-
, HCO
3
-
- zasadowo
ść mineralną (Z
m
) wywołaną obecnością OH
-
, CO
3
2-
,
- zasadowo
ść węglanową wywołaną obecnością CO
3
2-
,
- zasadowo
ść wodorowęglanową wywołaną obecnością HCO
3
-
,
- zasadowo
ść wodorotlenową wywołaną obecnością OH
-
.
Obok wodorow
ęglanów i węglanów wapnia oraz magnezu w niektórych wodach mogą występować
w
ęglany oraz wodorowęglany sodu i potasu. W takich przypadkach zasadowość wody jest wyższa od
twardo
ści ogólnej. Występująca różnica:
Z
og
– Tw
og
= Z
alk
jest okre
ślana jako zasadowość alkaliczna.
Znaczna zasadowo
ść alkaliczna nie jest pożądana w wodach zasilających kotły parowe, gdyż
wodorow
ęglan sodu podczas odparowywania wody w kotle rozkłada się na ditlenek węgla i wodorotlenek
sodu:
Na HCO
3
→ NaOH + CO
2
Wydzielony ditlenek w
ęgla jest agresywny i powoduje korozję kotłów parowych.
METODY OZNACZANIA
Do oznaczania kwasowo
ści i zasadowości można wykorzystać metody:
- miareczkow
ą potencjometryczną
- oraz miareczkow
ą wobec wskaźników.
Za podstaw
ę oznaczania kwasowości oraz zasadowości przyjęto metodę wg.:

PN-EN ISO 9963-1: 2001. Jako
ść wody. Oznaczanie zasadowości. Oznaczanie zasadowości ogólnej
i zasadowo
ści wobec fenoloftaleiny.
PN-C-04540-03: 1990. Woda i
ścieki. Badania pH, Kwasowości i zasadowości. Oznaczanie
kwasowo
ści i zasadowości mineralnej i ogólnej metodą miareczkowania wobec wskaźników.
W oznaczaniu przeszkadzaj
ą następujące czynniki:
- barwa wy
ższa od 50 mg Pt/dm
3
,
- m
ętność wyższa od 30 mg/dm
3
,
- du
że ilości łatwo hydrolizujących soli żelaza i glinu,
- substancje utleniaj
ące (np. wolny chlor) odbarwiające wskaźnik,
- twardo
ść węglanowa powyżej 3,6 mval/dm
3
.
Wykonanie oznaczenia
Do kolby sto
żkowej o pojemności 200 – 250 cm
3
odmierzy
ć pipetą 100 cm
3
próbki lub mniejszą jej
obj
ętość rozcieńczoną wodą destylowaną do 100 cm
3
. Wykona
ć oznaczenia:
- zasadowo
ści mineralnej - miareczkując próbką badaną, po dodaniu 3 - 5 kropli fenoloftaleiny,
roztworem 0,1 M HCl do
zaniku różowego zabarwienia (odbarwienia)próbki. Objętość roztworu HCl
u
żytego do miareczkowania, oznaczyć jako (a).
UWAGA ! Je
żeli badana próbka nie zabarwi się na różowo po dodaniu roztworu fenoloftaleiny, i próbka
pozostaje bezbarwna oznacza to,
że ten rodzaj zasadowości w wodzie badanej nie występuje (Z
m
= 0).
- zasadowo
ści ogólnej - miareczkując tą samą próbkę po oznaczeniu zasadowości mineralnej oraz po
dodaniu 3-5 kropli oran
żu metylowego, roztworem 0,1 M HCl do zmiany zabarwienia z żółtego na
pomara
ńczowy. Łączną objętość 0,1 M HCl użytego do zmiareczkowania próbki wobec oranżu
metylowego i fenoloftaleiny, oznaczy
ć jako (b).
Zasadowo
ść mineralną (Z
m
) i ogólną (Z
og
) , w mval/dm
3
obliczy
ć z równań:
Z
m
= (0,1 · a · 1000)/V
Z
og
= (0,1 · b · 1000)/V
gdzie:
a
– objętość 0,1M HCl użytego do miareczkowania próbki badanej wobec fenoloftaleiny, cm
3
b
– łączna objętość 0,1 M HCl użytego do miareczkowania próbki badanej wobec wskaźników
(fenoloftaleiny i oran
żu metylowego), cm
3
V
– objętość próbki badanej, cm
3
.
Na podstawie oznacze
ń zasadowości ogólnej i mineralnej można dokonać obliczeń współistnienie jonów
OH
-
, CO
3
2-
, HCO
3
-
w wodach przy pH ≤ 9 (tabela 2).
W celu uzyskania wyników poszczególnych jonów w mg/dm
3
, nale
ży skorzystać z
nast
ępujących zależności:
1 mval OH
-
/dm
3
= 17,01 mg OH
-
/dm
3
1 mval CO
3
2-
/dm
3
= 30,0 mg CO
3
2-
/dm
3
1 mval HCO
3
-
/dm
3
= 61,02 mg HCO
3
-
/dm
3
TABELA 2. Zale
żność między rodzajem zasadowości a stężeniem jonów: wodorotlenkowych (OH
-
),
w
ęglanowych (CO
3
2-
) i wodorow
ęglanowych (HCO
3
-
), w mval/dm
3
Wyniki oznacze
ń
zasadowo
ści
Zasadowo
ść, mval/dm
3
OH
-
CO
3
2-
HCO
3
-
Z
m
= 0
0
0
Z
og
2 Z
m
< Z
og
0
2 Z
m
Z
og
– 2 Z
m
2 Z
m
= Z
og
0
2 Z
m
0
2 Z
m
> Z
og
2 Z
m
– Z
og
2 (Z
og
- Z
m
)
0
Z
m
= Z
og
Z
og
0
0
1.4. Wolny ditlenek w
ęgla (CO
2
)
Ditlenek w
ęgla występuje prawie we wszystkich wodach naturalnych. Źródłem jego występowania w
wodzie s
ą procesy geochemiczne (wody podziemne), procesy metaboliczne organizmów wodnych,
procesy rozkładu związków organicznych, powietrze atmosferyczne (wody powierzchniowe). Ilość ditlenku
w
ęgla, zależy od zawartości materii organicznej w wodzie oraz intensywności i kierunku samego procesu.
Jego formy wyst
ępowania w wodach naturalnych można przedstawić według poniższego schematu:
CO
2
ogólny
CO
2
zwi
ązany
CO
2
wolny
CO
2
w
ęglanowy
CO
2
wodorow
ęglanowy
CO
2
równowagi
CO
2
agresywny
W przypadku wód naturalnych prawie cały wolny ditlenek węgla występuje w postaci rozpuszczonego CO
2
i jedynie niespełna 1% znajduje się w postaci H
2
CO
3
. Stanowi on sum
ę ditlenku węgla równowagi i
ditlenku w
ęgla agresywnego, przy czym układ ten nie jest stabilny.
Zawarte w wodzie jony w
ęglanowe, wodorowęglanowe oraz wolny ditlenek węgla są związane między
sob
ą równaniem równowagi węglanowej:
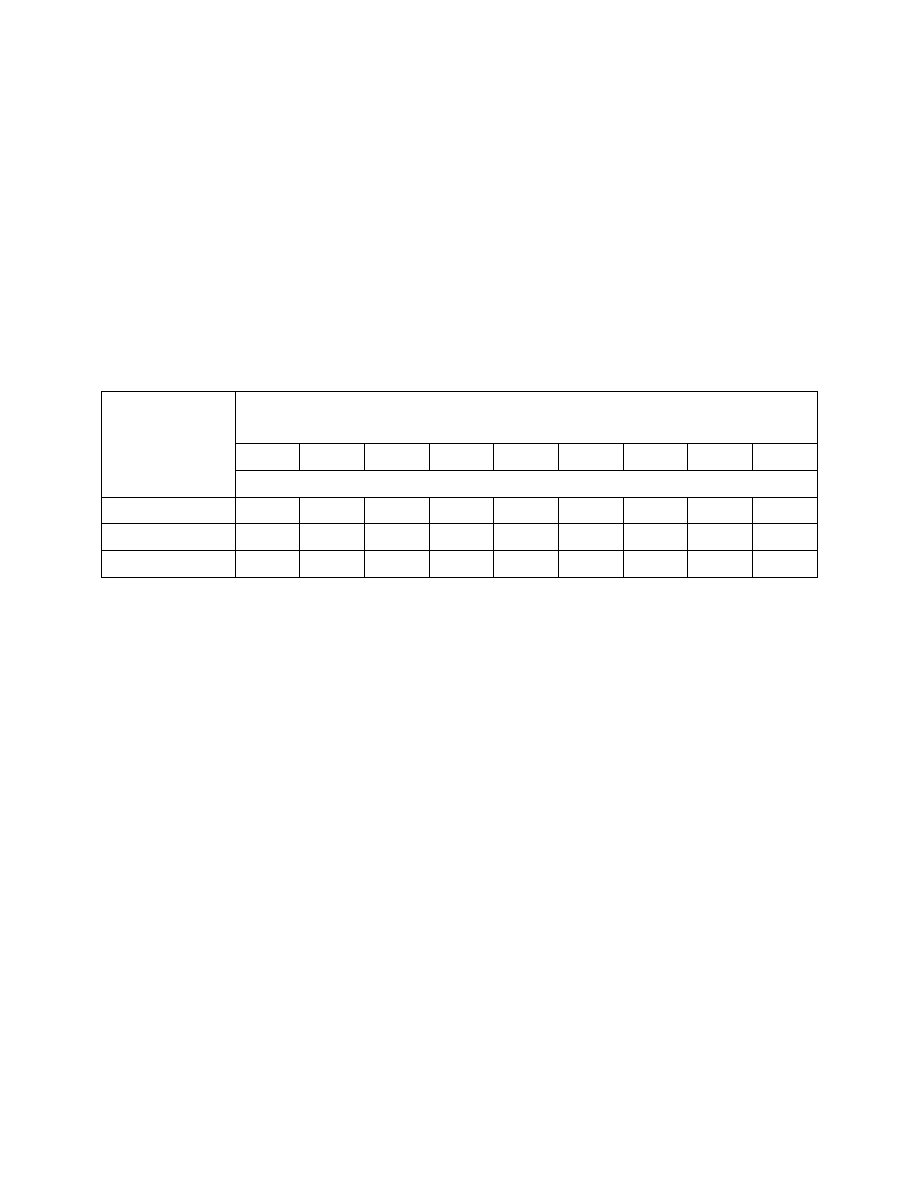
CO
2
+ H
2
O ↔ H
+
+ HCO
3
-
↔ 2H
+
+ CO
3
2-
W zale
żności od odczynu wód naturalnych, jak wynika z Tabeli 3, ditlenek węgla może występować
całkowicie w postaci gazowej (pH < 4,5), wyłącznie w postaci jonu wodorowęglanowego HCO
3
-
(pH = 8,4)
lub w
ęglanowego CO
3
2-
(pH = 12). Poniewa
ż większość naturalnych wód podziemnych ma pH w
granicach 6,5 ÷ 8,5; zatem w wodach tych ditlenek węgla występuje na ogół w całym zespole związków
kwasu w
ęglowego.
TABELA 3. Wyst
ępowanie różnych form ditlenku węgla w wodzie w zależności od pH
Posta
ć CO
2
pH wody
4,0
5,0
6,0
7,0
8,3
9,0
10,0
11,0
12,0
% zawarto
ść CO2
wolny
99,5
95,4
67,7
17,3
2,0
1,0
0,2
-
-
wodorow
ęglanowy
0,5
4,6
32,3
82,7
97,4
97,8
94,1
62,5
14,3
w
ęglanowy
-
-
-
-
0,6
1,2
5,7
37,5
85,7
METODY OZNACZANIA
Zawarto
ści wolnego ditlenku węgla można oznaczyć metodami:
- miareczkow
ą wobec fenoloftaleiny,
- miareczkowania potencjometrycznego.
Do oznaczania wolnego ditlenku w
ęgla wykorzystano metodę miareczkową wg.:PN-C-04547-01: 1974.
Woda i
ścieki. Badania zawartości dwutlenku węgla. Oznaczanie wolnego dwutlenku węgla w
wodzie.
W oznaczeniu przeszkadzaj
ą następujące czynniki:
- sole
żelaza powyżej 1 mg Fe/dm
3
,
- twardo
ść wody powyżej 3,6 mval/dm
3
,
- barwa wody wi
ększa niż 50 mgPt/dm
3
.
Oznaczanie polega na miareczkowaniu wolnego ditlenku w
ęgla (CO
2
) oraz kwasu w
ęglowego (H
2
CO
3
),
który jest słabo zdysocjowany, roztworem wodorotlenku sodu (NaOH) wobec fenoloftaleiny jako
wska
źnika do pH równego 8,3. Przebieg reakcji jest następujący:
CO
2
+ H
2
O ↔ H
2
CO
3
↔ H
+
+ HCO
3
-
H
+
+ OH
-
↔ H
2
O
HCO
3
-
+ OH
-
↔ CO
3
2-
+ H
2
O

Ditlenek w
ęgla można oznaczyć jako:
· ditlenek węgla wolny,
· ditlenek węgla węglanowy
· oraz ditlenek węgla wodorowęglanowy.
Wykonanie oznaczenia.
Do cylindra Nesslera z korkiem o pojemno
ści 100 - 200 cm3 delikatnie zlewarować 100 cm3 badanej
próbki. W przypadku występowania czynników przeszkadzających dodać 2 cm3 roztworu 30% winianu
sodowo - potasowego oraz 3 krople fenoloftaleiny jako wska
źnika. Zamknąć korkiem cylinder Nesslera i
delikatnie wymiesza
ć zawartość. Miareczkować roztworem 0,05 M NaOH do lekkiego różowego
zabarwienia utrzymuj
ącego się nie krócej niż 3 min. Po dodaniu każdej następnej porcji roztworu NaOH
cylinder Nesslera zamkn
ąć i zawartość wymieszać. Oznaczenie powtórzyć przynajmniej dwukrotnie,
zachowuj
ąc powyższą procedurę.
St
ężenie wolnego ditlenku węgla (w mgCO2/dm3), obliczyć z równania:
X = a · 2,2 · 1000/V
gdzie:
a
– objętość roztworu 0,05 M NaOH użytego do miareczkowania próbki badanej, cm
3
2,2
– współczynnik przeliczeniowy zużytego roztworu NaOH na liczbę mg CO
2
,
V
– objętość próbki badanej użytej do oznaczania, cm
3
Ćwiczenie 2
2.1. Twardość ogólna
Twardo
ść wody określa zużycie określonych ilości mydła bez wytwarzania piany. Przyczynę powstania
tego zjawiska nale
ży upatrywać w obecności jonów: wapnia, magnezu, żelaza, manganu, glinu, cynku
oraz innych kationów, które z mydłem tworzą nierozpuszczalne mydła wapniowe, magnezowe i inne.
Wap
ń i magnez – główne składniki wody powodujące jej twardość – znajdują się w środowisku wodnym
przewa
żnie w postaci: wodorowęglanów - Ca(HCO
3
)
2
, Mg(HCO
3
)
2
, siarczanów (VI) – CaSO
4
, MgSO
4
,
chlorków – CaCl
2
, MgCl
2
oraz małych ilości węglanów – CaCO
3
, MgCO
3
, natomiast rzadziej w postaci
azotanów (V) lub wodorotlenków.
Twardo
ść wody surowej (niegotowanej) nazywa się twardością ogólną. Na twardość ogólną składa się
twardo
ść przemijająca i twardość stała.
Twardo
ść przemijająca wywołana jest obecnością wodorowęglanów wapnia i magnezu - Ca(HCO
3
)
2
,
Mg(HCO
3
)
2
. Usuni
ęcie tego typu twardości następuje podczas termicznego rozkładu tych związków w
procesie gotowania, według równania:
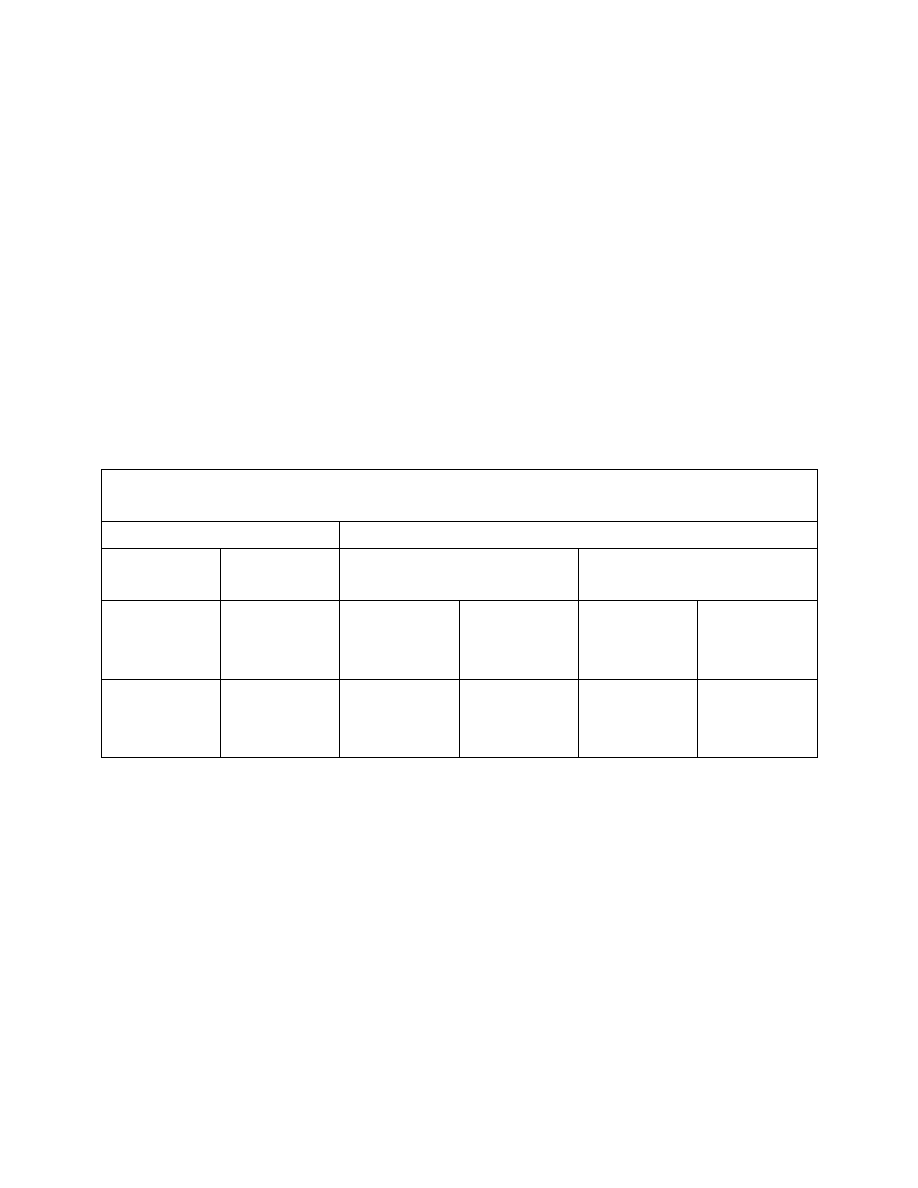
Ca(HCO
3
)
2
→ CaCO
3
+ CO
2
↑ + H
2
O
Mg(HCO
3
)
2
→ Mg(OH)
2
+ 2 CO
2
↑
Podczas ogrzewania wody rozpuszczalno
ść ditlenku węgla ulega stopniowemu obniżeniu.
Nast
ępuje jego wydzielanie do atmosfery. Prowadzi to do naruszenia równowagi węglanowo-wapniowej. Z
wody wytr
ąca się trudno rozpuszczalny CaCO
3
oraz Mg(OH)
2
. Powstałe związki są przyczyną tworzenia
si
ę kamienia kotłowego.
Twardo
ść wody pozostającą po przegotowaniu nazywa się twardością stałą. Równolegle do
podziału twardości wody na przemijającą i stałą stosuje się podział uwzględniający skład chemiczny soli
wapnia i magnezu, zgodnie z którym twardość ogólna składa się z twardości węglanowej i twardości
niew
ęglanowej.
TABELA 4. Rodzaje twardo
ści wody
Twardo
ść ogólna (T
og
)
Podział wg kationów
Podział wg anionów
Symbol
Rodzaj
twardo
ści
Twardo
ść węglanowa (T
ww
)
Twardo
ść niewęglanowa (T
wnw
)
T
wCa
wapniowa
T
wCa
Ca(HCO
3
)
2
Ca(OH)
2
CaCO
3
T
wCa
CaSO
4
CaCl
2
Ca(NO
3
)
2
T
wMg
magnezowa
T
wMg
Mg(HCO
3
)
2
Mg(OH)
2
MgCO
3
T
wMg
MgSO
4
MgCl
2
Mg(NO
3
)
2
W tabeli 4 scharakteryzowano twardo
ść ogólną wody, będącej sumą wszystkich rodzajów związków
wapnia i magnezu wyst
ępujących w środowisku wodnym, w podziale wg kationów i anionów.
Jednostka twardo
ści
Twardo
ść
wody
wyra
ża
si
ę
w
specjalnych
jednostkach
twardo
ści
–
stopniach
lub
miligramorówoważnikach, czyli milivalach tlenków wapnia i magnezu w 1 dm
3
wody. Jeden stopie
ń
twardo
ści (stopień niemiecki) odpowiada zawartości 10 mg CaO lub równoważnej ilości, tj. 7,19 mg MgO
w dm
3
wody. 1 mval CaO = 28,04 mg oraz 1 mval MgO = 20,16 mg. Twardo
ść wody można wyrażać
tak
że w stopniach francuskich, angielskich lub w ppm (parts per million). Twardość podaną w określonych
jednostkach mo
żna łatwo przeliczyć na inne (tabela 5).
Przykładowo: w celu przeliczenia twardości ogólnej z mval/dm
3
na mgCaCO
3
/dm
3
obliczony wynik
oznaczania nale
ży pomnożyć przez 50.
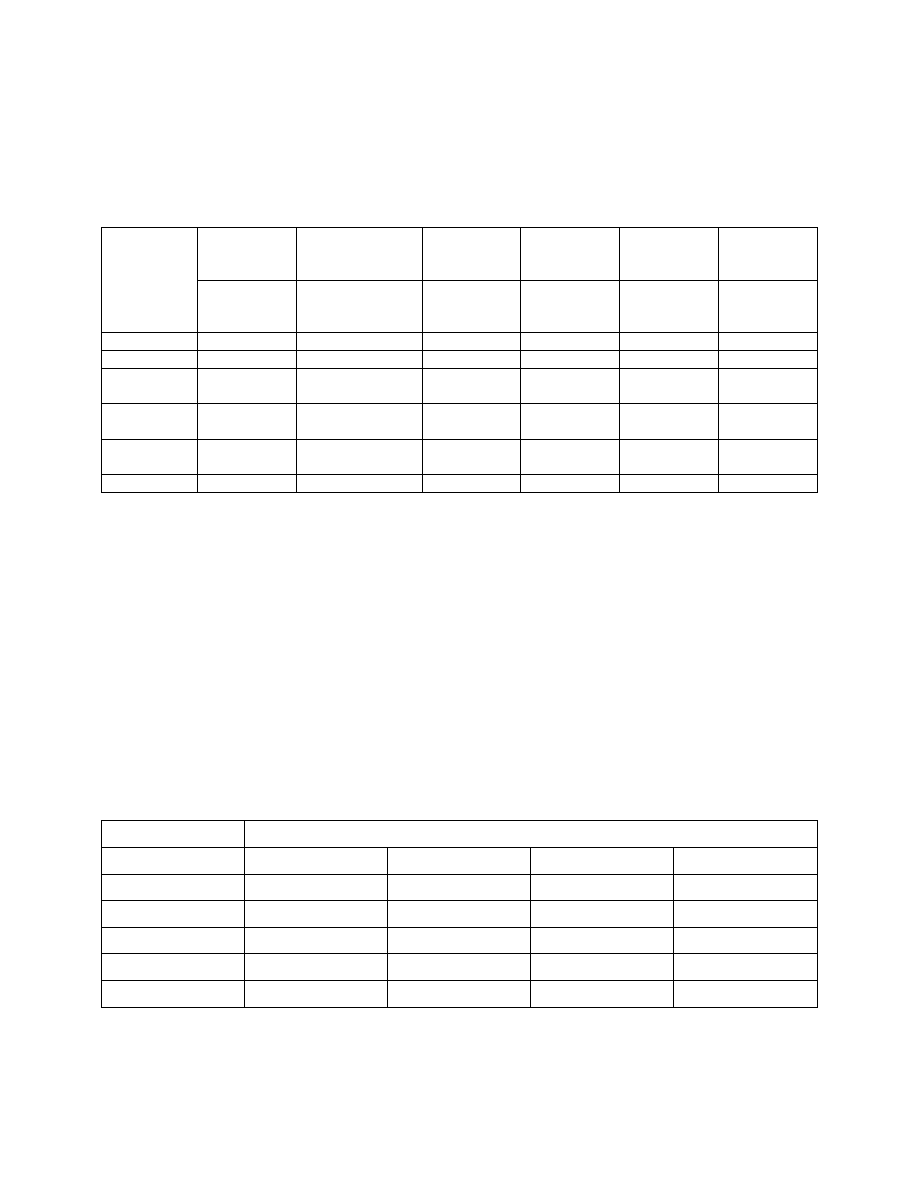
TABELA 5.
Współczynniki przeliczeniowe jednostek twardości wody
mmol/dm
3
mval/dm
3
o
n
(niemiecki)
o
Clarka
(angielski)
o
F
(francuski
ppm
100 mg
CaCO
3
/dm
3
28 mg CaO lub
50mgCaCO
3
/dm
3
10 mg
CaO/dm
3
14,3 mg
CaCO
3
/dm
3
10 mg
CaCO
3
/dm
3
1 mg
CaCO
3
/dm
3
mmol/dm
3
1
2
5,61
7,02
10
100
mval/dm
3
0,5
1
2,8
3,5
5
50
o
n
0,178
0,357
1
1,25
1,78
17,8
o
Clarka
0,143
0,286
0,8
1
1,43
14,3
o
F
0,1
0,2
0,56
0,7
1
10
ppm
0,01
0,02
0,056
0,07
0,1
1
Wody naturalne mog
ą znacznie różnić się twardością. Wody opadowe są bardzo miękkie, ich twardość
j
est bliska zeru. W wodach słodkich przeważa twardość wapniowa. Wody powierzchniowe, zwłaszcza z
potoków górskich, są na ogół miękkie. Większą twardość wykazują wody podziemne.
Obecno
ść jonów wapnia i magnezu, w wodzie do picia i do celów gospodarczo-przemysłowych ma ważne
znaczenie techniczne. Skala twardo
ści wody podana w tabeli 6 pozwala na określenie stopnia
przydatno
ści wody. Z gospodarczego punktu widzenia wody twarde są niepożądane ze względu na duże
zu
życie mydła, łatwość tworzenia się osadów, itp. Wody miękkie, o niskiej zawartości jonów Ca i Mg,
stwarzaj
ą korzystne warunki rozwoju procesu korozji w przewodach wodociągowych, podczas gdy wody o
nadmiernej twardo
ści wytrącają osady, powodując stopniowe zmniejszanie przepustowości przewodów.
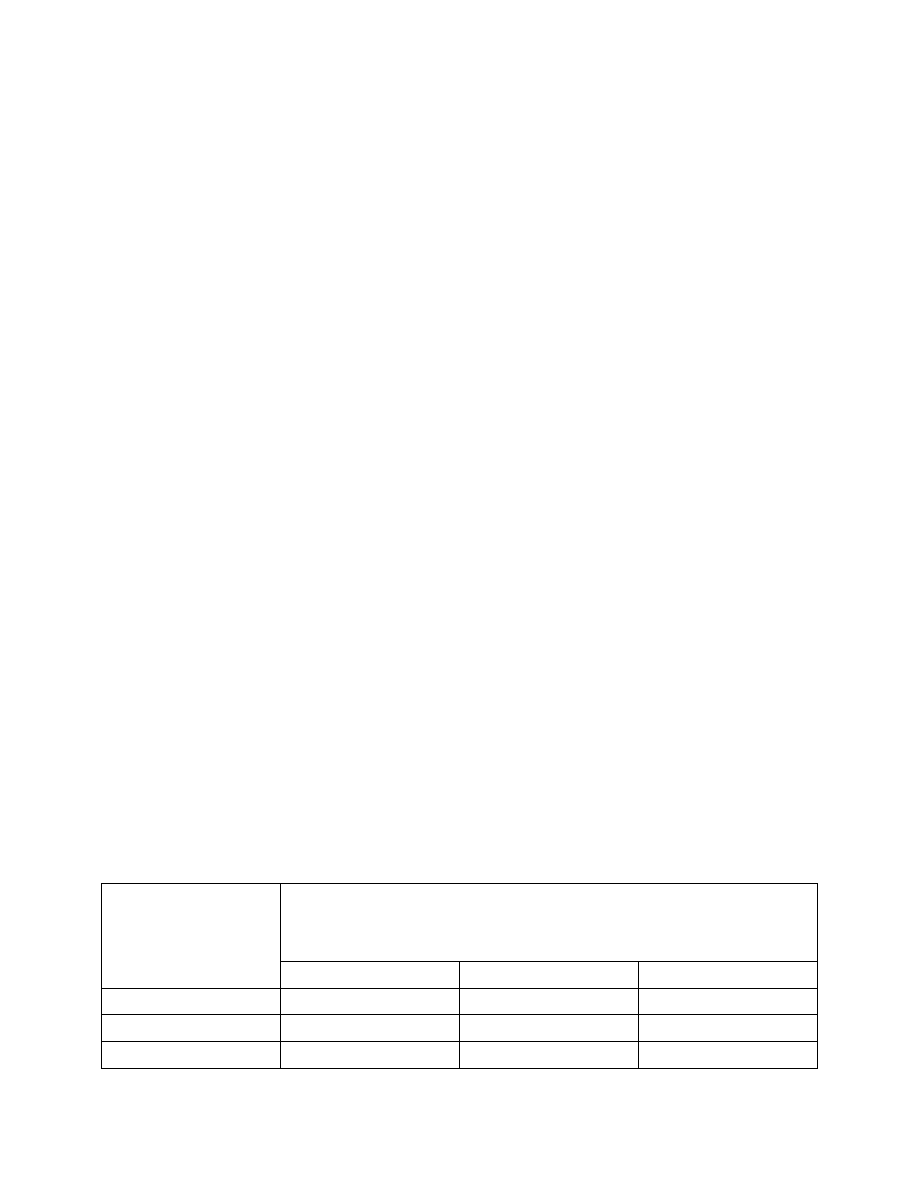
TABELA 6. Skala twardo
ści wody
Skala opisowa
Twardo
ść wody
Woda
mgCaCO
3
/dm
3
mmol/dm
3
mval/dm
3
o
n
Bardzo mi
ękka
0,0 ÷ 85,0
0,0 ÷ 0,89
0,0 ÷ 1,78
0,0 ÷ 5,0
Mi
ękka
85,0 ÷ 170,0
0,89 ÷ 1,78
1,78 ÷ 3,57
5,0 ÷ 10,0
Średnio twarda
170,0 ÷ 430,0
1,78 ÷ 3,57
3,57 ÷ 7,13
10,0 ÷ 20,0
Twarda
340,0 ÷ 510,0
3,57 ÷ 5,35
7,13 ÷ 10,7
20,0 ÷ 30,0
Bardzo twarda
> 510,0
> 5,35
> 10,7
> 30,0
W wodach zanieczyszczonych
ściekami przemysłowymi o odczynie zasadowym (pH powyżej 8,3) mogą
wyst
ępować również wodorowęglany potasu – KHCO
3
, sodu
– NaHCO
3
oraz w
ęglany potasu – K
2
CO
3
i

sodu
– Na
2
CO
3
. Sole te ulegaj
ą hydrolizie z wytworzeniem jonów wodorotlenowych – OH
-
. W takich
przypadkach woda ma zasadowo
ść większą od twardości ogólnej.
Do obliczenia twardo
ści węglanowej (T
ww
) i nieweglanowej (T
wnw
) mo
żna wykorzystać wyniki oznaczenia
twardo
ści ogólnej i zasadowości ogólnej (tabela 7).
TABELA 7.
Współzależność między twardością ogólną a zasadowością wody
Warunek
Zaistniałe współzależności
T
wog
> Z
og
T
wog
– Z
og
= T
wnw
T
ww
= Z
og
T
wog
< Z
og
Z
og
– T
wog
= Z
alk
T
wog
= T
ww
T
wog
= Z
og
T
wnw
= 0
Z
alk
= 0
T
wog
= T
ww
METODY OZNACZANIA
St
ężenie twardości ogólnej (T
wog
), w tym wapniowej (T
wCa
) i magnezowej (T
wM
g) mo
żna wyznaczyć
metodami:
- miareczkow
ą kompleksometryczną - typu: wersenianową (EDTA)
- absorpcji spektrometrii atomowej (ASA)
- lub chromatrograficzn
ą (ICP).
Twardo
ść ogólną wykonano wg.: PN-ISO 6059: 1999. Jakość wody. Oznaczanie sumarycznej
zawarto
ści wapnia i magnezu. Metoda miareczkowa z EDTA
W metodzie wersenianowej oznacza si
ę łączną zawartość jonów wapnia i magnezu (T
wog
) przez
miareczkowanie próbki roztworem EDTA, przy pH około 9,0 ÷ 10,0 w obecności czerni eriochromowej T
jako wska
źnika.
Utworzony kompleks w trakcie miareczkowania czerni eriochromowej T z jonami wapnia i magnezu
wykazuje mniejsz
ą trwałość od powstałego kompleksu wersenianu disodu (EDTA) z obecnymi jonami
wapnia i magnezu. Podczas miareczkowania próbki wody, w końcowym punkcie miareczkowym obecny
wska
źnik zostaje uwolniony z uprzednio powstałych związków kompleksowych, co w efekcie prowadzi do
zmiany barwy, z czerwonej na niebiesk
ą, zgodnie z uproszczonym zapisem reakcji:
HT
2-
+ Ca
2+
→ CaT
-
+ H
+
gdzie: T
– skrócony zapis jonu czerni eriochromowej T
H
2
Y
2-
+ Ca
2+
→ CaY
2-
+ 2H
+
gdzie: H
2
Y
2-
skrócony zapis jonu wersenianu disodu (EDTA)
H
2
Y
2-
+ CaT
-
®→ CaY
2-
+ HT
2-
+ H
+

czerwony
niebieski
W oznaczeniu przeszkadzaj
ą następujące czynniki:
-
jony: cynku, glinu, kadmu, kobaltu, manganu, miedzi, niklu, ołowiu i żelaza,
- m
ętność powyżej 20 mg/dm3,
- obecno
ść wodorowęglanów i węglanów powyżej 6,0 mval/dm
3
,
- substancje organiczne.
Obj
ętość próbki powinna być tak dobrana, aby objętość roztworu EDTA zużyta do miareczkowania próbki
nie była mniejsza niż 5 cm
3
i nie wi
ększa niż 25 cm
3
(tabela 8).
TABELA 8. Orientacyjne obj
ętości próbek w zależności od stopnia twardości wody
Twardo
ść ogólna badanej próbki,
mval/dm
3
Obj
ętość próbki, jaką należy
pobra
ć do oznaczania, cm
3
0,357 ÷ 2,0
2,0 ÷ 20,0
> 20,0
250
50
25
UWAGA ! W przypadku stwierdzenia obecno
ści czynników przeszkadzających należy zastosować
poni
ższą procedurę:
-
do odmierzonej próbki wody (w razie potrzeby przesączonej, jeżeli woda jest mętna) dodać taką
ilo
ść 0,1M HCl, jaką zużyto do oznaczania ogólnej zasadowości wody (równoważną w stosunku
do obj
ętości próbki), oraz 0,5 cm
3
nadmiaru tego kwasu, je
żeli stwierdzono uprzednio obecność
wodorow
ęglanów i węglanów wynoszącą powyżej 6 mval/dm
3
. Nast
ępnie ogrzać próbkę do
wrzenia i utrzymywa
ć w tym stanie 1 minutę. Ostudzić zawartość kolby stożkowej do temperatury
pokojowej. W
tak przygotowanej próbce oznaczyć twardość ogólną niżej opisaną metodą,
-
obecno
ść jonów: cynku, glinu, kadmu, kobaltu, manganu, miedzi, niklu, ołowiu i żelaza maskuje
si
ę w trakcie oznaczania przez dodanie 1 cm
3
roztworu 1% chlorowodorku hydroksyloaminy i 0,1
cm
3
roztworu 5% siarczku sodu.
Wykonanie oznaczenia:
Do kolby sto
żkowej o pojemności 200 – 250 cm
3
odmierzy
ć pipetą próbkę wody o objętości dobranej
zgodnie z tabel
ą 5. W następującej kolejności dodać: 2 cm
3
roztworu buforowego, 1 cm
3
1% roztworu
chlorowodorku hydroksyloaminy, 0,1 cm3
5% roztworu siarczku sodu oraz około 0,05 g mieszaniny czerni
eriochromowej T na ka
żde 50 cm
3
badanej próbki. Wymieszać i miareczkować roztworem EDTA do
zmiany zabarwienia z czerwonej na niebiesk
ą (błękitną).
UWAGA ! Pod koniec miareczkowania, gdy pojawi si
ę fioletowe zabarwienie roztworu, należy dodawać
roztwór EDTA powoli kroplami, energicznie mieszając zawartość kolby stożkowej, po dodaniu każdej
kropli roztworu miareczkuj
ącego.

Twardo
ść ogólną (w mval/dm
3
), obliczy
ć z równania:
x = a×0,02×1000/V
gdzie:
a
– objętość 0,01 M roztworu EDTA użytego do miareczkowania próbki badanej, cm
3
V
– objętość próbki badanej użytej do oznaczania, cm
3
0,02
– współczynnik przeliczeniowy określający ilość wapnia i magnezu odpowiadający 1 cm
3
0,01M roztworu EDTA, mval.
2.2. Wapń
Za podstaw
ę oznaczania twardości wapniowej (T
wCa
) przyj
ęto procedury zawarte w:
- PN-ISO 6059: 1999. Jako
ść wody. Oznaczanie sumarycznej zawartości wapnia i magnezu. Metoda
miareczkowa z EDTA
- PN-C-04551-01: 1991. Woda i
ścieki. Badania zawartości wapnia. Oznaczanie wapnia (twardości
wapniowej) metod
ą wersenianową
- PN-C-04554-07: 1981. Woda i
ścieki. Badania twardości. Oznaczanie twardości wapniowej
powy
żej 0.5 mval/dm
3
metod
ą wersenianową.
W metodzie miareczkowej kompleksometrycznej stosowanym wska
źnikiem jest kalces, który reaguje tylko
z oznaczanym jonem wapnia. Obecne w
środowisku wodnym jony wapnia przy pH w zakresie 12 ÷ 13
tworz
ą z kalcesem związek kompleksowy barwy czerwonej.
Kompleks ten charakteryzuje si
ę mniejszą trwałością niż kompleks wapnia z wersenianem disodu (EDTA).
W trakcie miareczkowaniu, po zwi
ązaniu wszystkich jonów wapnia przez wersenian, wskaźnik zostaje
uwolniony i barwa roztworu ulega zmianie z czerwonej na niebiesk
ą.
W oznaczaniu przeszkadzaj
ą następujące czynniki:
- jony:
żelaza, glinu, manganu, miedzi, kobaltu, kadmu, ołowiu i niklu,
- obecno
ść ortofosforanów oraz zasadowość większa niż 6,0 mval/dm
3
.
Wykonanie oznaczenia:
Do kolby sto
żkowej o pojemności 200 – 250 cm
3
odmierzy
ć pipetą 50 cm
3
badanej wody lub mniejsz
ą jej
obj
ętość rozcieńczoną wodą destylowaną do 50 cm
3
tak, aby próbka zawierała 5,0 do 10,0 mg Ca. W
nast
ępującej kolejności dodać: 3 cm3 24% KOH (roztwór alkalizujący) oraz 0,2 g kalcesu. Po dodaniu
powy
ższych odczynników próbkę wymieszać i miareczkować roztworem EDTA do zmiany zabarwienia z
czerwonej na niebiesk
ą.
W przypadku wyst
ępowania czynników przeszkadzających, należy je usunąć stosując metodykę
omówioną przy oznaczaniu twardości ogólnej.
St
ężenie wapnia (w mgCa/dm
3
), obliczy
ć z równania:

x = a × 0,4008×1000/V
gdzie:
a
– objętość 0,01 M roztworu EDTA użytego do miareczkowania próbki badanej, cm
3
V
– objętość próbki badanej, cm
3
0,4008
– współczynnik przeliczeniowy określający ilość wapnia, odpowiadający 1 cm
3
0,01M
roztworu EDTA, mg.
Twardo
ść wapniową (w mg CaCO
3
/dm
3
), obliczy
ć z równania:
X
1
= X × 2,5
gdzie:
X
– zawartość wapnia w badanej próbce, mgCa/dm
3
2,5
– współczynnik przeliczeniowy Ca na CaCO
3
2.3. Magnez
Twardo
ść magnezową (T
wMg
) oraz jego st
ężenie można określić na podstawie różnicy pomiędzy
oznaczon
ą twardością ogólną (T
wog
) i twardo
ścią wapniową (T
wCa
) wykorzystuj
ąc metod zawartych w:
- PN-C-04554-4:1999. Woda i
ścieki. Badania twardości. Oznaczanie sumarycznej zawartości
wapnia i magnezu w
ściekach metodą miareczkową z EDTA oraz obliczanie zawartości magnezu w
wodzie i
ściekach.
- PN-C-04562-01: 1975. Woda i
ścieki. Badanie zawartości magnezu. Oznaczanie magnezu metodą
wersenianow
ą.
- PN
–C–04554-10: 1971. Woda i ścieki. Badanie twardości. Obliczanie twardości magnezowej.
T
wMg
= T
wog
- T
wCa
(mval/dm
3
)
W celu podania zawarto
ści magnezu (w mgMg/dm
3
) w badanej próbce należy skorzystać z poniższego
wzoru:
X = (T
wog
– T
wca
) × 12,16
gdzie:
T
wog
– twardość ogólna próbki wody, mval/dm
3
T
wCa
– twardość wapniowa próbki wody, mval/dm
3
12,16
– miligramorównoważnik magnezu, mg
2.4. Kwasowość i zasadowość
Kwasowo
ść definiuje się jako zdolność wody do zobojętniania dodawanych do niej
mocnych zasad mineralnych lub w
ęglanów wobec umownych wskaźników.
Kwasowo
ść wód naturalnych może być spowodowana obecnością:

- wolnego (rozpuszczonego) ditlenku w
ęgla (pochodzącego z rozkładu kwasu węglowego),
-
słabych oraz mocnych kwasów mineralnych,
-
słabych kwasów organicznych (np. kwasów humusowych),
-
produktów hydrolizy soli mocnych kwasów i słabych zasad (np. soli żelaza lub glinu).
Kwasowo
ść wody jest właściwością, która może występować jednocześnie z zasadowością. Ma to
miejsce w wodach o wysokiej twardo
ści i dużej zawartości ditlenku węgla.
Rozróżnia się kwasowość mineralna i ogólną:
-
Kwasowo
ść mineralna jest to ilościowy wskaźnik zawartości mocnych kwasów, oznaczany
przez miareczkowanie próbki mocną zasadą do pH = 4,5 wobec oranżu metylowego lub
potencjometrycznie
-
Kwasowo
ść ogólna jest ilościowym wskaźnikiem zawartości mocnych kwasów i soli mocnych
kwasów i słabych zasad, oznaczanym przez miareczkowanie próbki mocną zasadą do pH = 8,3
wobec fenoloftaleiny lub potencjometrycznie.
Podczas miareczkowania roztworem zasady zachodz
ą poniższe reakcje:
H
+
+ OH
-
→ H
2
O
CO
2
+ OH
-
→HCO
3
-
HCO
3
-
+ OH
-
→ CO
3
2-
+ H
2
O
Zasadowo
ść jest to zdolność wody do zobojętniania mocnych kwasów mineralnych wobec
umownych wska
źników.
Właściwość te nadają obecne w niej węglany, wodorowęglany i wodorotlenki oraz występujące w
mniejszych st
ężeniach krzemiany, borany, fosforany, amoniak, zasadowe związki organiczne oraz sole
hydrolizuj
ące z odczynem zasadowym.
OH
-
+ H
+
→ H
2
O
CO
3
2-
+ H
+
→ HCO
3
-
HCO
3
-
+ H
+
→ CO
2
+ H
2
O
Zasadowo
ść nie ma znaczenia z punktu widzenia sanitarnego, natomiast ma istotne znaczenie przy
oce
nie wody do celów gospodarczych i przemysłowych. Rozróżnia się zasadowość mineralną i ogólną:
- Zasadowo
ść mineralna jest ilościowym wskaźnikiem zawartości jonów wodorotlenkowych i
w
ęglanowych, oznaczanym przy miareczkowaniu próbki mocnym kwasem do pH = 8,3 wobec
fenoloftaleiny jako wska
źnika lub potencjometrycznie
-
Zasadowo
ść
ogólna
jest
ilo
ściowym
wska
źnikiem
zawarto
ści
jonów
węglanowych,
wodorow
ęglanowych, wodorotlenkowych i innych anionów pochodzących z dysocjacji soli słabych
kwasów i mocnych zasad, oznaczanym przez miareczkowanie próbki mocnym kwasem do pH = 4,5
wobec oran
żu metylowego lub potencjometrycznie.
Wody naturalne w zale
żności od swego odczynu, mogą jednocześnie wykazywać zasadowość i
kwasowo
ść (rys.1). Dotyczy to głównie wód o wysokiej twardości węglanowej i dużym stężeniu CO
2
.
Kwasowo
ść wód powierzchniowych powodowana jest wyłącznie przez kwas węglowy. Kwasowość wody

do picia ma znaczenie bezpo
średnie w przypadkach kwasowości wywołanej przez kwasy mineralne lub
produkty hydrolizy soli (a taka kwasowo
ść w wodzie do picia nie jest dopuszczalna) lub znaczenie
po
średnie, gdyż zawarte w wodzie kwasy mogą rozpuszczać metale szkodliwe dla zdrowia i nadawać
wodzie cechy niepo
żądane (np. rozpuszczają rury żelazne, zbiorniki). Z tych tez powodów kwasowość nie
jest po
żądana w wodach do celów przemysłowych (powoduje korozje rur, zbiorników i innych urządzeń).
Rys. 1. Zakres wyst
ępowania kwasowości i zasadowości w wodach naturalnych w zależności od
pH
W zale
żności od rodzaju związków, powodujących zasadowość wody rozróżnia się:
-
zasadowo
ść ogólną (Z
og
) wywołaną obecnością OH
-
, CO
3
2-
, HCO
3
-
,
-
zasadowo
ść mineralną (Z
m
) wywołaną obecnością OH
-
, CO
3
2-
,
-
zasadowo
ść węglanową Z
CO3
wywołaną obecnością CO
3
2-
,
-
zasadowo
ść wodorowęglanową Z
HCO3
wywołaną obecnością HCO
3
-
,
-
zasadowo
ść wodorotlenową ( Z
OH-
) wywołaną obecnością OH
-
.
Obok wodorow
ęglanów i węglanów wapnia oraz magnezu w niektórych wodach mogą występować
w
ęglany oraz wodorowęglany sodu i potasu. W takich przypadkach zasadowość wody jest wyższa od
twardo
ści ogólnej. Występująca różnica:
Z
og
– Tw
og
= Z
alk
jest okre
ślana jako zasadowość alkaliczna.
Znaczna zasadowo
ść alkaliczna nie jest pożądana w wodach zasilających kotły parowe, gdyż
wodorow
ęglan sodu podczas odparowywania wody w kotle rozkłada się na ditlenek węgla i wodorotlenek
sodu:
Na HCO
3
→ NaOH + CO
2
Wydzielony ditlenek w
ęgla jest agresywny i powoduje korozję kotłów parowych.
METODY OZNACZANIA
Do oznaczania kwasowo
ści i zasadowości można wykorzystać metody:
- miareczkow
ą potencjometryczną
- oraz miareczkow
ą wobec wskaźników.
Za podstaw
ę oznaczania kwasowości oraz zasadowości przyjęto metodę wg.:
PN-EN ISO 9963-1: 2001. Jako
ść wody. Oznaczanie zasadowości. Oznaczanie zasadowości ogólnej
i zasadowo
ści wobec fenoloftaleiny.
PN-C-04540-03: 1990. Woda i
ścieki. Badania pH, Kwasowości i zasadowości. Oznaczanie
kwasowo
ści i zasadowości mineralnej i ogólnej metodą miareczkowania wobec wskaźników.
W oznaczaniu przeszkadzaj
ą następujące czynniki:

- barwa wy
ższa od 50 mg Pt/dm
3
,
- m
ętność wyższa od 30 mg/dm
3
,
- du
że ilości łatwo hydrolizujących soli żelaza i glinu,
- substancje utleniaj
ące (np. wolny chlor) odbarwiające wskaźnik,
- twardo
ść węglanowa powyżej 3,6 mval/dm
3
.
Kwasowo
ść mineralna (K
wm
) i kwasowo
ść ogólna (K
wog
)
Do kolby sto
żkowej o pojemności 200 – 250 cm
3
odmierzy
ć pipetą 100 cm
3
próbki lub mniejszą jej
obj
ętość rozcieńczoną wodą destylowaną do 100 cm
3
. Wykona
ć oznaczenie:
- kwasowo
ści mineralnej - miareczkując próbką badaną w obecności 3 - 5 kropli oranżu metylowego,
roztworem 0,05 M NaOH do zmiany zabarwienia z
czerwonoróżowego na pomarańczowożółtą.
Obj
ętość roztworu NaOH użytego do miareczkowania oznaczyć jako (a).
UWAGA ! Je
żeli badana próbka nie zabarwi się na czerwono-różowo po dodaniu roztworu oranżu
metylowego, oznacza to,
że ten rodzaj kwasowości w wodzie badanej nie występuje (K
m
= 0).
- kwasowo
ści ogólnej - miareczkując tę samą próbkę po oznaczeniu kwasowości mineralnej oraz po
dodaniu 3 - 5 kropli fenoloftaleiny, roztworem 0,05 M NaOH do wyra
źnego różowego (lub zbliżonego)
zabarwienia utrzymuj
ącego się przez 3 min.
Łączną objętość 0,05 M NaOH użytego do zmiareczkowania próbki wobec oranżu metylowego i
fenoloftaleiny, oznaczy
ć jako (b).
Kwasowo
ść mineralną (K
wm
) i ogólną (K
wog
), w mval/dm
3
obliczy
ć z równań:
K
wm
= 0,05 ×a × 1000/V
K
wog
= 0,0
5 × b × 1000/V
gdzie:
a
– objętość 0,05 M NaOH użytego do miareczkowania próbki badanej wobec fenoloftaleiny, cm
3
b
– łączna objętość 0,05 M NaOH użytego do miareczkowania próbki badanej wobec wskaźników
(fenoloftaleiny i oran
żu metylowego), cm
3
V
– objętość próbki badanej użytej do oznaczania, cm
3
.
Zasadowo
ść mineralna (Z
m
) i zasadowo
ść ogólna (Z
og
)
Do kolby sto
żkowej o pojemności 200 – 250 cm
3
odmierzy
ć pipetą 100 cm
3
próbki lub mniejszą jej
obj
ętość rozcieńczoną wodą destylowaną do 100 cm
3
. Wykona
ć oznaczenia:
- zasadowo
ści mineralnej - miareczkując próbką badaną, po dodaniu 3 - 5 kropli fenoloftaleiny,
roztworem 0,1 M HCl do
zaniku różowego zabarwienia (odbarwienia)próbki. Objętość roztworu HCl
u
żytego do miareczkowania, oznaczyć jako (a).
UWAGA ! Je
żeli badana próbka nie zabarwi się na różowo po dodaniu roztworu fenoloftaleiny, i próbka
pozostaje bezbarwna oznacza to,
że ten rodzaj zasadowości w wodzie badanej nie występuje (Z
m
= 0).
- zasadowo
ści ogólnej - miareczkując tą samą próbkę po oznaczeniu zasadowości mineralnej oraz po
dodaniu 3-5 kropli oran
żu metylowego, roztworem 0,1 M HCl do zmiany zabarwienia z żółtego na
pomara
ńczowy. Łączną objętość 0,1 M HCl użytego do zmiareczkowania próbki wobec oranżu
metylowego i fenoloftaleiny, oznaczy
ć jako (b).
Zasadowo
ść mineralną (Z
m
) i ogólną (Z
og
) , w mval/dm
3
obliczy
ć z równań:
Z
m
= (0,1 · a · 1000)/V
Z
og
= (0,1 · b · 1000)/V
gdzie:
a
– objętość 0,1M HCl użytego do miareczkowania próbki badanej wobec fenoloftaleiny, cm
3
b
– łączna objętość 0,1 M HCl użytego do miareczkowania próbki badanej wobec wskaźników
(fenoloftaleiny i oran
żu metylowego), cm
3
V
– objętość próbki badanej, cm
3
.
Na podstawie oznacze
ń zasadowości ogólnej i mineralnej można dokonać obliczeń współistnienie jonów
OH
-
, CO
3
2-
, HCO
3
-
w wod
ach przy pH ≤ 9 (tabela 2).
W celu uzyskania wyników poszczególnych jonów w mg/dm
3
, nale
ży skorzystać z
nast
ępujących zależności:
1 mval OH
-
/dm
3
= 17,01 mg OH
-
/dm
3
1 mval CO
3
2-
/dm
3
= 30,0 mg CO
3
2-
/dm
3
1 mval HCO
3
-
/dm
3
= 61,02 mg HCO
3
-
/dm
3
TABELA 2. Zale
żność między rodzajem zasadowości a stężeniem jonów: wodorotlenkowych (OH
-
),
w
ęglanowych (CO
3
2-
) i wodorow
ęglanowych (HCO
3
-
), w mval/dm
3
Wyniki oznacze
ń
zasadowo
ści
Zasadowo
ść, mval/dm
3
OH
-
CO
3
2-
HCO
3
-
Z
m
= 0
0
0
Z
og
2 Z
m
< Z
og
0
2 Z
m
Z
og
– 2 Z
m
2 Z
m
= Z
og
0
2 Z
m
0

2 Z
m
> Z
og
2 Z
m
– Z
og
2 (Z
og
- Z
m
)
0
Z
m
= Z
og
Z
og
0
0
Ćwiczenie 3
Chlorki i siarczany
3.1. Chlorki
Dobra rozpuszczalno
ść chlorków oraz ich powszechne występowanie w skorupie ziemskiej, w postaci
naturalnych złóż soli (NaCl, MgCl
2
) powoduje,
że jon chlorkowy znajduje się we wszystkich w wodach
naturalnych. Chlorki zawarte w wodzie mog
ą pochodzić z gruntu, z naturalnych pokładów soli oraz z
zanieczyszcze
ń ściekami lub różnymi odpadami pochodzenia zwierzęcego.
METODY OZNACZANIA
Do oznaczania st
ężenia jonów chlorków można wykorzystać metody:
- argentometryczn
ą miareczkową (metoda Mohra) w środowisku obojętnym lub lekko
alkalicznym,
- merkurymetryczn
ą miareczkową z azotanem rtęci,
- potencjometryczn
ą z użyciem elektrody jonoselektywnej.
Za podstaw
ę oznaczania jonów chlorkowych przyjęto metodę Mohra wg.: PN-ISO 9297: 1994. Jakość
wody. Oznaczanie chlorków. Metoda miareczkowa azotanem srebra w obecności chromianu jako
wska
źnika (metoda Mohra).
W oznaczaniu przeszkadzaj
ą następujące substancje:
tworz
ące nierozpuszczalne związki srebra: bromki, jodki, siarczki, cyjanki, sześciocyjanożelaziany
(II) i sze
ściocyjanożelaziany (III),
jony amonowe i tiosiarczanowe tworz
ące kompleksy z jonami srebra,
zwi
ązki redukujące jony chromianowe, w tym jony żelaza (II) i jony siarczynowe,
obecno
ść wysokiej barwy i mętności, mogą utrudniać obserwacje punktu końcowego
miareczkowania.
Zasada oznaczania, polega na miareczkowaniu jonów chlorkowych w badanej próbce azotanem srebra
(AgNO
3
) w
środowisku obojętnym lub słabo alkalicznym (pH = 6,5 ÷ 10,0), wobec chromianu potasu
(K
2
CrO
4
) jako wska
źnika. W pierwszym etapie miareczkowania wszystkie obecne w wodzie jony
chlorkowe zostaj
ą związane w postać trudno rozpuszczalnego chlorku srebra, zgodnie z poniższą reakcją:
Ag
+
+ Cl
-
→ AgCl ↓ trudno rozpuszczalny, biały osad

Po całkowitym wytrąceniu jonów chlorkowych (AgCl), wprowadzenie niewielkiego nadmiaru azotanu (V)
srebra w obecno
ści chromianu potasu, jako wskaźnika powoduje utworzenie jasno czerwonobrązowego
zabarwienia:
2Ag
+
+ CrO
4
2-
→ Ag
2
CrO
4
↓ trudno rozpuszczalny, czerwonobrunatny osad
Wykonanie oznaczenia.
Do kolby sto
żkowej o pojemności 250–300 cm
3
odmierzy
ć pipetą 100 cm
3
próbki lub mniejszą jej objętość
rozcie
ńczoną wodą destylowaną do 100 cm
3
, doda
ć 1 cm
3
10% roztworu K
2
CrO
4
jako wska
źnika.
Oznaczanie wykona
ć w zakresie pH = 6,5 ÷ 10,0. Miareczkować próbkę dodając kroplami 0,02 M roztwór
AgNO
3
a
ż do uzyskania zmiany zabarwienia, z żółtego (mlecznożółtego) na żółtobrunatne. Równolegle
przygotowa
ć próbkę kontrolną, sporządzoną ze 100 cm
3
wody destylowanej i 1 cm
3
10% K
2
CrO
4
.
Post
ępować w sposób analogiczny jak w przypadku próbki badanej. Objętość roztworu AgNO
3
zu
żytego
do zmiareczkowania próbki kontrolnej nie powinna przekraczać 0,2 ÷ 0,3 cm
3
. St
ężenie jonów chlorków
(w mgCl
-
/dm
3
), obliczy
ć z równania:
X = f × c × (a - b)/V
gdzie:
a
– objętość roztworu mianowanego AgNO
3
u
żytego do miareczkowania badanej próbki, cm
3
b - obj
ętość roztworu mianowanego AgNO
3
u
żytego do miareczkowania próbki kontrolnej, cm
3
f
– współczynnik przeliczeniowy (f = 35 453 mg/mol)
c
– rzeczywiste stężenie roztworu AgNO
3
, mol/dm
3
V
– objętość próbki badanej użytej do oznaczenia, cm
3
UWAGA!
W przypadku gdy odczyn próbki wykracza poza pożądany zakres, należy go skorygować,
stosuj
ąc 1 M H
2
SO
4
lub 1 M NaOH.
Je
śli objętość roztworu AgNO
3
zu
żytego do zmiareczkowania badanej próbki przekroczy 25 cm
3
, nale
ży
powtórzyć oznaczanie, odpowiednio rozcieńczając analizowaną próbkę.
3.2. Siarczany (VI)
Siarczany (VI) s
ą oprócz chlorków najbardziej rozpowszechnione w wodach naturalnych. Dostają
si
ę one, wskutek wymywania skał osadowych, w skład których wchodzi gips CaSO
4
× 2 H
2
O,
wyługowania z gleby, a także podczas utleniania siarczków i siarki pochodzących z rozkładu białka
ro
ślinnego lub zwierzęcego. W wodach powierzchniowych mogą pochodzić dodatkowo z zanieczyszczeń
ściekami przemysłowymi. Ponadto źródłem siarczanów (VI) mogą być wody kopalniane, w których jony te
mog
ą występować w dużych ilościach.

Obecno
ść siarczanu (VI) wapnia w wodach do celów przemysłowych jest niepożądana, zwłaszcza
w wodach do zasilania kotłów parowych, gdyż gips powoduje powstawanie twardego kamienia kotłowego.
Oznaczanie polega na str
ącaniu siarczanów (VI) z roztworu zakwaszonego kwasem solnym (HCl) za
pomoc
ą chlorku baru (BaCl
2
) w postaci trudno opadaj
ącej zawiesiny siarczanu (VI) baru – BaSO
4
.
SO
4
2-
+ Ba
+2
→ BaSO
4
↓
Powstałe zmętnienie, które jest proporcjonalne do zawartości siarczanów (VI) w roztworze,
okre
śla się za pomocą fotometrycznego pomiaru zmętnienia próbki. W oznaczeniu przeszkadzają
zawiesiny i silne zabarwienia, które usuwa się przez przesączenie próbki.
METODY OZNACZANIA
Do oznaczania siarczanów (VI) w wodzie, obecnie stosuje się metody:
- wagow
ą (dla stężeń > 10 mg SO
4
2-
/dm
3
),
- miareczkow
ą (dla stężeń > 2 mg SO
4
2-
/dm
3
),
- nefelometryczn
ą (dla stężeń < 2 mg SO
4
2-
/dm
3
),
- jonitowo- miareczkow
ą.
Wymienione metody służą do oznaczania siarczanów (VI) rozpuszczonych. W przypadku oznaczania
siarczanów wykorzystano procedurę w oparciu o metodykę zgodną z:
-
PN-C-04519:1
982. Analiza chemiczna. Oznaczanie małych zawartości siarczanów w
bezbarwnych roztworach metod
ą turbidymetryczną
-
PN-C-04566-10: 1979. Wody i
ścieki. Badanie zawartości siarki i jej związków. Oznaczanie
siarczanów metodą turbidemetryczną
Wykonanie oznaczenia
Do zlewki odmierzy
ć 40 cm
3
próbki badanej, aby zawartość w niej siarczanów (VI) wynosiła od 0,1 do 0,5
mg. Doda
ć 10 cm
3
odczynnika stabilizuj
ącego. Mieszając za pomocą mieszadła elektromagnetycznego z
umiarkowan
ą stałą prędkością, dodać do zlewki 5 cm
3
roztworu 5% BaCl
2
, zawarto
ść zlewki mieszać
jeszcze przez 30 s. Po 15 minutach wykona
ć pomiar absorbancji (długość fali 420 nm), stosując jako
odno
śnik próbkę kontrolną., którą przygotować tak jak próbkę badaną, z tym, że zamiast 5 cm
3
roztworu
5% BaCl2 nale
ży dodać 5 cm
3
wody destylowanej.
St
ężenie siarczanów (VI) w mg SO
4
2-
/dm3, obliczy
ć z równania:
x = a ×1000/V
gdzie:
a
– wartość jonów siarczanowych w badanej próbce, odczytana ze skali wzorców lub z krzywej
wzorcowej, mg
V
– objętość próbki badanej użyta do oznaczania, cm
3
.

UWAGA! W przypadku stwierdzenia st
ężenia siarczanów powyżej 0,5 mg SO
4
2-
/dm
3
próbkę badaną
odpowiednio rozcie
ńczyć wodą destylowaną lub poddać zagęszczeniu (jeśli stężenie siarczanów będzie
<0,1 mg/dm
3
) przez odparowanie na łaźni wodnej. Badaną próbkę doprowadzić do objętości 40 cm
3
.
Ćwiczenie 4
Utlenialność
Utlenialno
ść wody jest to umowny wskaźnik określający zdolność wody do pobierania tlenu z
manganianu (VII) potasu
– KMnO
4
w roztworze kwa
śnym lub alkalicznym, spowodowaną obecnością w
niej substancji o właściwościach redukujących, głównie organicznych, które zostają utlenione. Oznaczenie
polega na utlenieniu za pomoc
ą manganianu (VII) potasu związków organicznych i niektórych
organicznych do zwi
ązków prostych, w środowisku kwaśnym, w stanie wrzenia, przykładowo według
reakcji:
5 C
6
H
12
O
6
+ 24 MnO
4
-
+ 72 H
+
→ 24 Mn
2+
+ 30 CO
2
+ 66 H
2
O
Nadmiar nadmanganianu (VII) potasu redukuje si
ę dodanym w równoważnej ilości mianowanym
roztworem kwasu szczawiowego
– H
2
C
2
O
4
, którego nadmiar miareczkuje się nadmanganianem potasu
według reakcji:
2 MnO
4
-
+ 5 C
2
O
4
2-
+ 16 H
+
→ 2 Mn
2+
+ 10 CO
2
+ 8 H
2
O
METODY OZNACZANIA
Istniej
ące metody oznaczania utlenialności w wodzie dają możliwości zastosowania metod:
- w
środowisku kwaśnym i zasadowym na gorąco,
- w
środowisku kwaśnym na zimno.
Zasada oznaczania jest we wszystkich metodach jednakowa.

Oznaczanie utlenialno
ści przeprowadzono zgodnie wg.:
PN-C-04578-02: 1985. Woda i
ścieki. Badania zapotrzebowania tlenu i zawartości węgla
organicznego. Oznaczanie chemicznego zapotrzebowania tlenu (ChZT) metod
ą nadmanganianową
Oznaczenie
Do kolby sto
żkowej o pojemności 250 ÷ 300 cm
3
odmierzy
ć 100 cm
3
badanej próbki. Dodać 5 cm
3
roztworu (1 + 3) H
2
SO
4
oraz 10 cm
3
roztworu 0,01 M KMnO
4
. W celu unikni
ęcia przegrzania cieczy dodać
kilka ziaren pumeksu. Całość zagotować i utrzymywać w stanie słabego wrzenia przez 10 minut.
Natychmiast, po upływie tego czasu, na gorąco dodać 10 cm
3
roztworu 0,01 M H
2
C
2
O
4
(kwas
szczawiowy) lub tak
ą objętość aby odpowiadała (była równoważna) łącznej objętości dodanego KMnO
4
.
Gdy badana próbka ulegnie całkowitemu odbarwieniu, natychmiast miareczkować 0,01 M KMnO
4
do
słabego różowego zabarwienia, trwałego co najmniej w ciągu 2 minuty.
Równolegle przygotować próbkę kontrolną, używając do tego celu 100 cm
3
wody destylowanej.
Post
ępować analogicznie jak w przypadku próbki badanej. Objętość roztworu 0,01 M KMnO
4
zu
żytego do
zmiareczkowania próbki kontrolnej nie powinna przekraczać 0,2 ÷ 0,3 cm
3
.
W celu wyznaczenia współczynnika molowości (f) roztworu 0,01 M KMnO
4
, nale
ży do próbki
kontrolnej, po jej zmiareczkowaniu (uzyskaniu lekkiego różowego zabarwienia) ponownie wprowadzić
nadmiar kwasu szczawiowego, w ilo
ści 10 cm
3
. Ponownie próbkę zmiareczkować roztworem 0,01 M
KMnO
4
(bez ponown
ego gotowania) do różowego zabarwienia.
Współczynnik (f) molowości 0,01 M KMnO
4
nale
ży obliczyć według wzoru:
f
KMnO4
=10/V
gdzie:
V
– objętość roztworu 0,01 M KMnO
4
, u
żytego do zmiareczkowania 10 cm
3
nadmiaru roztworu
0,01M H
2
C
2
O
4
Uwaga! W przypadku stwierdzenia,
że zabarwienie cieczy w trakcie ogrzewania znacznie osłabło lub
znikło dodać ponownie 10 cm
3
0,01 M KMnO
4
lub odpowiednio rozcie
ńczyć próbkę badaną.
Utlenialno
ść próbki badanej, w mg O
2
/dm
3
obliczy
ć według wzoru:
x =
f · (a – b )·1000/V mg O
2
/dm
3
gdzie:
a
– ilość roztworu 0,01 M KMnO
4
zu
żyta do zmiareczkowania badanej próbki, cm
3
b - ilo
ść roztworu 0,01 M KMnO
4
zu
żyta do zmiareczkowania badanej próbki kontrolnej, cm
3
f
– współczynnik stężenia roztworu 0,01 M KMnO
4
wyznaczony wg. wzoru
V
– objętość próbki badanej, użytej do oznaczania, cm
3

Wyszukiwarka
Podobne podstrony:
materialy do zajec laboratoryjn Nieznany
Płyny eksploatacyjne. Materiały do zajęć laboratoryjnych, Studia, MECHANIKA I BUDOWA MASZYN, Płyny E
socjologia ludności - materialy do zajęć 9, socjologia, Socjologia Ludności
Podpowiedzi do mądrości przyrody, Ekologia - materiały do zajęć
ZABAWA MATEMATYCZNA -DODAWANIE I ODEJMOWANIE LICZB .DWUCYFROWYCH KOLOROWANIE, MATERIAŁY DO ZAJĘĆ, KO
materialy do zajec Karta pracy GLONY I SINICE id 768215
Leibniz Monadologia, Filozofia, Materiały do zajęć, Mistrzu, Zalewski
OczywistoŠ w epistemologii, Filozofia, Materiały do zajęć, Epistemologia
socjologia ludności - materialy do zajęć 5, socjologia, Socjologia Ludności
Cywilizacja multimedialna, Filozofia, Materiały do zajęć, Różne z innych zajęć
socjologia ludności - materiały do zajęć 3, socjologia, Socjologia Ludności
SCENARIUSZ KONSPEKT ZAJĘĆ RUCHOWYCH - WODA, MATERIAŁY DO ZAJĘĆ, KONSPEKTY I SCENARIUSZE ZAJĘĆ
Quiz 2, Ekologia - materiały do zajęć
ZABAWY KREATYWNE Z DZIEĆMI PRZEDSZKOLNYMI, MATERIAŁY DO ZAJĘĆ, KONSPEKTY I SCENARIUSZE ZAJĘĆ
Mtd1, Studia, Psychologia UW - materiały do zajęć, UWPsych - Metodologia badań psychologicznych
Klasyczna teoria prawdy1, Filozofia, Materiały do zajęć, Różne z innych zajęć
więcej podobnych podstron