
1
Badania prenatalne
WSTĘP WIKIPEDIA
Badania prenatalne – badanie płodu przeprowadzone w okresie rozwoju wewnątrzmacicznego (w
czasie ciąży), przed urodzeniem. Zadaniem badań prenatalnych jest wykrycie chorób wrodzonych i
genetycznych takich jak zespół Downa, wady cewy nerwowej, nieprawidłowości chromosomów.
Istnieją dwie grupy badań prenatalnych - inwazyjne i nieinwazyjne. Metody inwazyjne wymagają
pobrania np. płynu owodniowego (amniopunkcja), natomiast metody nieinwazyjne opierają się o
ultrasonografię lub testy krwi (poziom alfa fetoproteiny, β-hCG, estriolu oraz h-hCG ) i pozwalają
jedynie na oszacowanie ryzyka wystąpienia danej wady. Od niedawna istnieje też metoda oparta o
analizę poziomów DNA we krwi[1].
Badanie prenatalne (inwazyjne) zaleca się głównie kobietom po 35 roku życia, które są pierwszy raz w
ciąży albo nie rodziły w okresie 2-5 lat.
WYKŁAD
Diagnostyka prenatalna
Biopsja kosmówki , CVS – chorionie Villi sampeling
Polega na biopsji rozwijającego się łożyska (kosmków kosmówki) przez brzuch lub szyjkę za pomocą
giętkiego cewnika lub igły. Stosowana w pierwszym trymestrze ciąży. Wprowadzona w latach 60-
tych, ale w badaniach stosowana po wprowadzeniu ultrasonografów.
1.
Kosmowka różnicuje się w kosmówkę kosmatą ( chorion frondo sum- część łożyskową),
która staje się częścią łożyska i poddawana jest biopsji w czasie CVS. Oraz kosmówkę gładką
(część błonowa), która staje się częścią błon płodowych.
2.
Cvs jest rutynowo wykonywana w 9-12 tyg. Ciąży. Biopsję przez brzuch można wykonać przez
cały okres ciąży, może być alternatywą aminocentezy.
3.
Próbka tkanki może być pobrana do analizy lub do hodowli.
4.
Powikłania:
•
Krwawienie
•
Poronienia samoistne
•
Zanieczyszczenie biopatu materiałem matczynym
•
Ograniczona mozaikowatość kosmówki
•
Wykonana przed 9 tyg. Ciąży wiąże się z ryzykiem wystąpienia wad kończyn.
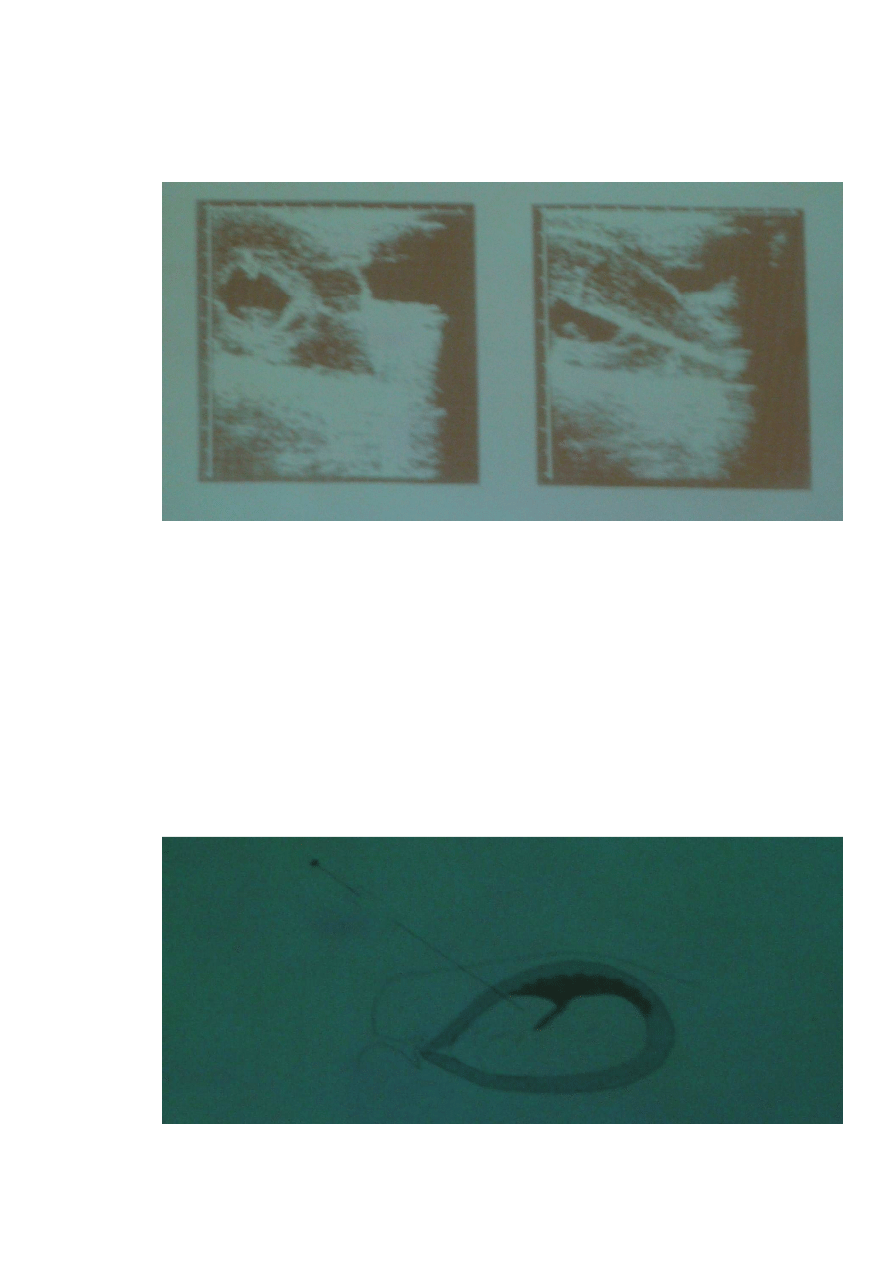
2
Pobieranie materiału do badań prenatalnych , monitorowanie USG.
Oznaczenia: 1 płód, 2 region otaczający płód, 3 kosmówka, 4 pobieranie igłą kosmówki do
badań (igła może być wprowadzona przez brzuch matki lub szyjkę macicy.)
Techniki diagnostyczne
AMNIOCENTEZA
Polega na aspiracji płynu owodniowego za pomocą specjalnej, cienkiej igły i założeniu
hodowli komórek owodniowych oraz analizie w kierunku stężenia markerów płodowych,
takich jak alfa-fetoproteina (AFP).

3
1.
Amniocentezę wykonuje się zwykle w 15-17 tyg ciąży, są próby w 11-14 tyg.
2.
Wyniki z hodowli uzyskuje się po 2-4 tyg w zależności od techniki hodowli
3.
Powikłania
•
Niezaaspirowanie płynu pod wpływem skurczu macicy
•
Powikłania matczyne polegające na plamieniu i przecieku płynu owodniowego
•
Poronienia- ryzyko 0.5%
•
Uraz płodu igłą aspiracyjną- ultrasonograf minimalizuje ryzyko.
POBIERANIE KRWI PŁODOWEJ
Przez skórne pobranie krwi pępowinowej (PUBS), czyli kordocenteza , zostało po raz pierwszy
zastosowane w diagnostyce chorób, których nie można rozpoznać w komórkach uzyskanych za
pomocą amniocentezy lub CVS. Polega na nakłuciu igłą pępowiny w pobliżu łożyska pod kontrolą
ultrasonografu. Zabieg wykonuje się od 17 tyg ciązy do porodu.
1.
W badaniu pobiera się 0,5-1 ml krwi płodowej – należy sprawdzić czy krew jest
pochodzenia płodowego, ponieważ matczyne naczynia łożyskowe są blisko miejsca
pobierania.
2.
Krew płodowa pobierana jest na badania kariotypu, do badań zakażen bakteryjnych i
wirusowych.
3.
Powikłania
•
Obumieranie płodu ryzyko 2%
•
Krwawienie płodowe trawa 1 ? i nie stanowi zagrożenia
BADANIA PRZESIEWOWE SUROWICY MATKI
Oznaczenie unikalnych markerów - białek produkowanych przez płód we wczesnym okresie ciąży,
obecnych w surowicy matki w odpowiednich stężeniach.
4
1.
Alfa-fetoproteina AFP- głowne białko osocza wytwarzane przez płód we wczesnym okresie
ciąży, stopniowo zastępowanym przez albuminy - pomiar we krwi płodowej, płynie
owodniowym i surowicy matki. Wady cewy nerwowej i ściany brzucha płodu są przyczyną
przecieku surowicy płodu do płynu owodniowego. Niskie stężenie AFP w surowicy matki –
ryzyko zespołu Downa.
2.
Stężenie niekoniugowanego estriolu – zwiększa się w ciąży- zespól Downa maleje.
3.
Gonadotropina kosmówkowa hCG – produkowana przez łożysko: stężenie obniża się w 10-20
tyg ciązy, a w zespole Downa i zespole Turnera – zwiększa się.
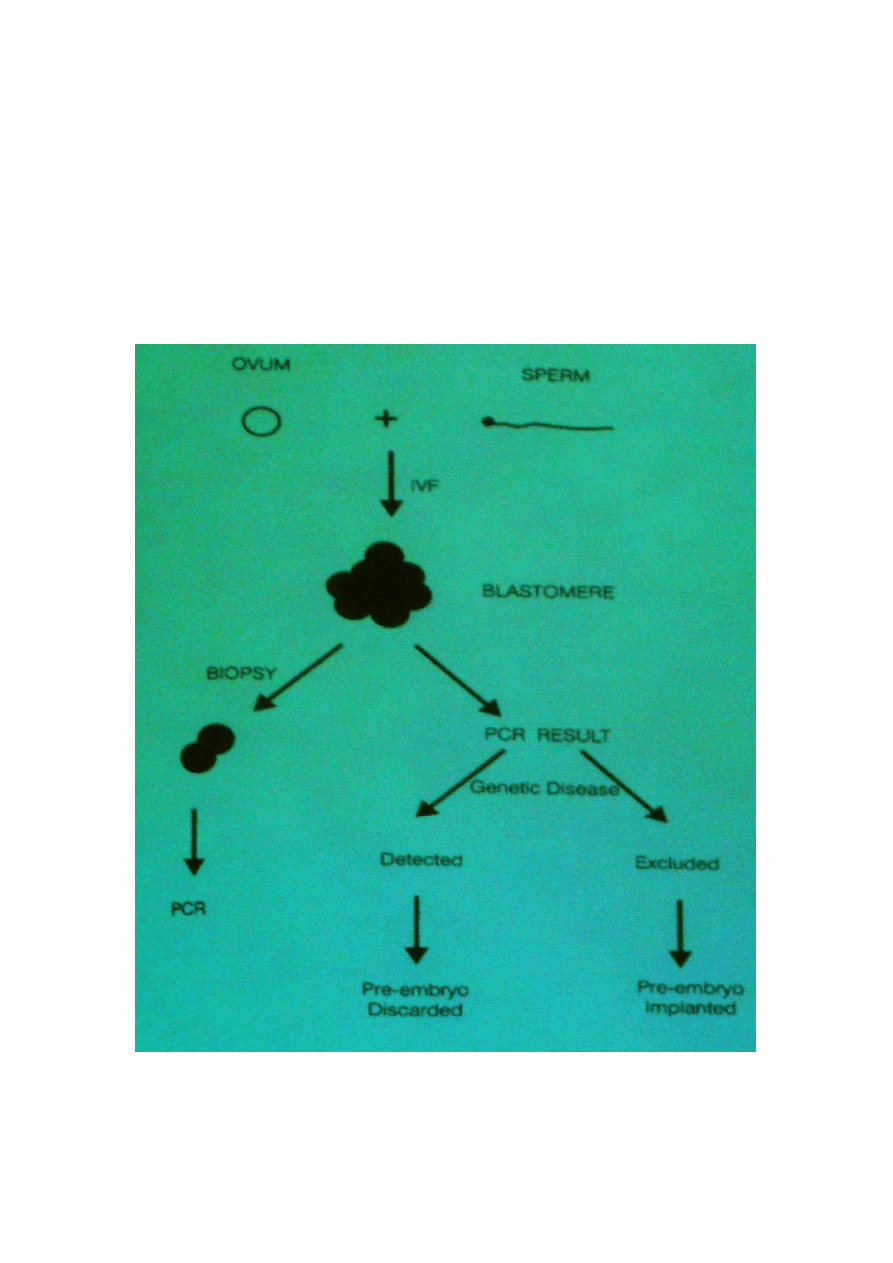
PRZEDIMPLANTACYJNA DIAGNOSTYKA CHORÓB GENETYCZNYCH
Przedimplantacyjna biopsja zapłodnionego In vitro oocytu umożliwia pobranie kilku komórek
(blastomery) jeszcze przed różnicowaniem się komórek.
5
CHOROBY INFEKCYJNE
1.
Płod może zakazić się od matki wirusami, bakteriami i pierwotniakami.
2.
Do najczęstszych infekcji przekazywanych przez matkę należą:
•
Różyczka
•
Syfilizm
•
Wirus zapalenia wątroby typu B
•
Wirus cytomegalii
•
Toksoplazmoza
•
HIV
•
Wirus opryszczki
•
Streptococcus B (paciorkowiec)
•
Chlamydia trachomatis
•
Dwoinka rzeżączki
W wielu krajach pierwsze trzy wymienione organizmy chorobotwórcze są rutynowo sprawdzane w
każdym przypadku ciąży.
3.
Następstwem zakażeń są poważne uszkodzenia płodu obejmujące wiele organów i układów
jak krwionośny, nerwowy czy immunologiczny, np. zakażenie wirusem CMV prowadzi do
upośledzenia umysłowego.
PORÓWNANIE METOD WCZESNEJ, NIEINWAZYJNEJ DIAGNOSTYKI PRENATALNEJ
Komórka docelowa
Metoda badania
Uwagi
Syncytio-trofoblast
Mikroskopia- wygląd fizyczny,
przeciwciała monoklonalne
Nie tak użyteczna liczba
komórek może się róznić
między ciążami, ale ogólnie
pozostaje mała
Limfocyty
Przeciwciała monoklonalne lub
markery genów chromosomu Y
lub genów np. HLA,
specyficznych dla ojca
Użyteczność ograniczona przez
możliwość pozostania
limfocytów w krążeniu matki
między ciążami
Krwinki czerwone z jądrami
Przeciwciała monoklonalne lub
markery genów chromosomu Y
lub genów np. HLA,
specyficznych dla ojca
Obecnie najlepsi kandydaci ,
jeśli możliwe jest uzyskanie
wystarczającej liczby komórek
bez zanieczyszczenia
komórkami matki
6
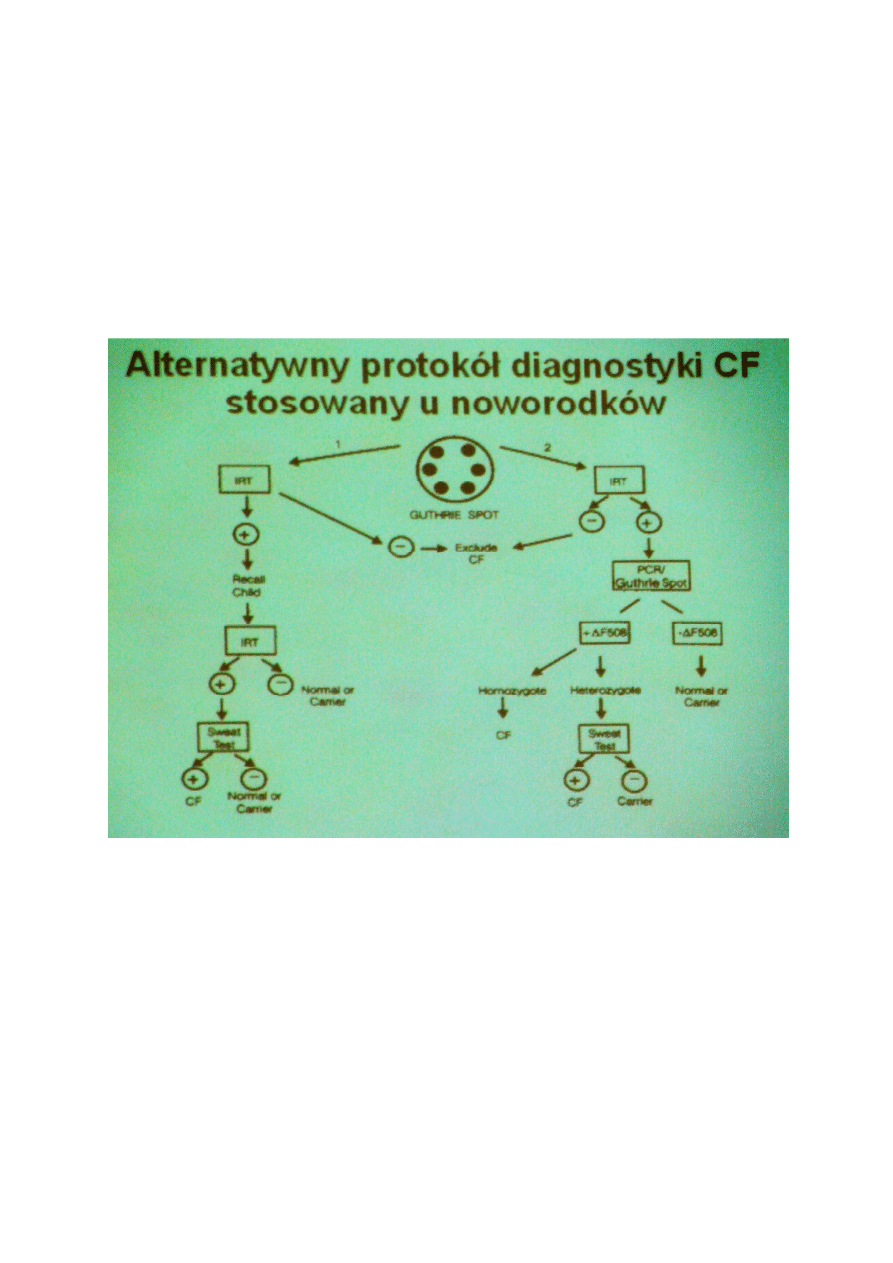
Diagnostyka noworodków obowiązuje w przypadku:
1.
Choroba występuje w populacji z dużą częstością i należy do ciężkich pod względem objawów
2.
Efektywne leczenie jest możliwe
3.
Leczenie przynosi lepsze efekty kiedy wcześniej zostanie rozpoczęte
4.
Testy laboratoryjne SA dostępne i odpowiednio czułe
•
Test IRT- badanie trypsynogenu we krwi dziecka - immunoreactive trypsinogen test
•
Badanie potu dziecka na obecnośc NaCl – sweat test
DO POCZYTANIA ABY ZADZIWIĆ NA EXAMIE :D
Diagnostyka prenatalna
Metody diagnostyki prenatalnej dzielą się na metody nieinwazyjne oraz metody inwazyjne.
Nieinwazyjne metody diagnostyki prenatalnej:
1. Ultrasonografia (USG).
2. Badania przesiewowe oparte na oznaczaniu specyficznych substancji pochodzenia płodowego
obecnych w surowicy krwi matki.
3. Badanie komórek i DNA pochodzenia płodowego obecnych w krążeniu matczynym.

7
Inwazyjne metody diagnostyki prenatalnej:
1. Amniocenteza (amniopunkcja).
2. Biopsja kosmówki (biopsja trofoblastu).
3. Kordocenteza (pobieranie krwi płodowej ze sznura pępowinowego).
Cele diagnostyki prenatalnej:
1. Ocena stanu płodu w celu wyboru optymalnego momentu i sposobu rozwiązania ciąży.
2. W ciążach podwyższonego ryzyka genetycznego uspokojenie rodziców, że w aktualnie
istniejącej ciąży dana wada rozwojowa lub choroba genetycznie uwarunkowana nie występuje u
dziecka.
3. Wykrycie u płodu wad rozwojowych i chorób genetycznie uwarunkowanych, w przypadku
których interwencja lekarska jeszcze w okresie życia wewnątrzmacicznego, stwarza szanse
uratowania dziecka lub zmniejsza ryzyko powikłań okresu okołoporodowego.
4. Wykrycie u płodu wad wrodzonych, w których istnieje szansa uratowania dziecka pod
warunkiem interwencji lekarskiej bezpośrednio po urodzeniu.
5. Wykrycie wad letalnych, nie dających szansy na przeżycie dziecka, a prowadzących do
wewnątrzmacicznego obumarcia płodu lub zgonu dziecka w okresie okołourodzeniowym.
BADANIA NIEINWAZYJNE
1)
Ultrasonografia (USG)
USG płodu jest najczęściej stosowaną metodą diagnostyki prenatalnej. Zaleca się, aby
przesiewowe badanie USG (tj. przeprowadzone u każdej ciężarnej kobiety) było wykonane
przynajmniej 3-krotnie podczas trwania całej ciąży (kolejno między 11-14, ok. 20 oraz ok. 30
tygodnia ciąży). Szczegółowa i częstsza ultrasonografia wskazana jest w przypadkach
podwyższonego ryzyka wystąpienia wrodzonej wady rozwojowej u dziecka lub zespołu wad
wrodzonych. Jakość badania USG zależy od doświadczenia lekarza przeprowadzającego badanie i
jakości aparatu jakim dysponuje.
Cele badania USG:
USG w 11-14 tygodniu ciąży – cele:
· Potwierdzenie wieku ciążowego
· Ocena żywotności płodu
· Ocena ilości płodów (z oceną kosmówkowatości)
· Wczesna diagnostyka dużych wad płodu
· Ocena przezierności fałdu karkowego (nuchal translucency, NT)

8
Przezierność fałdu karkowego, inaczej przezierność karokowa (NT) oceniana jest w badaniu USG
między 11-14 tygodniem ciąży. Przeziernością karkową nazywamy obraz ultrasonograficzny,
odpowiadający podskórnemu gromadzeniu się płynu w okolicy karkowej u płodu. Grubość fałdu
karkowego rośnie wraz z wiekiem ciążowym, a tym samym długością ciemieniowo-siedzeniową CRL
(ang. crown-rump length), która ściśle zależy od wieku ciąży.
Począwszy od 14 tygodnia trudniej jest zmierzyć przezierność karkową (wierzchołkowa pozycja
płodu), a prawdopodobieństwo uzyskania pomiaru spada z 98-100% do 90%. Na dodatek nie istnieje
grupa kontrolna, do której można by było przyrównać otrzymane wyniki NT.
Przezierność karkowa – normy:
Opracowane normy NT obejmują ciąże od początku 11 Hbd do końca 13 Hbd (13 tyg. + 6 dni).
Dla CRL=45mm (11 Hbd) mediana wynosi 1,2 mm, a 95 centyl 2,1 mm.
Dla CRL=84mm (13+6 Hbd) mediana wynosi 1,9 mm, a 95 centyl 2,7 mm.
Ryzyko indywidualne obliczamy mnożąc wartość ryzyka wstępnego dla danej pacjentki (wynikającego
z jej wieku oraz wieku ciążowego) przez różnicę między wartością NT zmierzoną a medianą dla
danego CRL.
Przezierność karkowa – interpretacja:
Ryzyko wystąpienia aberracji chromosomowych i innych zaburzeń wrodzonych jest raczej związane z
grubością niż z obrazem ultrasonograficznym fałdu karkowego. Skrining NT pozwala zidentyfikować
około 72% płodów z zespołem Downa przy odsetku wyników fałszywie dodatnich wynoszącym 5%. W
czasie 2 trymestru ciąży fałd karkowy ulega zazwyczaj wchłonięciu, a tylko w nielicznych przypadkach
rozwija się obrzęk karku (ang. nuchal edema) lub tzw. cystic hygroma (obrzęk wielokomorowy szyi),
którym może towarzyszyć uogólniony obrzęk płodu. Ryzyko wystąpienia trisomii u płodu rośnie wraz
ze wzrostem przezierności (grubości) fałdu karkowego NT.
- NT = 3 mm – ryzyko trisomii podwyższone ponad ryzyko wynikające z wieku matki 3 razy
- NT = 4 mm – ryzyko trisomii podwyższone ponad ryzyko wynikające z wieku matki 18 razy
- NT = 5 mm – ryzyko trisomii podwyższone ponad ryzyko wynikające z wieku matki 28 razy
- NT > 5 mm – ryzyko trisomii podwyższone ponad ryzyko wynikające z wieku matki 36 razy
Poza aberracjami chromosomowymi istnieją inne przyczyny zwiększenia grubości fałdu karkowego.
Są to:
1) niewydolność płodowego układu krążenia związana z wadą serca i/lub dużych naczyń
2) zastój krwi żylnej w obrębie głowy i szyi płodu spowodowany uciskiem
3) nieprawidłowy lub opóźniony rozwój układu limfatycznego
4) nieprawidłowy drenaż limfatyczny w chorobach nerwowo-mięśniowych płodu

9
5) anemia płodowa lub hipoproteinemia
6) infekcje płodu powodujące anemię lub niewydolność krążenia
7) zmieniony skład substancji międzykomórkowej
Innym markerem ultrasonograficznym aberracji chromosomowych (przede wszystkim Z. Downa) jest
brak lub niedorozwój kości nosowej u płodu – NB (ang. nasal bone). Obecność kości nosowej
zaznaczana jest w opisie badania USG jako NB (+), a brak jako NB(-). Brak kości nosowej stwierdza się:
- u 67 % płodów z trisomią 21
- u 55 % płodów z trisomią 18
- u 34 % płodów z trisomią 13
- u 11 % płodów z monosomią X (Zespół Turnera)
- u 7 % płodów z triploidią
Oprócz pomiaru NT, w trakcie badania USG w 11-14 Hbd możliwa jest również ocena anatomii płodu i
ewentualne wykrycie wrodzonych wad rozwojowych dziecka. Stwierdzenie niektórych wad
wrodzonych, powinno nasuwać podejrzenie aberracji chromosomowej u płodu i jest wskazaniem do
wykonania inwazyjnej diagnostyki prenatalnej z oceną kariotypu płodu. Poniżej wymieniono kilka z
nich:
- zespół Dandy’ego-Walkera (częstość 1/30.000) – aberracje chromosomowe w 40% przypadków;
ponadto występuje w 50 zespołach genetycznych
(Z. Dandy’ego-Walkera: zanik robaka móżdźku, zwężenie komory IV, powiększenie cysterna magna)
- brak ciała modzelowatego (częstość 1/1000) – występuje w ok. 100 zespołach genetycznych w tym
w trisomii 13 i 18
- cystic hygroma: 75% aberracje chromosomowe (głównie zespół Turnera)(oubstronne, torbielowate
struktury w okolicy potyliczno-szyjnej płodu)
- wentrykulomegalia: (częstość 1/1000) – w 10% wiąże się z aberracją chromosomową
- holoprosencefalia: (częstość 1/10.000) – w 30% aberracje chromosomowe (trisomia 13 i 18)
- małogłowie: (częstość 1/1000) – w 15% aberracje chromosomowe (trisomia 13, delecje 4p i 5p)
- przepuklina przeponowa: (częstość 1/3000) – 20% aberracje chromosomowe
- omphalocoele (przpuklina sznura pępowinowego): (częstość 1/3000) – w 60% aberracje
chromosomowe - * ryzyko aberracji jest większe, jeśli przepuklina pojawia się wcześniej oraz jeśli
zawiera tylko jelita
- gastroschisis (wytrzewienie): (częstość 1/5000) – rzadko wiąże się z aberracjami chromosomowymi
- wady serca: (częstość 5-10/1000) – aberracje chromosomowe w 5% przypadków

10
- zarośnięcie przełyku: (częstość 1/3000) – w 4% aberracje chromosomowe
- zarośnięcie dwunastnicy: (częstość 1/5000) – 40% aberracje chromosomowe (głównie trisomia 21)
- hiperechogeniczne jelita: (częstość 1/200) – ryzyko trisomii 21 wzrasta 20-krotnie
- hipotrofia płodu: w 1% przypadków aberracje chromosomowe (trisomia 21, triploidia)
- wodonercze: w 3% wiąże się z aberracjami chromosomowymi
- megacystis (pęcherz olbrzymi): w 20% aberracje chromosomowe, ale w 50% samoistnie zanika
Ryzyko aberracji chromosomowej wzrasta wraz z ilością wad rozwojowych stwierdzanych u płodu. I
tak w przypadku stwierdzenia 2 wad rozwojowych, ryzyko aberracji chromosomowej u dziecka
wynosi średnio ok. 10%, w przypadku 3 wad – ok. 30%, 4 wad – 50%, 5-7 wad – 60-70%, 8 lub więcej
– ok. 90%.
2) Badania przesiewowe surowicy krwi matki
I trymestr ciąży:
Badania przesiewowe w 1. trymestrze (test PAPP-A):
1. Wolna podjednostka beta-hCG
2. PAPP-A
Test PAPP-A wraz z pomiarem NT (wykonywane między 11 a 14 tygodniem ciąży):
- dla trisomii 21 (tzn. zespołu Downa) – wykrywalność wynosi 86,3%, przy odsetku wyników fałszywie
dodatnich równym 5%
- dla wszystkich aberracji chromosomowych wykrywalność sięga 90%, przy 6% wyników fałszywie
dodatnich
Polegają na oznaczeniu markerów biochemicznych w surowicy krwi kobiet ciężarnych:
- Alfa-fetoproteina (AFP)
- Podjednostka beta ludzkiej gonadotropiny kosmówkowej (beta-hCG)
- Nieskoniugowany estriol (uE3)
- PAPP-A
- Inhibina A
· białko PAPP-A - niższe stężenie w ciąży z trisomią 21
II trymestr ciąży:
Test potrójny (wykonywany między 15 a 19 tygodniem ciąży):

11
Test potrójny to badanie, które polega na określeniu stężeń podjednostki beta-hCG, alfa-fetoproteiny
(AFP) i nieskoniugowanego estriolu (uE3). Wykrywa ono 50-75% ciąż z trisomią 21 (zespołem Downa),
a fałszywie dodatnie wyniki otrzymuje się w 5% przypadków. Przy uwzględnieniu NT, wykrywalność
sięga 85-90% przy odsetku wyników fałszywie dodatnich wynoszącym 5%.Poniżej opisano patologie
ciąży, w jakich obserwuje się wzrost lub spadek stężeń markerów biochemicznych, badanych testem
potrójnym.
· podjednostka beta-hCG – wyższe stężenie w ciąży z trisomią 21, zaśniadzie groniastym, ciąży
mnogiej;
- niższe stężenie w ciąży z trisomią 18, ciąży obumarłej
· nieskoniugowany estriol (uE3) – niższe stężenie w ciąży z trisomią 21, bezmózgowiem, aplazją
lub hipoplazją nadnerczy
· AFP
Patologia płodu, w której podwyższone jest stężenie AFP w surowicy:
1) otwarte wady cewy nerwowej
2) ubytki ściany brzucha
3) cystic hygroma
4) atrezja przewodu pokarmowego
5) niektóre wady układu pokarmowego
6) choroby skóry (epidermolysis bullosa simplex, aplasia cutis congenita)
7) IUGR
Inne przyczyny matczyno-płodowe wzrostu AFP w surowicy:
- ciąża mnoga, ciąża obumarła, wady łożyska lub pępowiny, immunizacja Rh
Choroby matki, w których podwyższone jest stężenie AFP:
- guzy wątroby, ostre zapalenie wątroby
3) Komórki i DNA pochodzenia płodowego we krwi kobiety ciężarnej
We krwi ciężarnych krąży pewna ilość komórek płodowych (komórki trofoblastu, pierwotne
erytrocyty jądrzaste, granulocyty) dostępnych badaniu. Ograniczeniami metody są jednak mała ilość
komórek pochodzenia płodowego we krwi ciężarnej oraz trudności w odróżnieniu komórek
matczynych od komórek płodowych.
Odsetek komórek pochodzenia płodowego w pobranej próbce krwi kobiety ciężarnej może zostać
zwiększony poprzez zastosowanie metod automatycznego sortowania komórek: MACS (magnetic cell

12
sorting) lub FACS (fluorescence activated cell sorting). Na uzyskanych komórkach można następnie
przeprowadzać badania cytogenetyczne techniką FISH. Czułość metody podobna jest do czułości
biochemicznych testów przesiewowych, ale badanie jest kosztowne i pracochłonne.
We krwi kobiet ciężarnych występują także niewielkie ilości wolnego DNA pochodzenia płodowego,
który może być wykorzystany do badań genetycznych techniką PCR. Obydwie wymienione metody
nie weszły jeszcze do rutynowej diagnostyki i są w trakcie udoskonalania.
METODY INWAZYJNE
1) Amniopunkcja (amniocenteza)
Amniopunkcja – informacje ogólne:
- wykonywana jest między 15-18 tygodniem ciąży
- pobranie 15-20 ml płynu owodniowego
- ryzyko utraty ciąży (poronienia) w związku z badaniem wynosi 0,5-1%
- czas oczekiwania na wynik: 10 dni - 3 tygodnie
Amniocenteza jest możliwa do wykonania także między 10 a 14 tygodniem ciąży (amniocenteza
wczesna), ale wówczas ryzyko poronienia wzrasta do 2%, a ryzyko wystąpienia wad kończyn (m. in.
stóp końsko-szpotawych u płodu) jest wysokie. Dlatego też wczesna amniocenteza wykonywana jest
bardzo rzadko.
Amniopunkcja – wskazania:
1) Podwyższone ryzyko urodzenia dziecka z aberracją chromosomową:
- wiek ciężarnej powyżej 35 lat (zazwyczaj bierze się pod uwagę wyniki badań przesiewowych i na ich
podstawie weryfikuje wyjściowe ryzyko wynikające z wieku matki i dopiero wówczas podejmuje
decyzję o wykonaniu amniopunkcji)
- urodzenie dziecka z aberracją chromosomową z poprzedniej ciąży
- nosicielstwo translokacji lub innej aberracji chromosomowej u jednego z rodziców
- stwierdzenie w USG patologii płodu sugerującej występowanie aberracji chromosomowej
- nieprawidłowy wynik testów biochemicznych (test PAPP-A, test potrójny) – ryzyko aberracji u płodu
>1:200
2) Urodzenie dziecka z wadą cewy nerwowej z poprzedniej ciąży
2) Biopsja kosmówki
Biopsja kosmówki (CVS – z ang. chorionic villus sampling) – informacje ogólne:
- wykonywana jest między 10-14 tygodniem ciąży

13
- pobranie 5-10 g tkanki
- oczekiwanie na wynik 1-3 tygodnie (komórki trofoblastu aktywnie się dzielą, dzięki czemu możliwa
jest bezpośrednia analiza chromosomów oraz szybkie badania biochemiczne i molekularne)
- ryzyko poronienia około 2 %
Stwierdzono związek między biopsją kosmówki wykonywaną przed 10 tygodniem ciąży, a
występowaniem wad ubytkowych kończyn płodu oraz niedorozwojem żuchwy i języka.
Biopsja kosmówki – wskazania:
- podobne jak w przypadku amniocentezy z wyjątkiem podwyższonego ryzyka urodzenia dziecka z
wadą cewy nerwowej
- CVS jest metodą z wyboru w przypadku molekularnej diagnostyki prenatalnej chorób
monogenowych
3) Kordocenteza
Kordocenteza – informacje ogólne:
- wykonywana od 17 tygodnia ciąży do momentu porodu
- pobranie 0,5-1,0 ml krwi płodu z żyły pępowinowej
- ryzyko poronienia ok. 1,0-1,5%
- istnieje ryzyko zanieczyszczenia krwią matki i otrzymania błędnego wyniku kariotypu płodu
Kordocenteza - wskazania:
- wykrycie w USG po 18. tygodniu ciąży wad sugerujących możliwość aberracji chromosomowych u
płodu
- uzyskanie materiału do badań cytogenetycznych (np. weryfikacja mozaikowatości) lub badań
molekularnych
- diagnostyka i leczenie konfliktu serologicznego, ocena morfologii krwi płodu (np. małopłytkowość)
- diagnostyka prenatalna genetycznie uwarunkowanych chorób krwi (anemia sierpowatokrwinkowa)
PRENATALNA OCENA KARIOTYPU
Wskazania do prenatalnej oceny kariotypu wymieniono przy opisie amniopunkcji.
Aktualnie podstawą badań cytogenetycznych w diagnostyce prenatalnej (ocena kariotypu płodu) jest
hodowla komórek płynu owodniowego uzyskanych na drodze amniopunkcji lub hodowla komórek

14
trofoblastu. Uzyskuje się preparaty cytogenetyczne i ocenia kariotyp płodu z zastosowaniem
klasycznych technik prążkowych.
Prążkowanie chromosomów jest od ponad 30 lat stosowane z powodzeniem jako główna metoda
prenatalnej diagnostyki cytogenetycznej. W celu analizy kariotypu wykorzystuje się takie techniki
prążkowe jak GTG (trawienie trypsyną i barwienie odczynnikiem Giemsy), R (ang. reverse banding,
prążkowanie odwrotne), Q (prążkowanie z zastosowaniem fluorochromu kwinakryny) oraz T.
Rozdzielczość technik prążkowych wynosi od 5 do 10 milionów par zasad.
Namnożenie komórek trofoblastu lub amniocytów w hodowli in vitro, przygotowanie preparatów i
analiza cytogenetyczna chromosomów jest procesem czasochłonnym. Wynik badania otrzymuje się
średnio od 10 dni do trzech tygodni po pobraniu materiału.
Nowoczesne metody badań cytogenetycznych w diagnostyce prenatalnej
Rozwój współczesnej diagnostyki prenatalnej stał się możliwy dzięki osiągnięciom w dziedzinie
cytogenetyki molekularnej i biologii molekularnej:
FISH (fluorescencyjne hybrydyzacja in situ):
· stosowana od lat 80-tych XX wieku
· obok analizy chromosomów umożliwia także badanie jąder w stadium interfazy
· zastosowanie sond specyficznych (dostępnych komercyjnie) dla chromosomów pary 13, 18, 21, X i Y
umożliwia szybką diagnostykę najczęściej występujących aneuploidii chromosomowych
· wymaga pozyskania niewielkiej ilości amniocytów bądź komórek kosmówki
· wyniki badania uzyskuje się w przeciągu 24 godzin
Array-CGH (porównawcza hybrydyzacja genomowa z wykorzystaniem mikromacierzy):
· DNA pacjenta (wyizolowany z amniocytów płynu owodniowego) i DNA referencyjny (kontrolny)
wyznakowane na różne kolory są hybrydyzowane do płytek mikromacierzy zawierających fragmenty
genomowego DNA
· umożliwia detekcję niewielkich zmian ilościowych (duplikacje, delecje) w obrębie chromosomów
pacjenta
· wysoka rozdzielczość (1 mln - 500 tys. par zasad)
Detekcja aneuploidii chromosomowych z wykorzystaniem technik biologii molekularnej:
QF-PCR (ilościowy, fluorescencyjny PCR):
· fragmenty DNA (powtórzenia mikrosatelitarne) podlegają amplifikacji, znakowaniu
fluorescencyjnemu a ilość kopii mierzona jest podczas rozdziału elektroforetycznego
· umożliwia szybką detekcję aneuploidii chromosomowych z wykorzystaniem DNA wyizolowanego z
amniocytów lub komórek kosmówki

15
· technika umożliwia również identyfikację przypadków disomii jednorodzicielskiej (UPD)
MLPA (ang. Multiplex Ligation-dependent Probe Amplification )
- metoda oparta o reakcję ligacji odpowiednich sond połączoną z reakcją amplifikacji.
- polega na amplifikacji nie łańcucha DNA, lecz sondy dodawanej do badanej próbki. Pojedyncza
sonda zawiera dwa różne oligonukleotydy, z których każdy wiąże się ze starterem PCR. Każda z sond
wiąże się specyficznie z wybranym miejscem sekwencji. Tylko w ten sposób połączone sondy ulegają
amplifikacji w reakcji PCR. Liczba otrzymanych w wyniku reakcji PCR sond zależy od liczby
odpowiadających sekwencji w badanym DNA.
- pozwala na równoczesną ocenę ilościową obecności ilości kopii wieloeksonowych genów. Na
podstawie zmian stosunków ilościowych poszczególnych fragmentów można wnioskować o delecjach
bądź duplikacjach odpowiednich odcinków genów.
- zaletą tej metody jest prostota wykonania, niska cena i mała ilość DNA potrzebna do jej wykonania
Wyszukiwarka
Podobne podstrony:
DIAGNOSTYKA PRENATALNA 2
Psychologiczne aspekty diagnostyki prenatalnej, Psychologia prokreacji
diagnostyka prenatarna referat na biomedyke
Diagnostyka prenatalna rozdział z podręcznika do pediatrii
Diagnostyka prenatalna 01, Koło II GENY
Diagnostyka prenatalna ćw 9 WWL IV rok
diagnostyka prenatalna, położnictwo, pediatria
Diagnostyka prenatalna
diagnostyka prenatalna (2)
13 Diagnostyka prenatalna
Diagnostyka prenatalna
diagnostyka prenatalna
Diagnostyka prenatalna (2), Pliki, dignostyka labolatotyjna
Diagnostyka prenatalna, Genetyka
więcej podobnych podstron