
http://kbs.ise.polsl.pl
Environmental Biotechnology Department, SUT
Wykład z biochemii
Kataliza enzymatyczna; kinetyka reakcji enzymatycznych;
łańcuch oddechowy
Prof.dr hab. inż.Korneliusz Miksch
Wykład 4

http://kbs.ise.polsl.pl
Environmental Biotechnology Department, SUT
3. Biochemia dynamiczna
3.1. Kataliza enzymatyczna
•
Swoistość enzymu względem katalizowanej reakcji i
względem substratu (specyficzność reakcji i
specyficzność substratowa)
2. Budowa enzymu
Holoenzym= koenzym + apoenzym
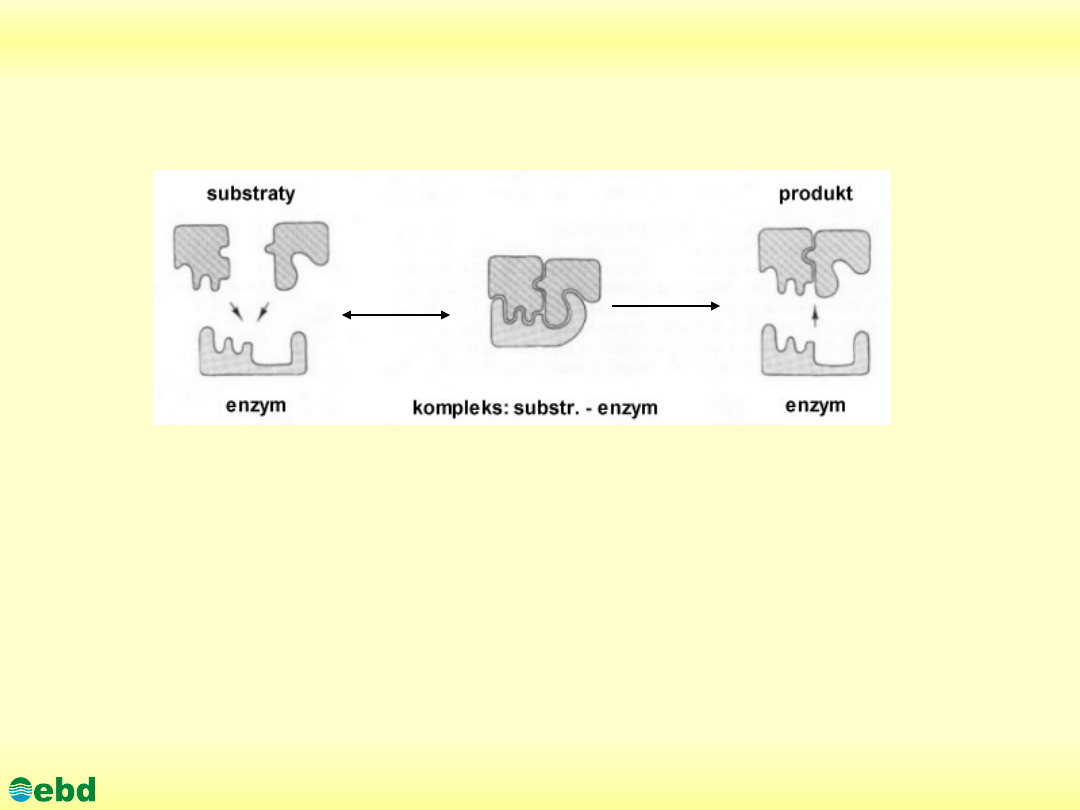
3. Mechanizm działania enzymów
E + S ES E + S
http://kbs.ise.polsl.pl
Environmental Biotechnology Department, SUT
3. Biochemia dynamiczna
3.1. Kataliza enzymatyczna
Kompleks enzym-substrat
http://kbs.ise.polsl.pl
Environmental Biotechnology Department, SUT
3. Biochemia dynamiczna
3.1. Kataliza enzymatyczna
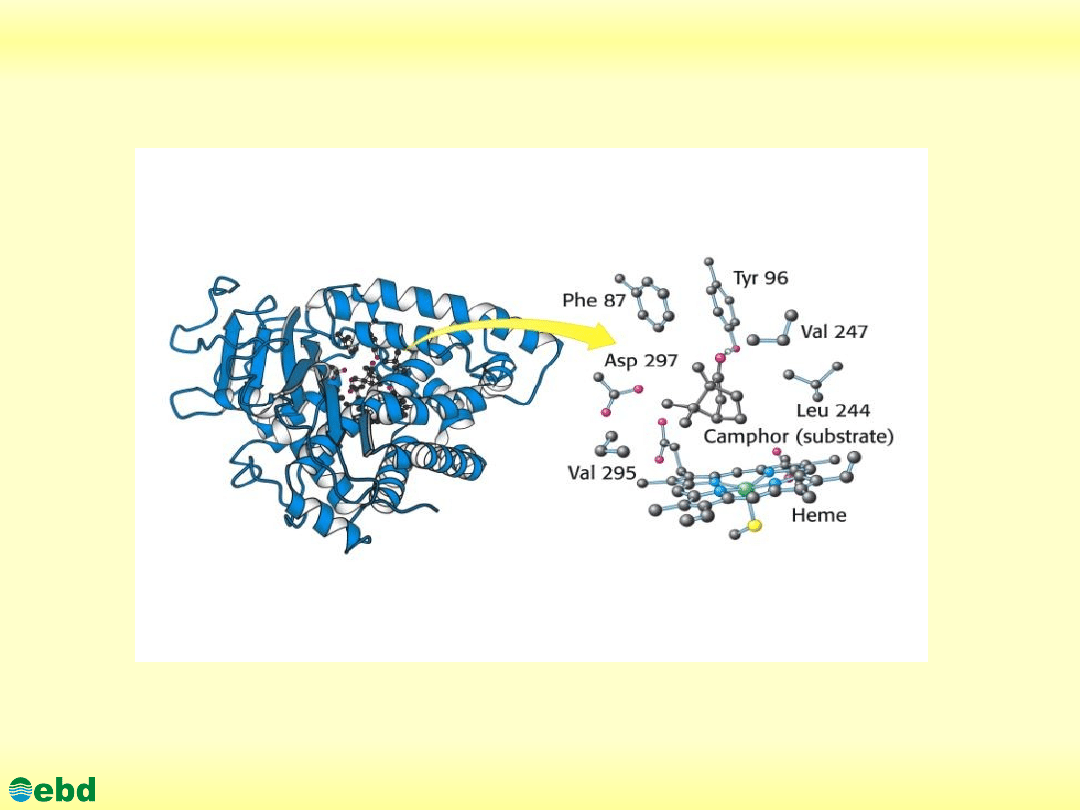
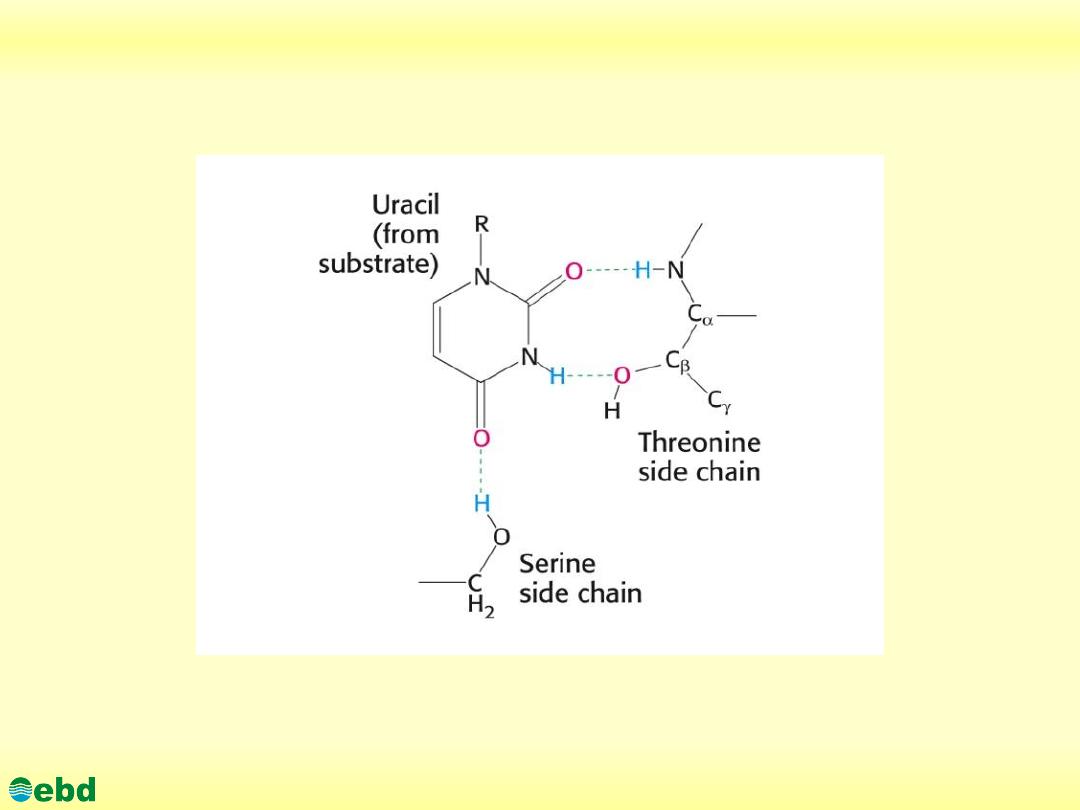
Miejsce aktywne enzymu (z substratem)
http://kbs.ise.polsl.pl
Environmental Biotechnology Department, SUT
3. Biochemia dynamiczna
3.1. Kataliza enzymatyczna
Reakcja katalizowana przez enzym rozpoczyna się od związania
substratów przez centrum aktywne enzymu i powstania
przejściowego kompleksu enzym-substrat (E-S). Następnie
zachodzi właściwa reakcja: połączenie cząsteczek substratów w
produkt reakcji albo rozłożenie substratu na mniejsze cząsteczki.
Reakcja kończy się uwolnieniem produktów przez enzym.
Cząsteczka enzymu nie zużywa się podczas reakcji i po
uwolnieniu produktów jest gotowa do przyłączenia nowych
substratów.
http://kbs.ise.polsl.pl
Environmental Biotechnology Department, SUT
3. Biochemia dynamiczna
3.1. Kataliza enzymatyczna
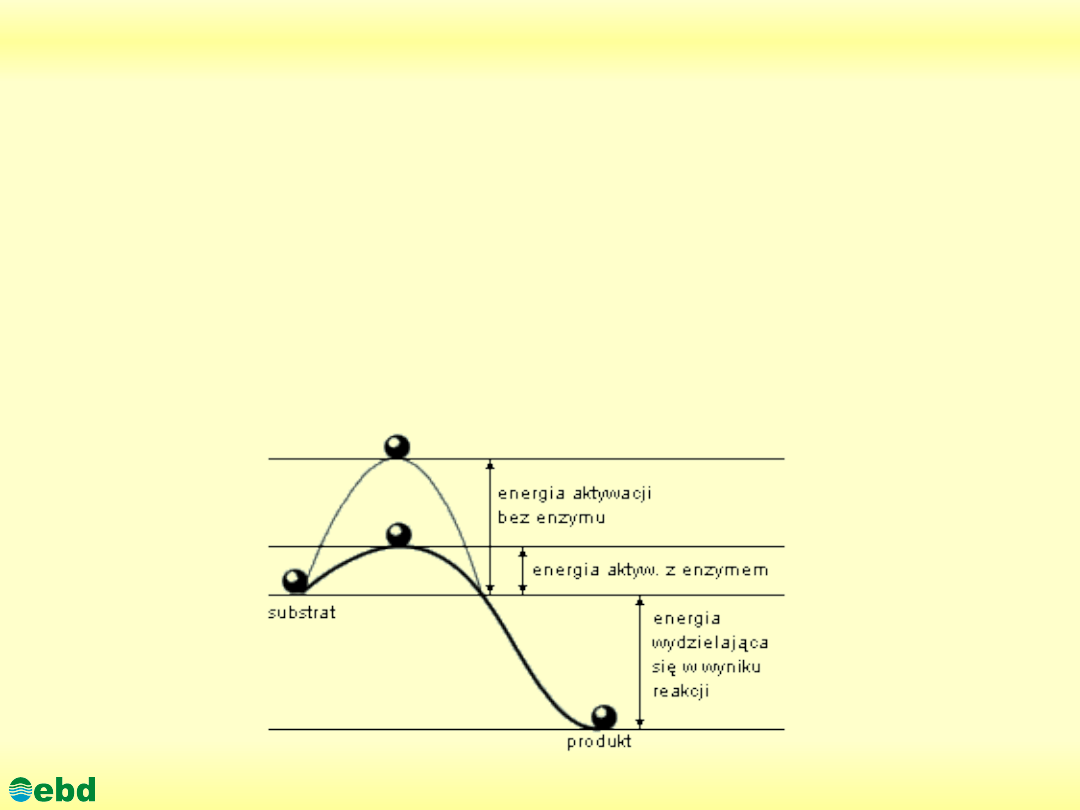
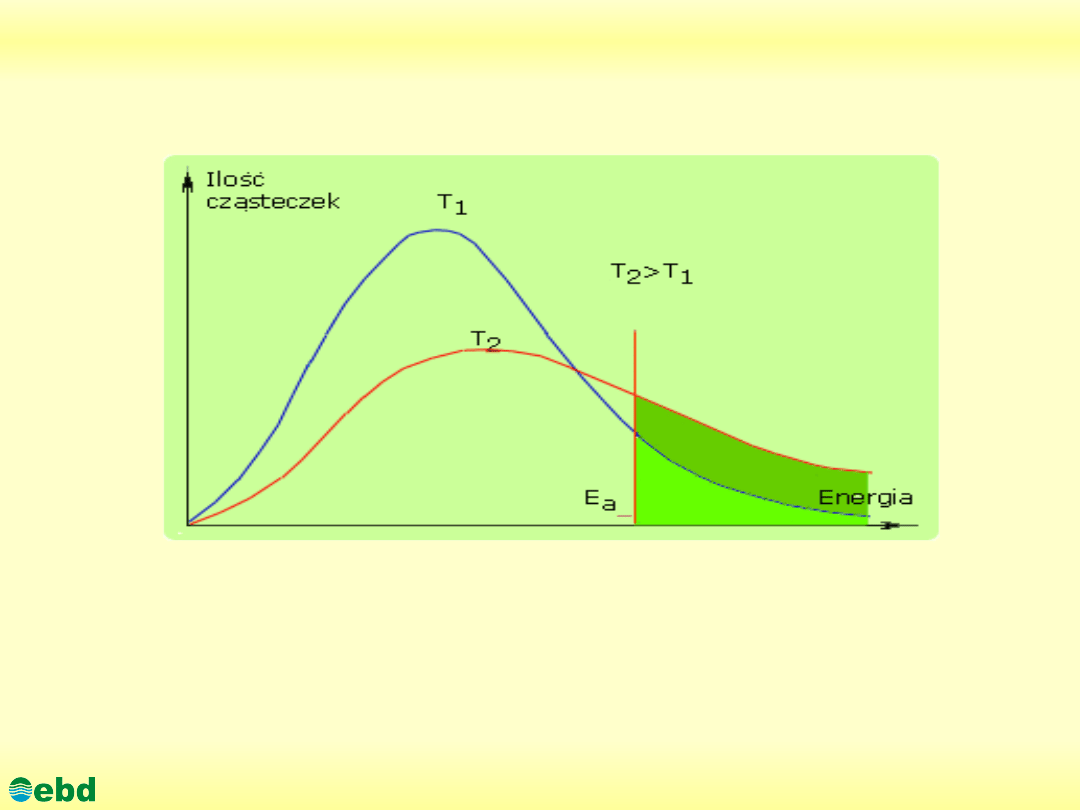
ENERGIA AKTYWACJI to energia, którą muszą mieć
cząsteczki (jony, atomy), aby były zdolne do określonej
reakcji chemicznej.; energia aktywacji wyraża się zwykle
w kilodżulach na mol (kJ/mol) reagujących cząsteczek; im
mniejsza jest energia aktywacji, tym reakcja zachodzi
szybciej
http://kbs.ise.polsl.pl
Environmental Biotechnology Department, SUT
3. Biochemia dynamiczna
3.1. Kataliza enzymatyczna
Jeżeli w czasie zderzeń substraty mają za małą energię reakcja nie
zachodzi.Łączna liczba zderzeń między cząsteczkami wzrasta z
temperaturą (cząsteczki poruszają się szybciej). Udział cząsteczek
obdarzonych energią większą od energii aktywacji wzrasta wraz z
temperaturą
http://kbs.ise.polsl.pl
Environmental Biotechnology Department, SUT
3. Biochemia dynamiczna
3.1. Kataliza enzymatyczna
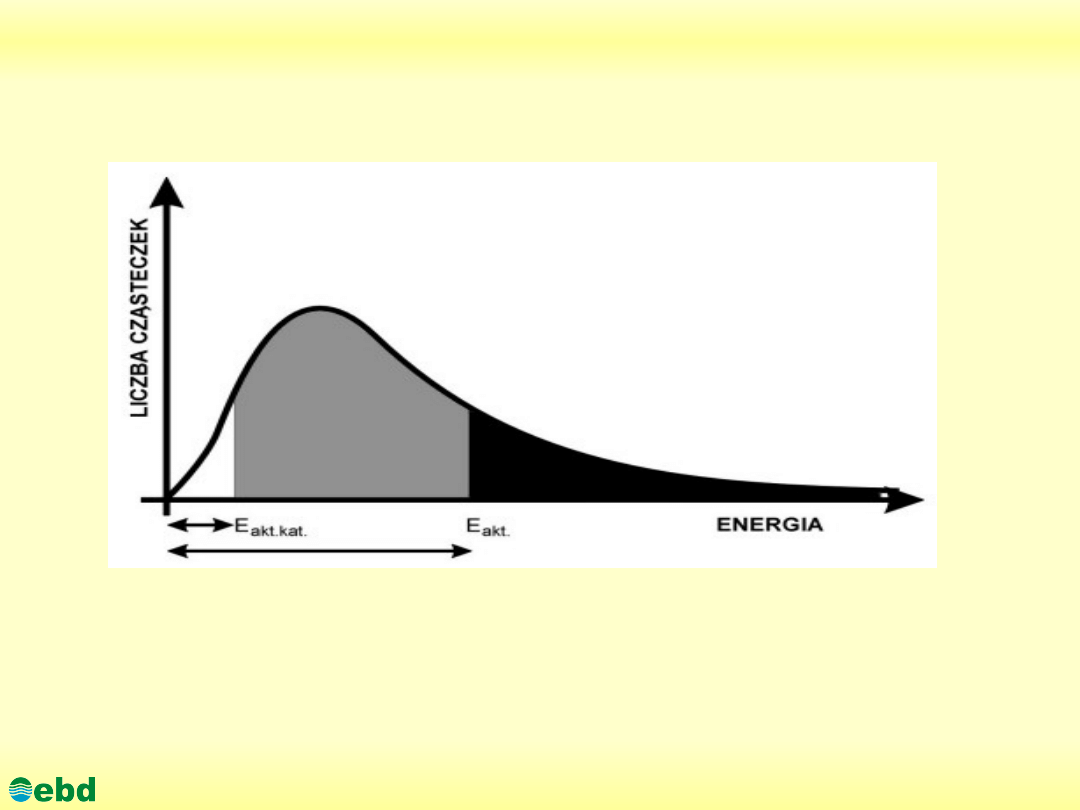
W reakcji katalizowanej wymagana jest znacznie niższa energia aktywacji:
E
akt.kat.
. W identycznych warunkach temperatury, znacznie więcej cząsteczek ma
energie przekraczające tę zmniejszoną wartość progową. Na wykresie odpowiada
temu pole oznaczone szarym + czarnym kolorem łącznie.

http://kbs.ise.polsl.pl
Environmental Biotechnology Department, SUT
3. Biochemia dynamiczna
3.1. Kataliza enzymatyczna
Maksymalna liczba obrotów wybranych enzymów
http://kbs.ise.polsl.pl
Environmental Biotechnology Department, SUT
3. Biochemia dynamiczna
3.1. Kataliza enzymatyczna
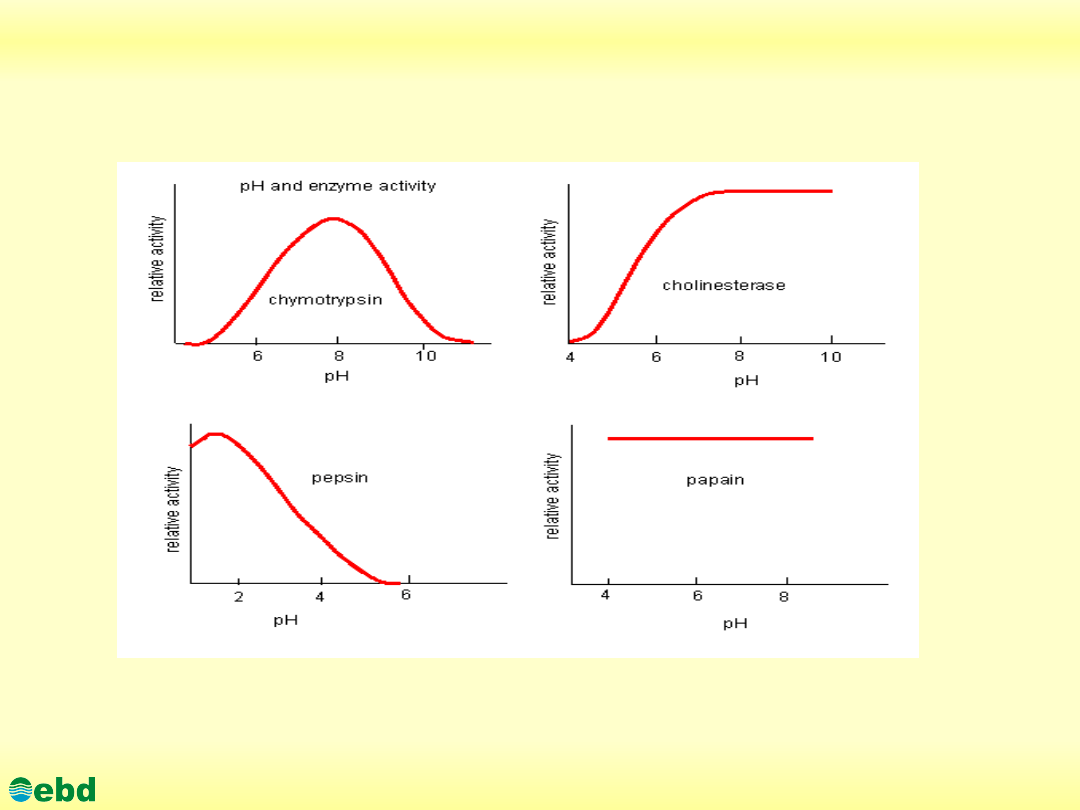
Wpływ odczynu na aktywność enzymów

http://kbs.ise.polsl.pl
Environmental Biotechnology Department, SUT
3. Biochemia dynamiczna
3.1. Kataliza enzymatyczna
Nazewnictwo i klasyfikacja enzymów
Enzymy dawniej poznane mają tradycyjnie używane nazwy
zwyczajowe, np. pepsyna, trypsyna. Często używanym
sposobem tworzenia nazwy enzymu jest dodanie do nazwy
rozkładanego związku końcówki „aza” np.:
- sacharoza – sacharaza
- dehydrogenacja (odłączenie H2) dehydrogenaza
- dekarboksylacja (odłączenie CO2) dekarboksylaza

http://kbs.ise.polsl.pl
Environmental Biotechnology Department, SUT
3. Biochemia dynamiczna
3.1. Kataliza enzymatyczna
Klasy enzymów wg klasyfikacji międzynarodowej:
•Klasa 1: oksydoreduktazy- przenoszą ładunki (elektrony i protony)
z cząsteczki substratu na cząsteczkę akceptora: AH
2
+ B A + BH
→
2
;
•Klasa 2: transferazy -przenoszą daną grupę funkcyjną z cząsteczki
jednej substancji na cząsteczkę innej substancji: AB + C A + BC;
→
•Klasa 3: hydrolazy -powodują rozpad substratu pod wpływem wody
(hydroliza): AB + H
2
O A + B;
→
•Klasa 4: liazy -powodują rozpad bez udziału wody: AB A + B;
→
•Klasa 5: izomerazy -zmieniają wzajemne położenie grup
chemicznych wewnątrz cząsteczki związku: AB BA;
→
•Klasa 5: ligazy -powodują syntezę różnych cząsteczek; powstają
wiązania chemiczne: A + B AB;
→

http://kbs.ise.polsl.pl
Environmental Biotechnology Department, SUT
3. Biochemia dynamiczna
3.1. Kataliza enzymatyczna

http://kbs.ise.polsl.pl
Environmental Biotechnology Department, SUT
3. Biochemia dynamiczna
3.1. Kinetyka reakcji enzymatycznych
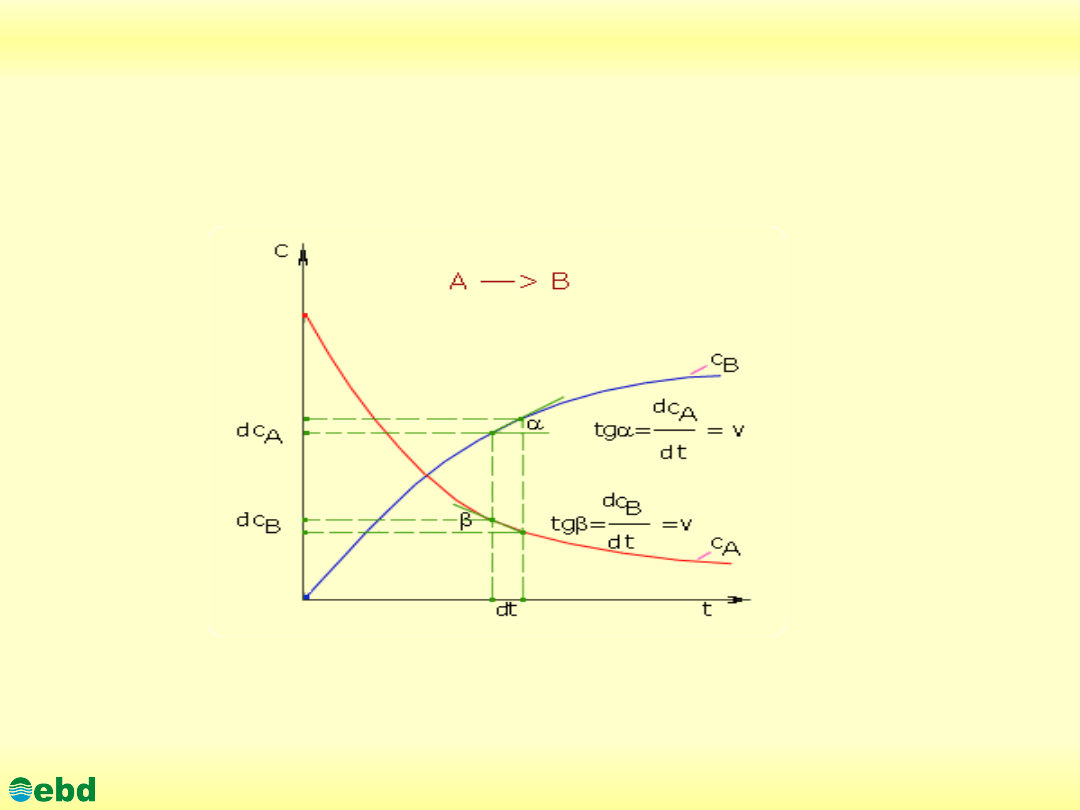
Ilościowo
szybkość reakcji
określa się jako zmianę molowego
stężenia substratu lub produktu w jednostce czasu.
Jeżeli mamy równanie reakcji chemicznej A ---> B + C + ...., to
szybkość reakcji opisuje równanie:
v = dc
A
/dt = k*c
A
/7-24/
lub
v = dc
B
/dt = dc
C
/dt /7-25/
gdzie: c
A
, c
B
, c
C
- stężenia molowe substancji A, B, C,..., t - czas,
dc
A
/dt - ubytek stężenia substaratu w jednostce czas,
dc
B
/dt, dc
C
/dt - przyrost stężenia produktów w jednostce czasu,
k - współczynnik proporcjonalności (stała szybkości).

http://kbs.ise.polsl.pl
Environmental Biotechnology Department, SUT
3. Biochemia dynamiczna
3.1. Kinetyka reakcji enzymatycznych
Szybkość reakcji jest wprost proporcjonalna do iloczynu stężeń
substratów.
Jeżeli mamy równanie reakcji chemicznej aA + bB + cC ---> dD,
to szybkość reakcji opisuje równanie;
v = k[A]
a
* [B]
b
* [C]
c
/7-26/
gdzie: k - stała szybkości reakcji, (a, b, c) - wykładnik potęgi, do
której należy podnieść stężenie, odpowiednio [A], [B], [C].
W przypadku reakcji gazowych często w równaniach
kinetycznych zamiast stężeń molowych stosuje się ciśnienia
cząstkowe

http://kbs.ise.polsl.pl
Environmental Biotechnology Department, SUT
3. Biochemia dynamiczna
3.1. Kinetyka reakcji enzymatycznych
Rząd reakcji
Współczynniki potęgowe (a, b, c) przy stężeniach poszczególnych
substratów określają rząd reakcji, który może być cząstkowy lub
sumaryczny.
Cząstkowy rząd reakcji
Jeżeli a = 1, to reakcja jest pierwszego rzędu względem A; jeżeli a
= 2, to reakcja jest drugiego rzędu względem A itp.
Cząstkowe rzędy reakcji, odpowiadają tylko współczynnikom
stechiometrycznym tych reagentów.
Sumaryczny rząd reakcji
Sumaryczny rząd reakcji chemicznej - jest to suma wykładników
potęgowych w równaniu szybkości reakcji chemicznej
( rząd reakcji = a + b + c + .....).

http://kbs.ise.polsl.pl
Environmental Biotechnology Department, SUT
3. Biochemia dynamiczna
3.1. Kinetyka reakcji enzymatycznych
Cząsteczkowość reakcji
Często stosuje się określenie cząsteczkowość reakcji, którą definiuje
liczba cząsteczek biorących udział w najwolniejszym stadium reakcji.
Cząsteczkowość i rząd reakcji wyznacza się tylko eksperymentalnie, nie
można obliczyć ich teoretycznie.
Sumaryczny rząd reakcji jest przeważnie liczbą niecałkowitą, co
oznacza, że reakcja przebiega przez etapy pośrednie, z których
nawolniejszy decyduje o sumarycznym rzędzie reakcji.
Na ogół rząd reakcji, jak i cząsteczkowość są z reguły małymi liczbami
nie przekraczającymi wartości 3. Zagadnienie sprowadza się do tego,
że równoczesne zderzenia większej liczby cząsteczek są mało
prawdopodobne, a na sumaryczną szybkość reakcji wpływa przede
wszystkim najpowolniejszy etap pośredni bedący przemianą
elementarną i dlatego rząd reakcji jest małą liczbą
http://kbs.ise.polsl.pl
Environmental Biotechnology Department, SUT
3. Biochemia dynamiczna
3.1. Kinetyka reakcji enzymatycznych
Praktycznie pomiary szybkości reakcji wykazały, że szybkość reakcji nie jest
stała, lecz maleje w miarę zużywania się substratów.
Zmiany stężenia w czasie, dla reakcji I-szego rzędu

http://kbs.ise.polsl.pl
Environmental Biotechnology Department, SUT
3. Biochemia dynamiczna
3.1. Kinetyka reakcji enzymatycznych
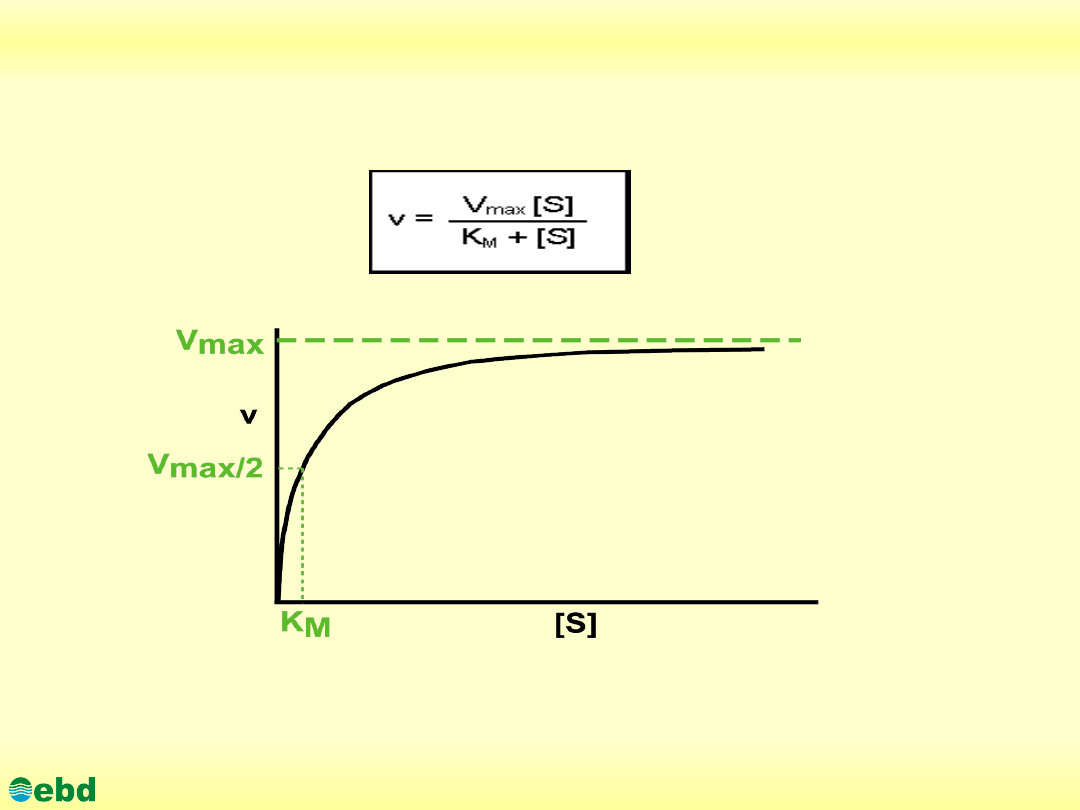
Równanie Michaelisa-Menten
http://kbs.ise.polsl.pl
Environmental Biotechnology Department, SUT
3. Biochemia dynamiczna
3.1. Kinetyka reakcji enzymatycznych
V=szybkość początkowa (mole/litr); [S]=stężenie substratu(molowe);
Vmax=szybkość maksymalna; Km= stała Michaelisa

http://kbs.ise.polsl.pl
Environmental Biotechnology Department, SUT
3. Biochemia dynamiczna
3.1. Kinetyka reakcji enzymatycznych
http://kbs.ise.polsl.pl
Environmental Biotechnology Department, SUT
3. Biochemia dynamiczna
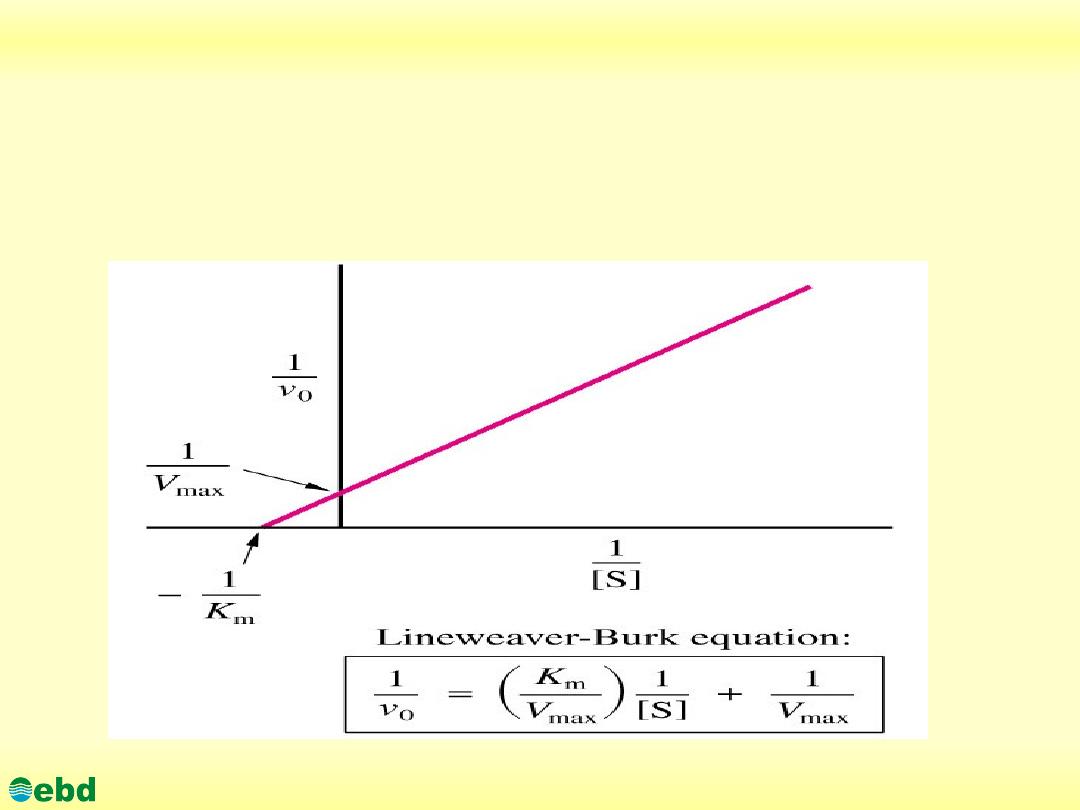
3.1. Kinetyka reakcji enzymatycznych
Determination of V
m
and K
m
Linear representation of the the Michaelis-Menten Equation
http://kbs.ise.polsl.pl
Environmental Biotechnology Department, SUT
3. Biochemia dynamiczna
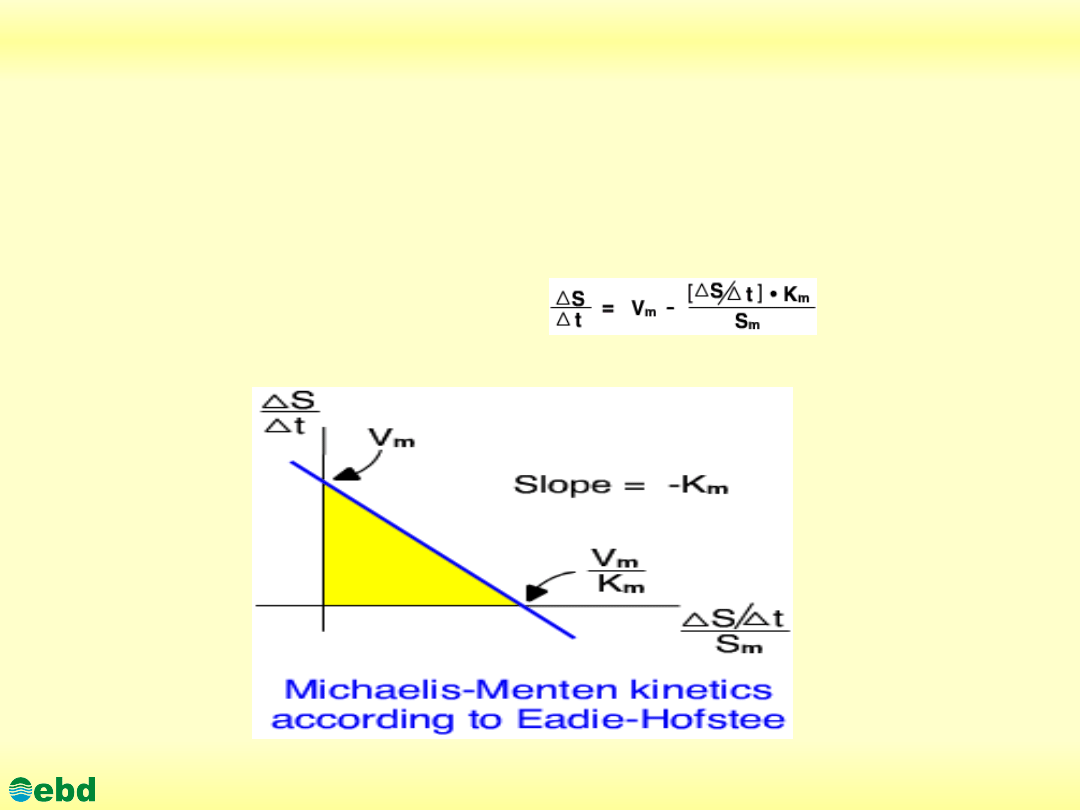
3.1. Kinetyka reakcji enzymatycznych
Determination of V
m
and K
m
Linear representation of the the Michaelis-Menten Equation
Eadie-Hofstee equation
http://kbs.ise.polsl.pl
Environmental Biotechnology Department, SUT
3. Biochemia dynamiczna
3.1. Kinetyka reakcji enzymatycznych
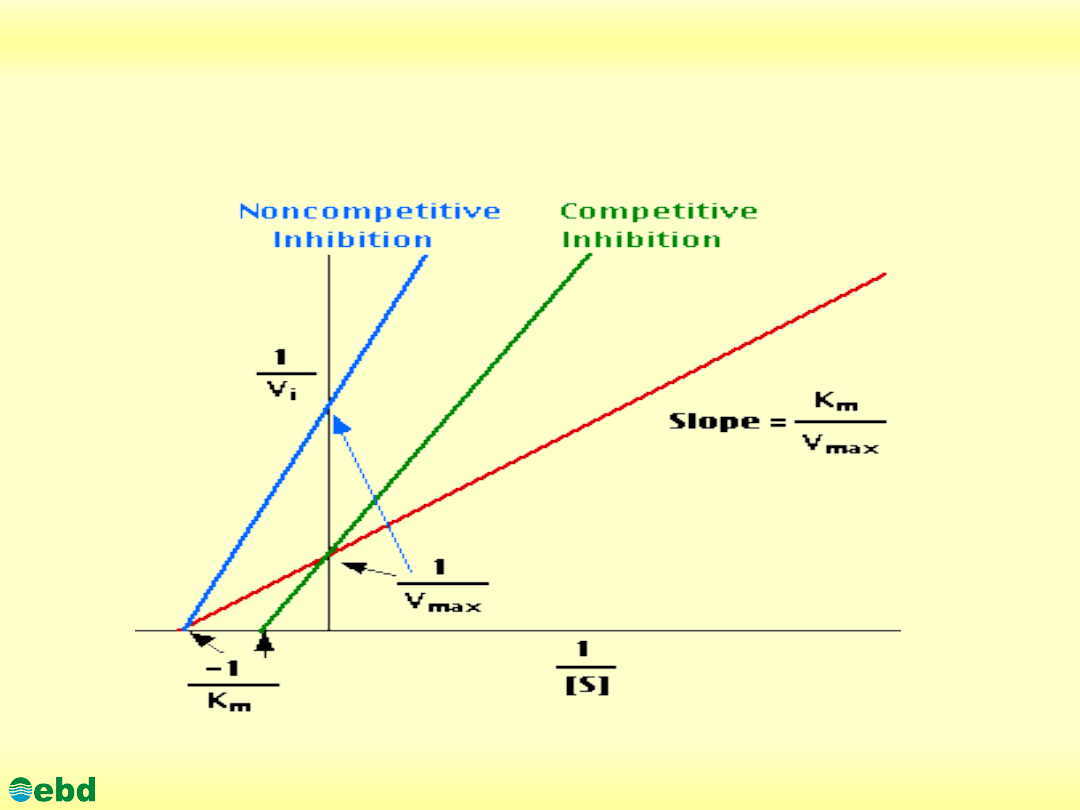
http://kbs.ise.polsl.pl
Environmental Biotechnology Department, SUT
3. Biochemia dynamiczna
3.1. Kinetyka reakcji enzymatycznych
http://kbs.ise.polsl.pl
Environmental Biotechnology Department, SUT
3. Biochemia dynamiczna
3.1. Kinetyka reakcji enzymatycznych
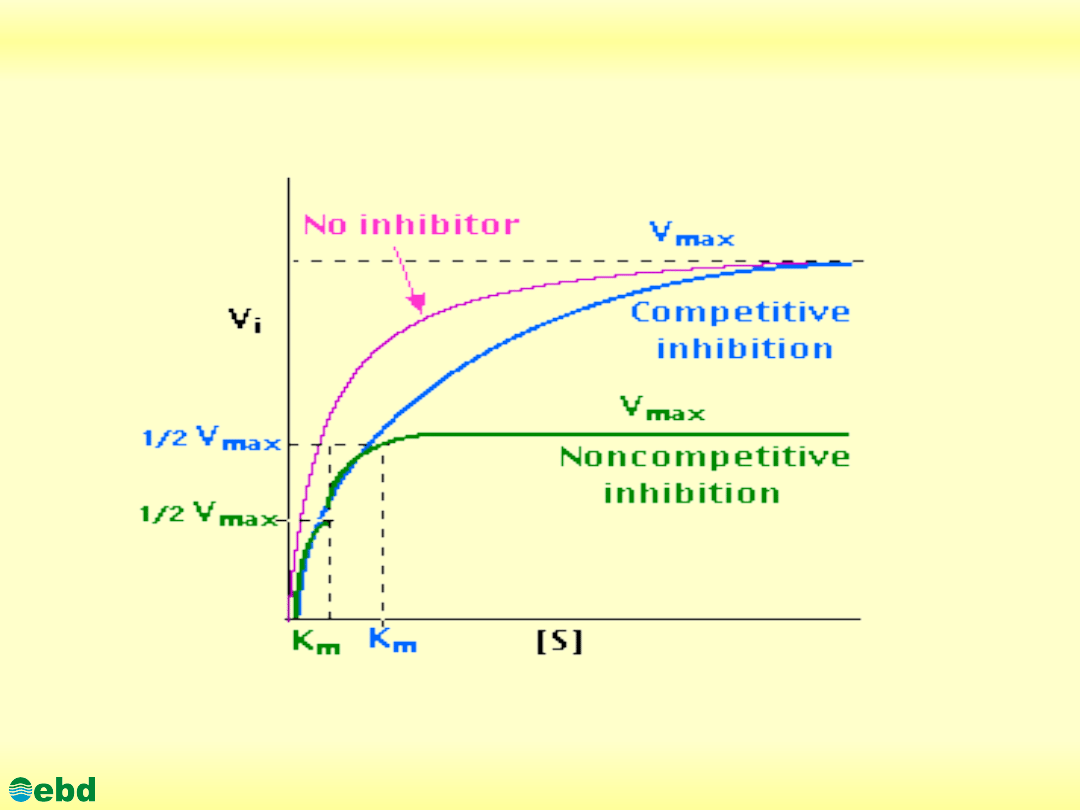
Efekt allosteryczny

http://kbs.ise.polsl.pl
Environmental Biotechnology Department, SUT
3. Biochemia dynamiczna
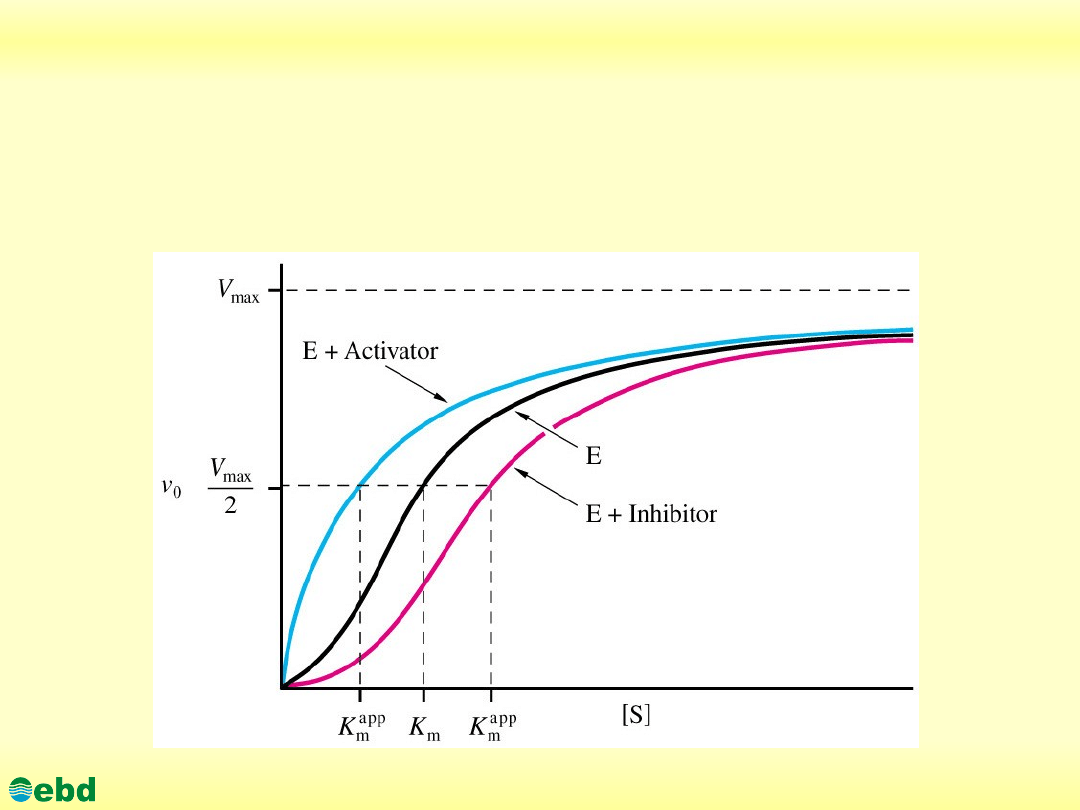
3.1. Kinetyka reakcji enzymatycznych
The activity of an allosteric enzyme with a sigmoidal binding curve
(black line) can be altered markedly when either an activator (blue
line) or inhibitor (red line) is bound to the enzyme. Addition of an
activator can lower the apparent Km, raising the activity at a given
[S]. Conversely, the addition of an inhibitor can raise the apparent
Km, producing less activity at a given [S].
The activated (blue) curve is ~hyperbolic. In the presence of
activator, the enzyme appears to be in the R-form. In the absence of
the activator or the presence of inhibitor (black and red curves)
appear to have decreasing R-form characteristics and more the
curve of the T-form of the allosteric enzyme.
http://kbs.ise.polsl.pl
Environmental Biotechnology Department, SUT
3. Biochemia dynamiczna
3.1. Kinetyka reakcji enzymatycznych
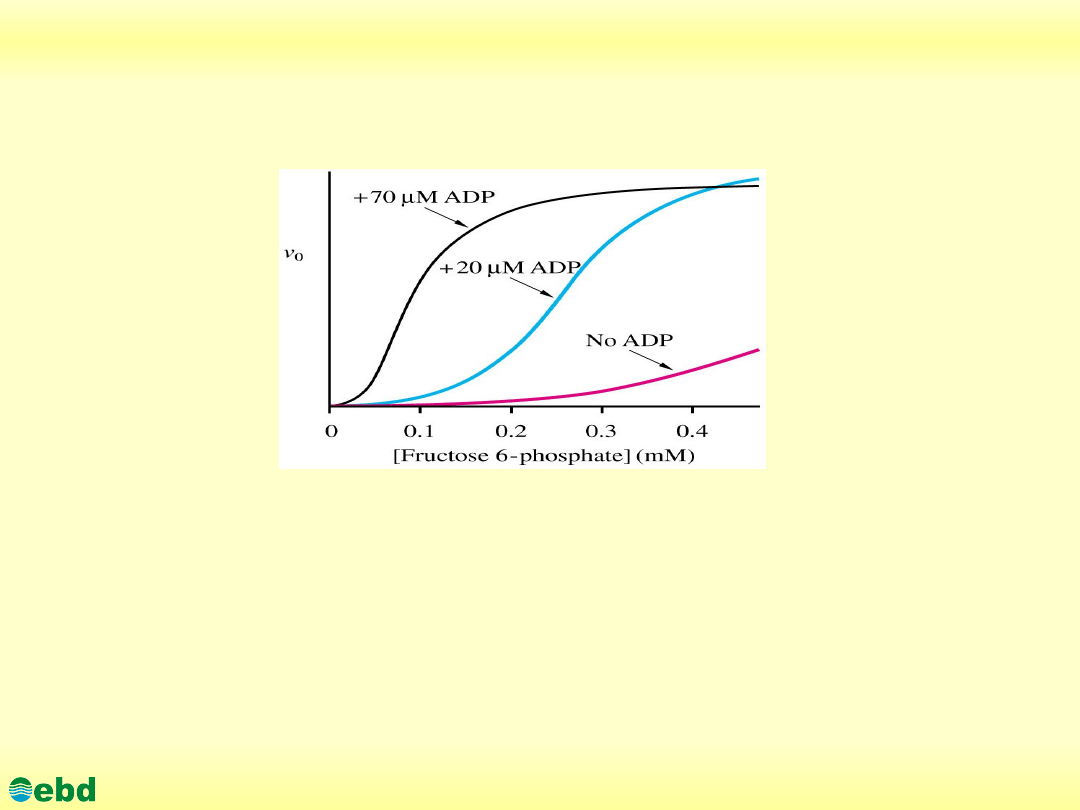
Shown are plots of initial velocity versus [fructose-6-phosphate] for
phosphofructokinase-1 from E. coli. Increasing the concentration of ADP decreases
the apparent Km without affecting Vmax. The concentration of ATP is 0.1mM.
[Adapted from Blangy, S., Buc, H., and Monod, J. (1968). Kinetics of the allosteric
interactions of phosphofructokinase from Escherichia coli. J. Mol. Biol. 31:13-35]
Non-covalent activation of an enyzme is possible through allostery through
cooperative binding of affector molecules. Increasing substrate increases the fraction
of enzyme in the R structure. The addition of ADP has the same effect. At
70micromolar ADP and 100micromolar ATP the plot shows that PFK-1 is almost
entirely in the R-form.
http://kbs.ise.polsl.pl
Environmental Biotechnology Department, SUT
O
2-
0,5 O
2
Q
QH
2
NAD
+
NADH
2
2 Fe
3+
2 Fe
2+
2 Fe
3+
2 Fe
2+
FADH
2
FAD
2 Fe
2+
2 Fe
3+
2 Fe
2+
2 Fe
3+
CoQ
Cyt. b
Cyt. c
1
Cyt. a
Cyt. a
3
AH
2
A
ATP
2 H
+
O
2-
0,5 O
2
Q
QH
2
NAD
+
NADH
2
2 Fe
3+
2 Fe
2+
2 Fe
3+
2 Fe
2+
FADH
2
FAD
2 Fe
2+
2 Fe
3+
2 Fe
2+
2 Fe
3+
CoQ
Cyt. b
Cyt. c
1
Cyt. a
Cyt. a
3
AH
2
A
ATP
ATP
2 H
+
O
2-
0,5 O
2
Q
QH
2
NAD
+
NADH
2
2 Fe
3+
2 Fe
2+
2 Fe
3+
2 Fe
2+
FADH
2
FAD
2 Fe
2+
2 Fe
3+
2 Fe
2+
2 Fe
3+
CoQ
Cyt. b
Cyt. c
1
Cyt. a
Cyt. a
3
AH
2
A
ATP
ATP
ATP
2 H
+
O
2-
0,5 O
2
Q
QH
2
NAD
+
NADH
2
2 Fe
3+
2 Fe
2+
2 Fe
3+
2 Fe
2+
FADH
2
FAD
2 Fe
2+
2 Fe
3+
2 Fe
2+
2 Fe
3+
CoQ
Cyt. b
Cyt. c
1
Cyt. a
Cyt. a
3
AH
2
A
H
2
O
ATP
ATP
ATP
2 H
+
O
2-
0,5 O
2
Q
QH
2
NAD
+
NADH
2
2 Fe
3+
2 Fe
2+
2 Fe
3+
2 Fe
2+
FADH
2
FAD
2 Fe
2+
2 Fe
3+
2 Fe
2+
2 Fe
3+
CoQ
Cyt. b
Cyt. c
1
Cyt. a
Cyt. a
3
AH
2
A
3. Biochemia dynamiczna
3.2. Utlenianie biologiczne - łańcuch oddechowy
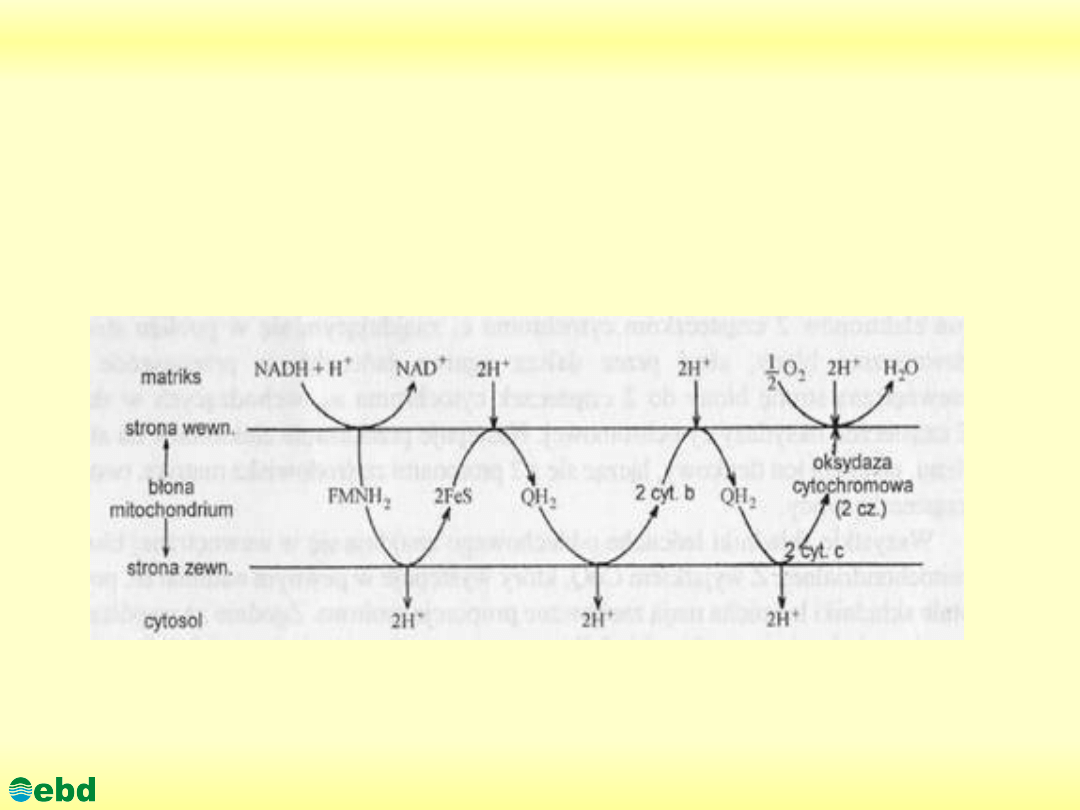
http://kbs.ise.polsl.pl
Environmental Biotechnology Department, SUT
3. Biochemia dynamiczna
3.1. Utlenianie biologiczne - łańcuch oddechowy
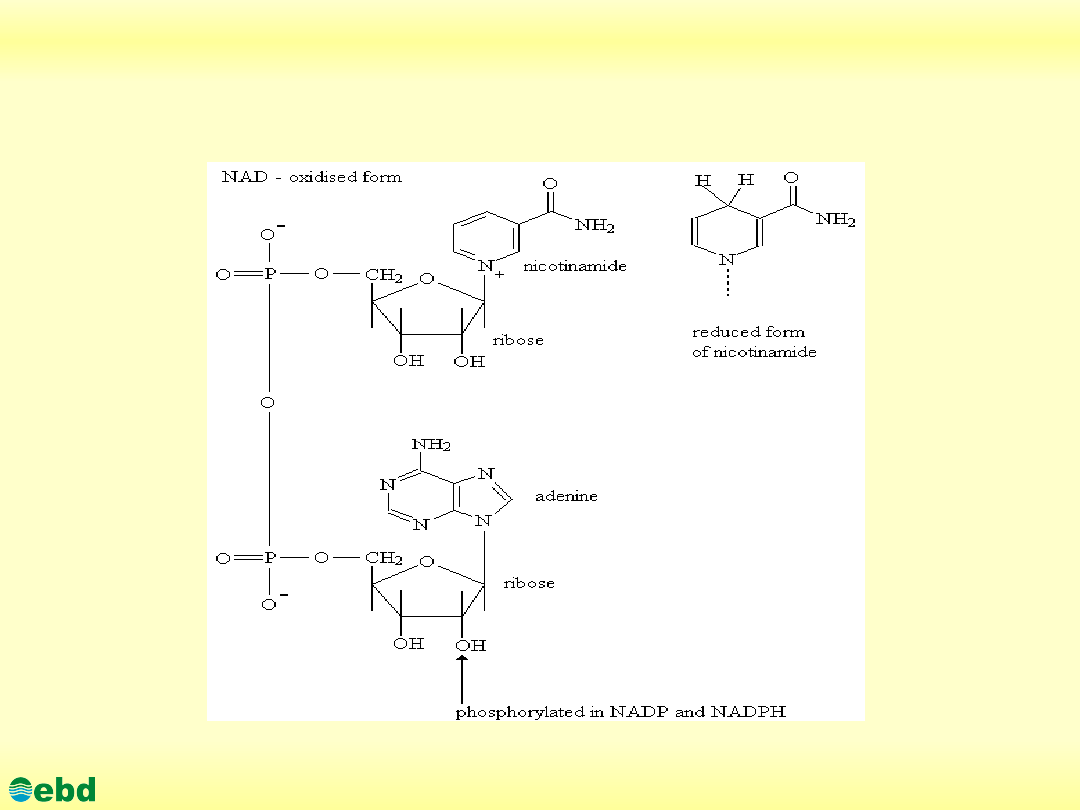
http://kbs.ise.polsl.pl
Environmental Biotechnology Department, SUT
3. Biochemia dynamiczna
3.1. Utlenianie biologiczne - łańcuch oddechowy
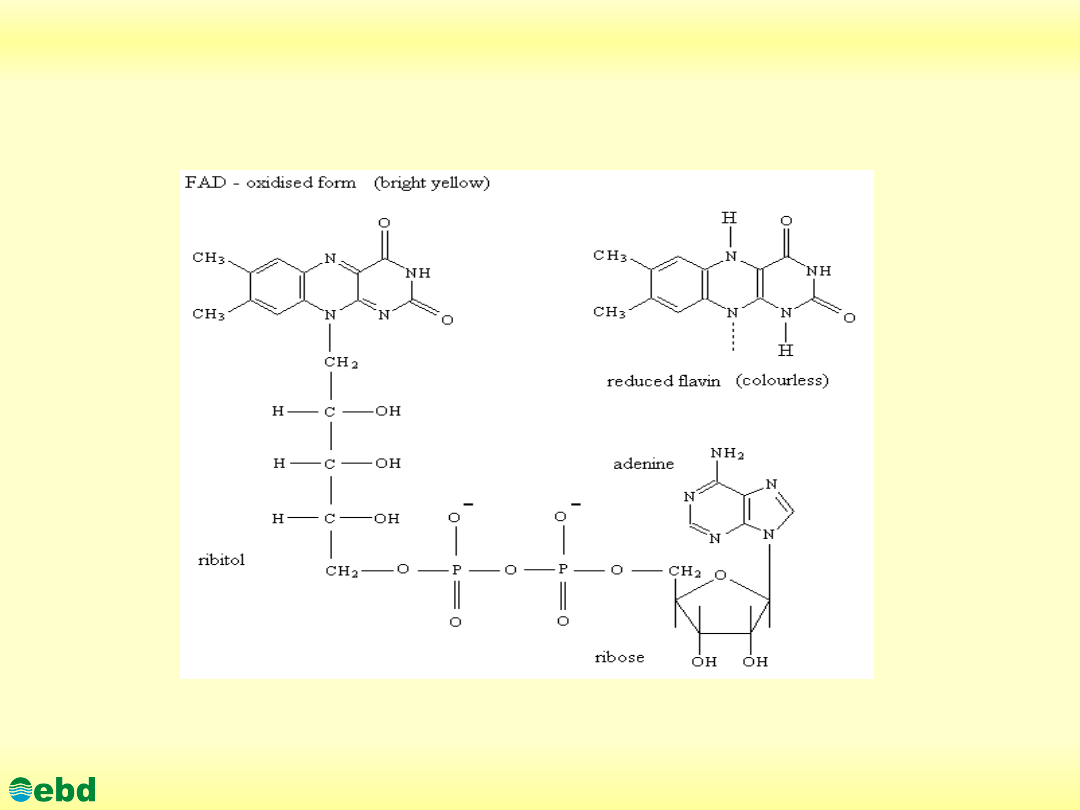
http://kbs.ise.polsl.pl
Environmental Biotechnology Department, SUT
3. Biochemia dynamiczna
3.1. Utlenianie biologiczne - łańcuch oddechowy
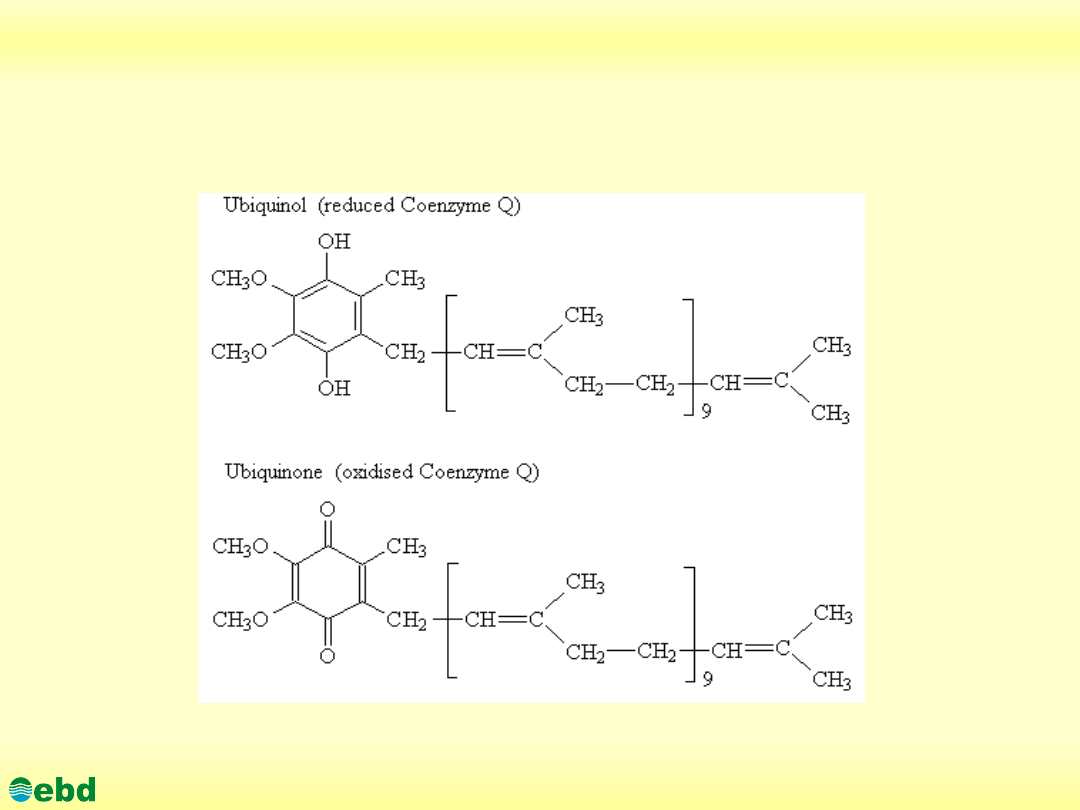
http://kbs.ise.polsl.pl
Environmental Biotechnology Department, SUT
3. Biochemia dynamiczna
3.1. Utlenianie biologiczne - łańcuch oddechowy
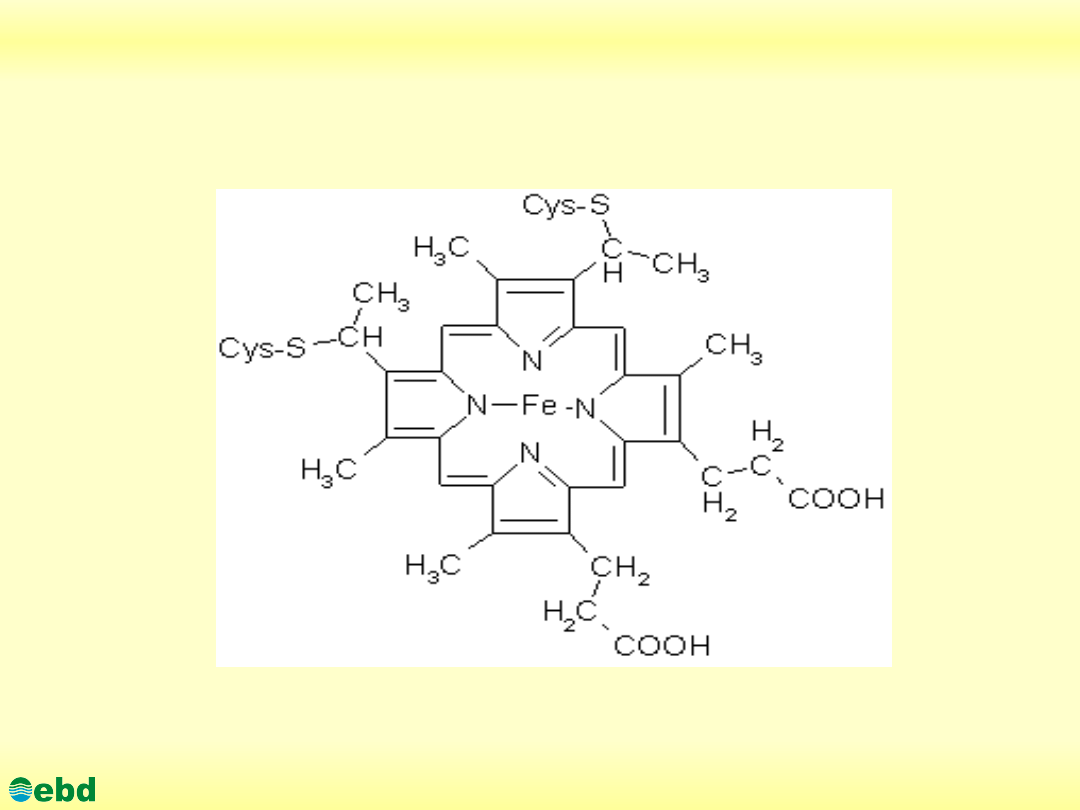
http://kbs.ise.polsl.pl
Environmental Biotechnology Department, SUT
3. Biochemia dynamiczna
3.1. Utlenianie biologiczne - łańcuch oddechowy
Cytochrom C

http://kbs.ise.polsl.pl
Environmental Biotechnology Department, SUT
3. Biochemia dynamiczna
3.1. Utlenianie biologiczne - łańcuch oddechowy
Cytochrom C
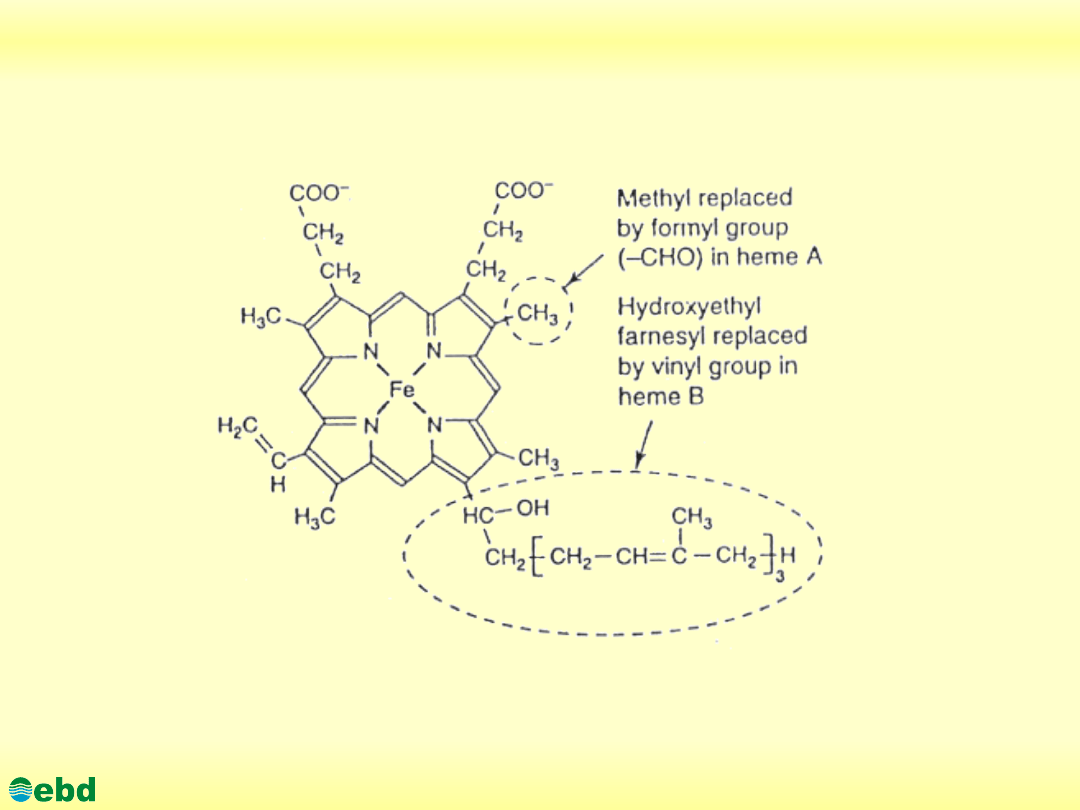
http://kbs.ise.polsl.pl
Environmental Biotechnology Department, SUT
3. Biochemia dynamiczna
3.1. Utlenianie biologiczne - łańcuch oddechowy
Oksydaza cytochromowa
(forma 0)
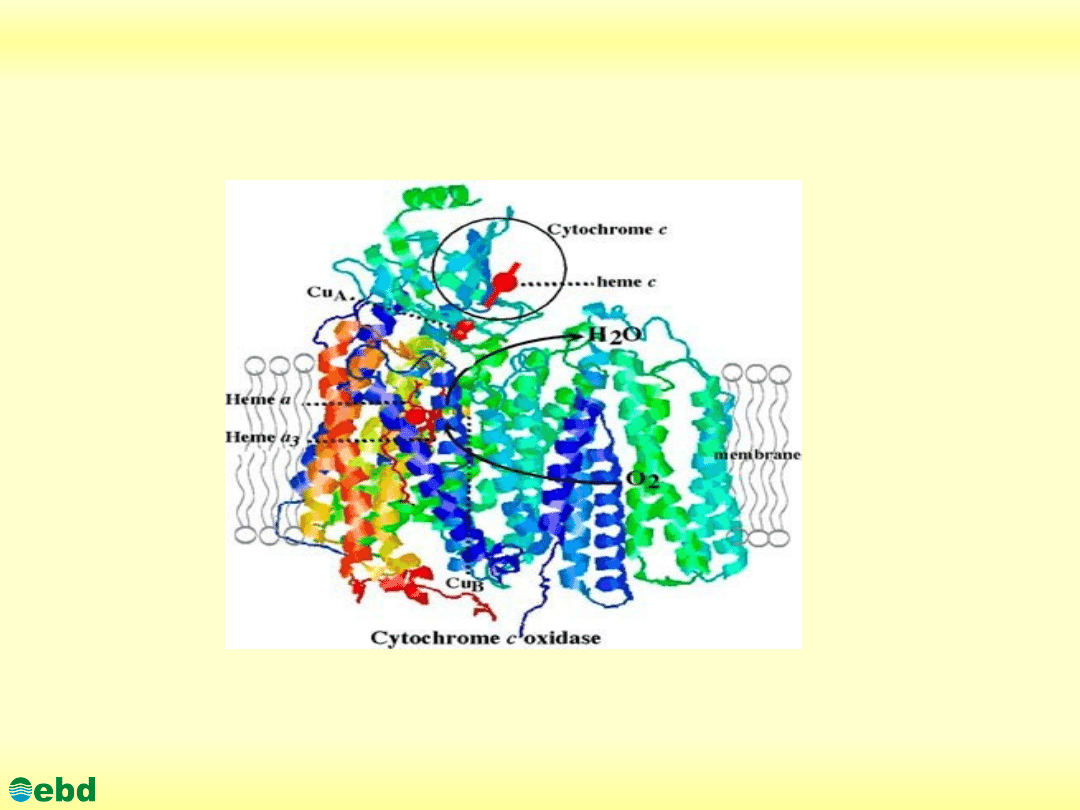
http://kbs.ise.polsl.pl
Environmental Biotechnology Department, SUT
3. Biochemia dynamiczna
3.1. Utlenianie biologiczne - łańcuch oddechowy
Oksydaza cytochromowa
Wyszukiwarka
Podobne podstrony:
2010 w09a Teoria kinetyczna gaz Nieznany (2)
03 i 04 BIOCHEMIA kataliza kinetykaid 4367 ppt
Kraking katalityczny id 250043 Nieznany
Biochemia wykład 3 i 4 Kataliza, kinetyka
Fizyka 2 3 teoria kinetyczna id Nieznany
kataliza id 233134 Nieznany
11 Kinetykaid 12436 Nieznany (2)
4 Badanie kinetyki reakcji zmy Nieznany (2)
04 Kinetyka reakcji chemicznych i kataliza
kinetyka 5 11 2010 id 235066 Nieznany
Kinetyka suszenia fluidalnego, Nieznany
09 Utlenianie 2005id 8028 Nieznany (2)
4 Kinetyka id 37668 Nieznany (2)
Silniki spalinowe, 10.13-Wplyw utleniajacego reaktora katalitycznego na emisje silnika ZS, LABORATOR
więcej podobnych podstron