I
II
III
Pierwiastki i związki chemiczne_ćw _r_27
Informacje do zadań 1 i 2.
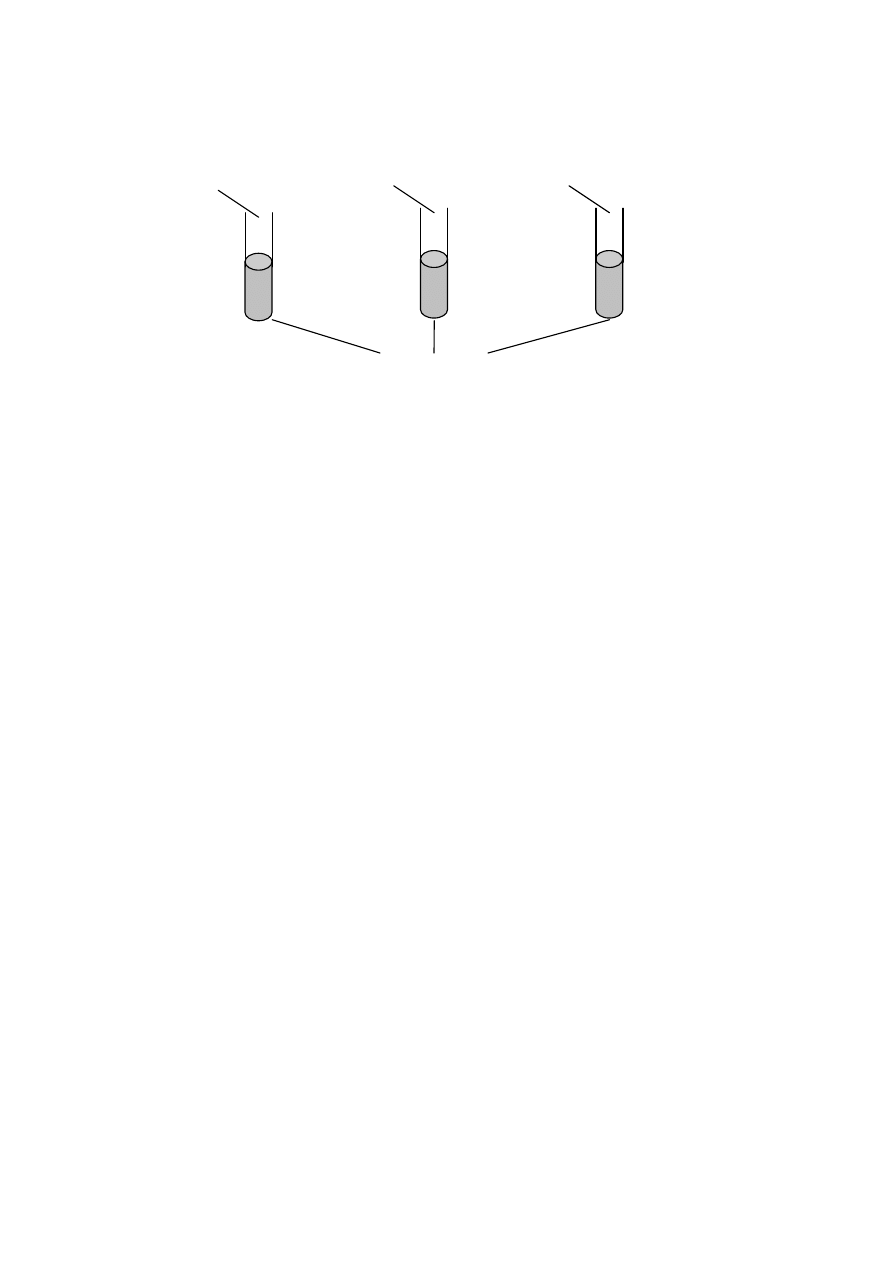
Przeprowadzono doświadczenie, które zostało przedstawione na rysunku.
oranż metyklowy
H
2
SO
4
NaOH
NH
4
Cl + H
2
O
Zad.1 (0 – 3pkt)
Napisz, jakie zmiany zaobserwowano w poszczególnych probówkach.
……………………………………………………………………………………………………………………...
……………………………………………………………………………………………………………………...
……………………………………………………………………………………………………………………...
Zad.2 (0 – 3pkt)
Napisz w formie jonowej skróconej równania reakcji opisanych w informacji wstępnej.
……………………………………………………………………………………………………………………...
……………………………………………………………………………………………………………………...
……………………………………………………………………………………………………………………...
Zad.3 (0 – 3pkt)
Zaprojektuj doświadczenie pozwalające określić charakter chemiczny tlenku magnezu.
a) Narysuj schemat doświadczenia
b) Napisz przewidywane obserwacje.
c) Podaj wniosek i zapisz w formie cząsteczkowej równanie reakcji
……………………………………………………………………………………………………………………...
…………………………………………………………………………………………………………..…
…………...
…………………………………………………………………….
…………………………………………………………………….
…………………………………………………………………….
…………………………………………………………………….
…………………………………………………………………….

Zad.4 (0 – 1pkt)
Spośród podanych związków wskaż te, które są kwasami o właściwościach utleniających:
H
2
SO
4
, HCl, HNO
2
, HClO
4
, HBr, H
2
SiO
3
,
……………………………………………………………………………………………………………………...
Zad.5 (0 – 2pkt)
Tlenek pierwiastka X o wzorze X
2
O
3
ulega reakcjom, które zostały przedstawione za pomocą podanych
równań:
X
2
O
3
+ 6 OH
–
2
3
3
XO
+ 3 H
2
O
X
2
O
3
+ 6 H
+
2
3
X
+ 3 H
2
O
a) Określ charakter chemiczny tego tlenku. ………………………………………………………………….
b) Podaj symbol przykładowego pierwiastka z bloku energetycznego p, który tworzy tlenek spełniający
powyższe warunki
…………………………………………………………………………………………..
Zad.6 (0 – 1pkt)
Aby porównać moc kwasów, przeprowadzono pewne doświadczenia. Wnioski zapisano w postaci równań
reakcji. Uszereguj podane kwasy według ich malejącej mocy.
K
2
SO
3
+ 2 HCl
2 KCl + SO
2
+ H
2
O
K
2
S + 2 HCl
2 KCl + H
2
S
(g)
H
2
SO
3
+ K
2
S
K
2
SO
3
+ H
2
S
(g)
........……………………………………………………………………………...
Zad.7 (0 – 2pkt)
Stężony kwas azotowy(V) reaguje z węglem., w wyniku czego powstaje tlenek węgla(IV), tlenek azotu(II) oraz
woda.
a) Napisz równanie opisanej reakcji
……………………………………………………………………………………………………………………...
…………………………………………………………………………………………………………..…
…………...
c) Określ, jaką właściwość stężonego kwasu azotowego(V) opisuje ta reakcja.
……………………………………………………………………………………………………………………...
…………………………………………………………………………………………………………..…
…………...
Zad.8 (0 – 4pkt)
Zaprojektuj doświadczenie potwierdzające właściwości amfoteryczne tlenku glinu.
a) Narysuj schemat doświadczenia
b) Napisz przewidywane obserwacje.
c) Podaj wniosek i zapisz w formie cząsteczkowej równanie reakcji
……………………………………………………………………………………………………………………...
…………………………………………………………………………………………………………..
p i z_s_r_27
…………………………………………………………………….
…………………………………………………………………….
…………………………………………………………………….
…………………………………………………………………….
…………………………………………………………………….
Zad.9 (0 – 3pkt)
Aby otrzymać 1,6 mola wodorofosforanu(V) wapnia, podziałano roztworem kwasu fosforowego(V) na roztwór
wodorotlenku wapnia o stężeniu 20%.
a) napisz równanie opisanej reakcji.
b) Oblicz masę użytego roztworu wodorotlenku wapnia.
Zad.10 (0 – 3pkt)
Zaprojektuj doświadczenie, którego celem jest otrzymanie wodorotlenku chromu(III)
a) Narysuj schemat doświadczenia
b) Napisz przewidywane obserwacje.
c) Podaj wniosek i zapisz w formie cząsteczkowej równanie reakcji
……………………………………………………………………………………………………………………...
………………………………………………………………………………………………………………….…..
……………………………………………………………………………………………………………………...
………………………………………………………………………………………………………………….…..
p i z_s_r_27
…………………………………………………………………….
…………………………………………………………………….
…………………………………………………………………….
…………………………………………………………………….
…………………………………………………………………….
1
2
3
Pierwiastki i związki chemiczne_ćw_r_28
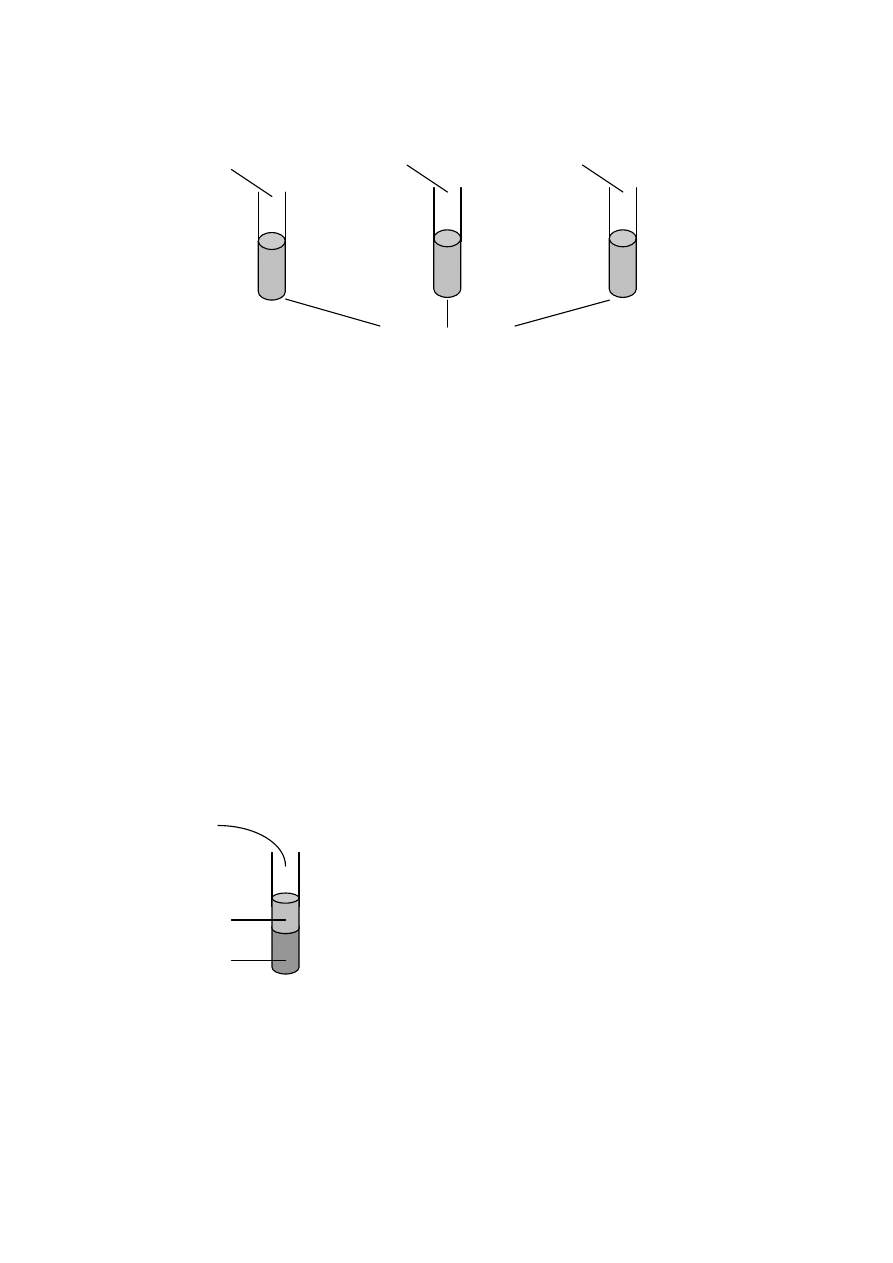
Informacje do zadań 1 i 2.
Przeprowadzono doświadczenie, które zostało przedstawione na rysunku.
fenoloftaleina
HCl
Ba(OH)
2
Wodny roztwór Na
2
CO
3
Zad.1. (0 – 3pkt)
Napisz jakie zmiany zaobserwowano w poszczególnych probówkach.
……………………………………………………………………………………………………………………...
……………………………………………………………………………………………………………………...
……………………………………………………………………………………………………………………...
……………………………………………………………………………………………………………………...
……………………………………………………………………………………………………………………...
Zad.2. (0 – 3pkt)
Napisz w formie skróconej jonowej równania przedstawionych reakcji.
……………………………………………………………………………………………………………………...
……………………………………………………………………………………………………………………...
……………………………………………………………………………………………………………………...
Zad.3. (0 – 4pkt)
Przeprowadzono doświadczenie pokazane na rysunku.
Wodny roztwór KI
benzen
woda bromowa
a) Napisz, jakie zmiany zaobserwowano w obu warstwach.
……………………………………………………………………………………………………………………...
……………………………………………………………………………………………………………………...
b) Sformułuj wnioski, jakie wynikają z przeprowadzonego doświadczenia.
……………………………………………………………………………………………………………………...
……………………………………………………………………………………………………………………...

Zad.4.(0 – 1pkt)
Spośród podanych wzorów wybierz te, które są wzorami kwasów o właściwościach nieutleniających:
H
2
CO
3
, H
2
SO
3
, HNO
3
, HClO, HBr
……………………………………………………………………………………………………………………...
Zad.5.(0 – 4pkt)
Tlenek chromu(III) ma charakter amfoteryczny. Napisz w postaci cząsteczkowej i jonowej skróconej równania
reakcji ilustrujące te wiadomości.
……………………………………………………………………………………………………………………...
……………………………………………………………………………………………………………………...
Zad.6 (0 – 2pkt)
Do wodnego roztworu krzemianu sodu wprowadzono tlenek węgla(IV).
a) Napisz, jakie zmiany zaobserwowano w probówce.
……………………………………………………………………………………………………………………...
……………………………………………………………………………………………………………………...
b) Sformułuj wniosek dotyczący właściwości kwasu węglowego.
……………………………………………………………………………………………………………………...
……………………………………………………………………………………………………………………...
Zad.7 (0 – 3pkt)
Stężony kwas azotowy(V) reaguje z węglem, w wyniku czego powstaje tlenek węgla(IV), tlenek azotu(II) oraz
woda.
a) Napisz równanie opisanej reakcji, dobierając współczynniki stechiometryczne metodą bilansu
elektronowego.
……………………………………………………………………………………………………………………...
……………………………………………………………………………………………………………………...
……………………………………………………………………………………………………………………...
……………………………………………………………………………………………………………………...
……………………………………………………………………………………………………………………...
……………………………………………………………………………………………………………………...
……………………………………………………………………………………………………………………...
b) Określ, jaka właściwość stężonego kwasu azotowego(V) opisuje ta reakcja
……………………………………………………………………………………………………………………...
……………………………………………………………………………………………………………………...
……………………………………………………………………………………………………………………...
……………………………………………………………………………………………………………………...
………………………………………………………………………………………………………...……………
p i z_ć_r 28
1
2
Zad.8 (0 – 4pkt)
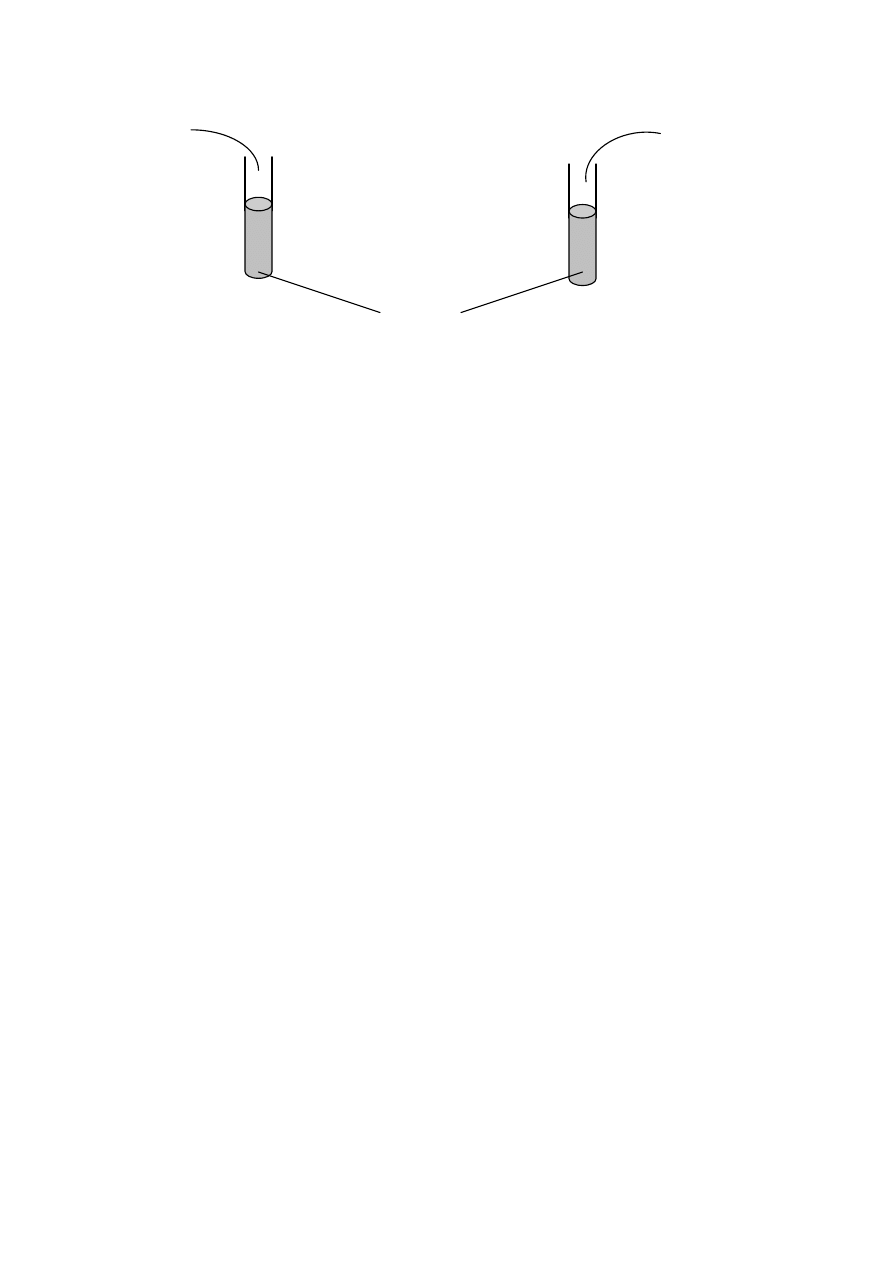
Przeprowadzono doświadczenie przedstawione na rysunku.
roztwór wodny zawierający
roztwór wodny zawierający
0,3 mola NaOH
1 mola NaOH
Roztwór wodny zawierający 0,1 mola AlCl
3
a) Napisz, jakie zmiany zaobserwowano w obu probówkach.
……………………………………………………………………………………………………………………...
……………………………………………………………………………………………………………………...
……………………………………………………………………………………………………………………...
b) Zapisz w formie jonowej skróconej równania reakcji, które zaszły w probówkach
……………………………………………………………………………………………………………………...
……………………………………………………………………………………………………………………...
Zad.9 (0 – 2pkt)
Proces oczyszczania ścieków jest wieloetapowy. Jeden z etapów ma na celu wytrącenie jonów metali ciężkich
w postaci trudnorozpuszczalnych soli.
a) Zaproponuj sposób usunięcia jonów ołowiu(II).
……………………………………………………………………………………………………………………...
b) Napisz równanie reakcji w formie jonowej skróconej.
……………………………………………………………………………………………………………………...
Zad.10 (0 – 3pkt)
Zaproponuj doświadczenie , którego celem jest otrzymanie wodorotlenku miedzi(II)
d) Narysuj schemat doświadczenia
e) Napisz przewidywane obserwacje.
f) Podaj wniosek i zapisz w formie cząsteczkowej równanie reakcji.
……………………………………………………………………………………………………………………...
…………………………………………………………………………………………………………..…
p i z_ć_r 28
…………………………………………………………………….
…………………………………………………………………….
…………………………………………………………………….
…………………………………………………………………….
…………………………………………………………………….
Wyszukiwarka
Podobne podstrony:
pierwiastki i związki zadania4
pierwiastki i związki zadania5
pierwiastki i związki zadania 2
Pierwiastki Zadanie domowe [PDF], Pierwiastki Rozwiązanie zadania domowego
Właściwości niektórych pierwiastków i związków nieorganicznych(1), podręczniki szkoła średnia liceum
Pierwiastki i związki chemiczne a zanieczyszczenia środowiska
PIERWIASTKI I ZWIĄZKI CHEMICZNE
ChO Wykrywanie pierwiastków związków nienasyconych i pierścieniowych, Technologia Żywnośći UR, I rok
JAKOŚCIOWE OZNACZANIE WYBRANYCH PIERWIASTKÓW W ZWIĄZKACH ORGANICZNYCH
pierwiasti i związki chemiczne
ZESTAW II - pierwiastki, związki, 1) Związki azotu i wodoru: NH3, NH2OH, N2H4
Pierwiastki Zadanie domowe [PDF], Pierwiastki Rozwiązanie zadania domowego
06 4 Mangan i jego związki zadania do lekcji nr 2
Pierwiastki i związki chemiczne
07 4 Chrom i jego związki zadania do lekcji nr 2
więcej podobnych podstron