Pierwiastki i związki chemiczne_ćw_p_27
Zad.1. (0 – 4pkt)
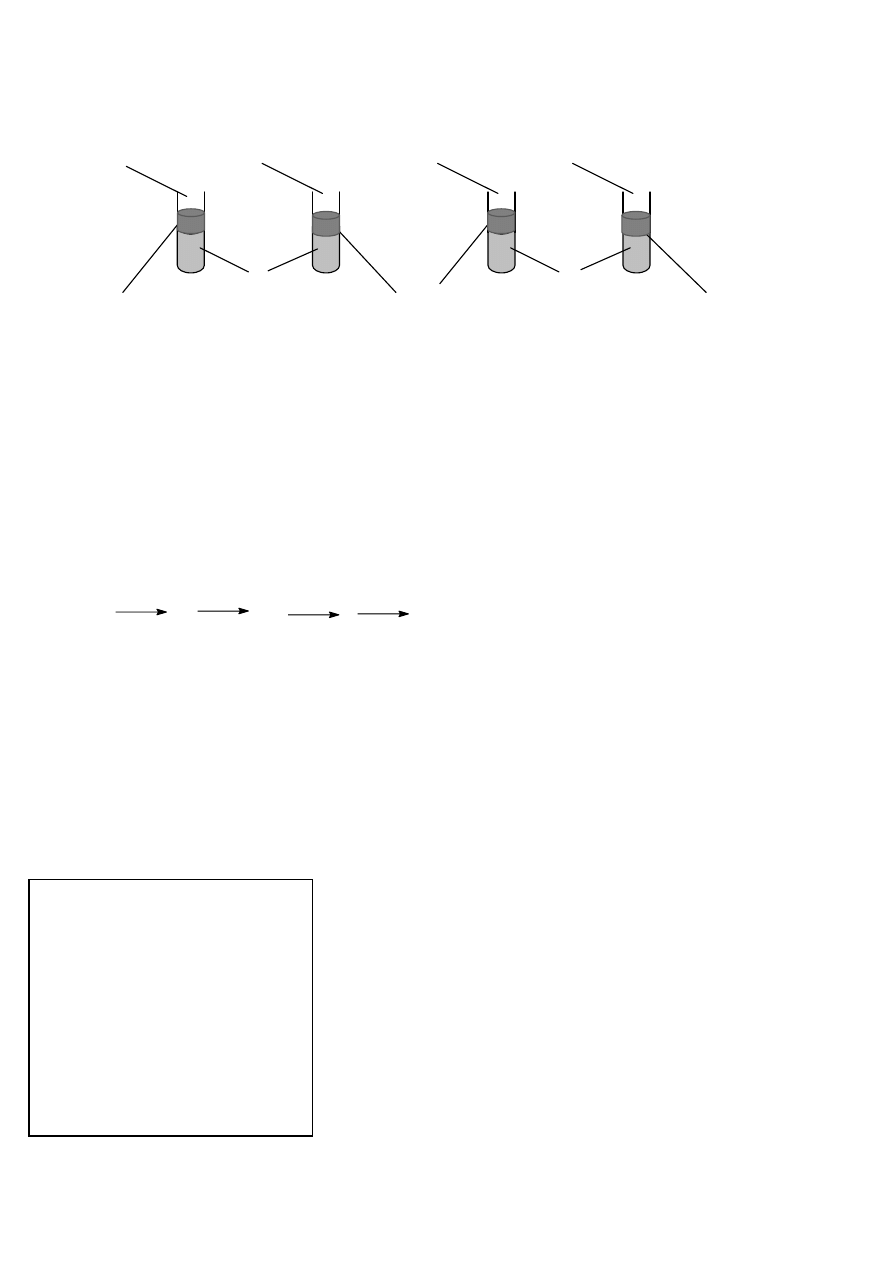
Przeprowadzono doświadczenie, które zostało przedstawione na rysunkach.
Cl
2
Br
2
Cl
2
J
2
KJ KBr
chloroform chloroform chloroform
Napisz, jakie zmiany zaobserwowano w poszczególnych probówkach. Odpowiedź uzasadnij równaniami
reakcji.
……………………………………………………………………………………………………………………
……………………………………………………………………………………………………………………
……………………………………………………………………………………………………………………
……………………………………………………………………………………………………………………
……………………………………………………………………………………………………………………
Zad.2 (0 – 4pkt)
Napisz równania reakcji przedstawione na podanym schemacie e formie cząsteczkowej.
C
CO
CO
2
X
CO
2
Ca(OH)
2
……………………………………………………………………………………………………………………
……………………………………………………………………………………………………………………
……………………………………………………………………………………………………………………
……………………………………………………………………………………………………………………
Zad.3 (0 – 3pkt)
Zaprojektuj doświadczenie pozwalające określić charakter chemiczny tlenku magnezu.
a) narysuj schemat doświadczenia.
b) Napisz obserwacje.
c) Zapisz wniosek i poprzyj go równaniem reakcji.
……………………………………………………………………………………………………………………
……………………………………………………………………………………………………………………
………………………………………………………………………
………………………………………………………………………
………………………………………………………………………
………………………………………………………………………
………………………………………………………………………
………………………………………………………………………
………………………………………………………………………
………………………………………………………………………

Zad.4 (0 – 2pkt)
W tabeli zostały przedstawione właściwości fizyczne wybranych związków.
Wzór
substancji
Temperatura
topnienia [
C]
Temperatura
wrzenia [
C]
Rozpuszczalność
g/100g H
2
O (20
C)
Rozpuszczalność
g/100g H
2
O (100
C)
Na
2
CO
3
858
(r*)
21,8
44,6
KOH
405
1322
85
581,6
PbSO
4
1000(r*)
(r*)
0,0045
0,0057
LiF
849
1670
0,27
0,135
Li
2
CO
3
732
1310(r*)
1,35
0,72
(r*) – związek się rozkłada
Na podstawie danych z tabeli podaj:
a) wzór związku o najwyższej temperaturze topnienia, którego rozpuszczalność w wodzie maleje wraz ze
wzrostem temperatury;
……………………………………………………………………………………..
b) wzory związków, które ulegają rozkładowi podczas ogrzewania.
……………………………………………………………………………………………………………..
Zad.5 (0 – 1pkt)
Aby porównać moc wodorotlenków przeprowadzono doświadczenie, z którego wniosek zapisano w postaci
równania reakcji:
2 NaOH +
Cu(OH)
2
CuCl
2
+ 2 NaCl
Wskaż wodorotlenek o większej mocy. …………………………………………………………………………..
Zad.6 (0 – 1pkt)
Podane równania reakcji opisują jedną z właściwości stężonego kwasu siarkowego(VI).
Cu
CuSO
4
+
+
+
H
2
SO
4
2
SO
2
H
2
O
2
C
H
2
SO
4
2
+
2 SO
2
+ CO
2
H
2
O
2
+
2 HBr + H
2
SO
4
Br
2
SO
2
H
2
O
2
+
+
Określ, czy stężony kwas siarkowy(VI) jest w tych reakcjach utleniaczem, czy reduktorem.
……………………………………………………………………………………………………………………
Zad.7 (0 – 2pkt)
Oblicz zawartość procentową żelaza w węglanie żelaza(III).
p i z_ ć_p_27
Zad.8 (0 – 3pkt)
Aby otrzymać 58g siarczanu(VI) miedzi(II), zmieszano stechiometryczne ilości kwasu siarkowego(VI) z
tlenkiem miedzi(II). Napisz odpowiednie równanie reakcji i oblicz masę użytego tlenku miedzi(II).
Zad.9 (0 – 4pkt)
Uzupełnij tabelę:
Właściwości
Amoniak (NH
3
)
Siarkowodór (H
2
S)
Stan skupienia
Barwa
Gęstość [g/dm
3
]
Charakter chemiczny
Zad.10 (0 – 5pkt)
Mając do dyspozycji: Ag, Mg, HCl, H
2
O i NaOH zaprojektuj doświadczenie, którego celem będzie porównanie
aktywności magnezu i srebra.
a) Zaprojektuj odpowiedni odczynnik.
b) Przedstaw rysunek doświadczenia.
c) Podaj przewidywane obserwacje.
d) Napisz wniosek oraz odpowiednie równania reakcji.
……………………………………………………………………………………………………………………
……………………………………………………………………………………………………………………
……………………………………………………………………………………………………………………
……………………………………………………………………………………………………………………
……………………………………………………………………………………………………………………
……………………………………………………………………………………………………………………
………………………………………………………………………………………………………p i z_ć_p_27
Pierwiastki i związki chemiczne_ćw_p_28
Zad.1 (0 – 4pkt)
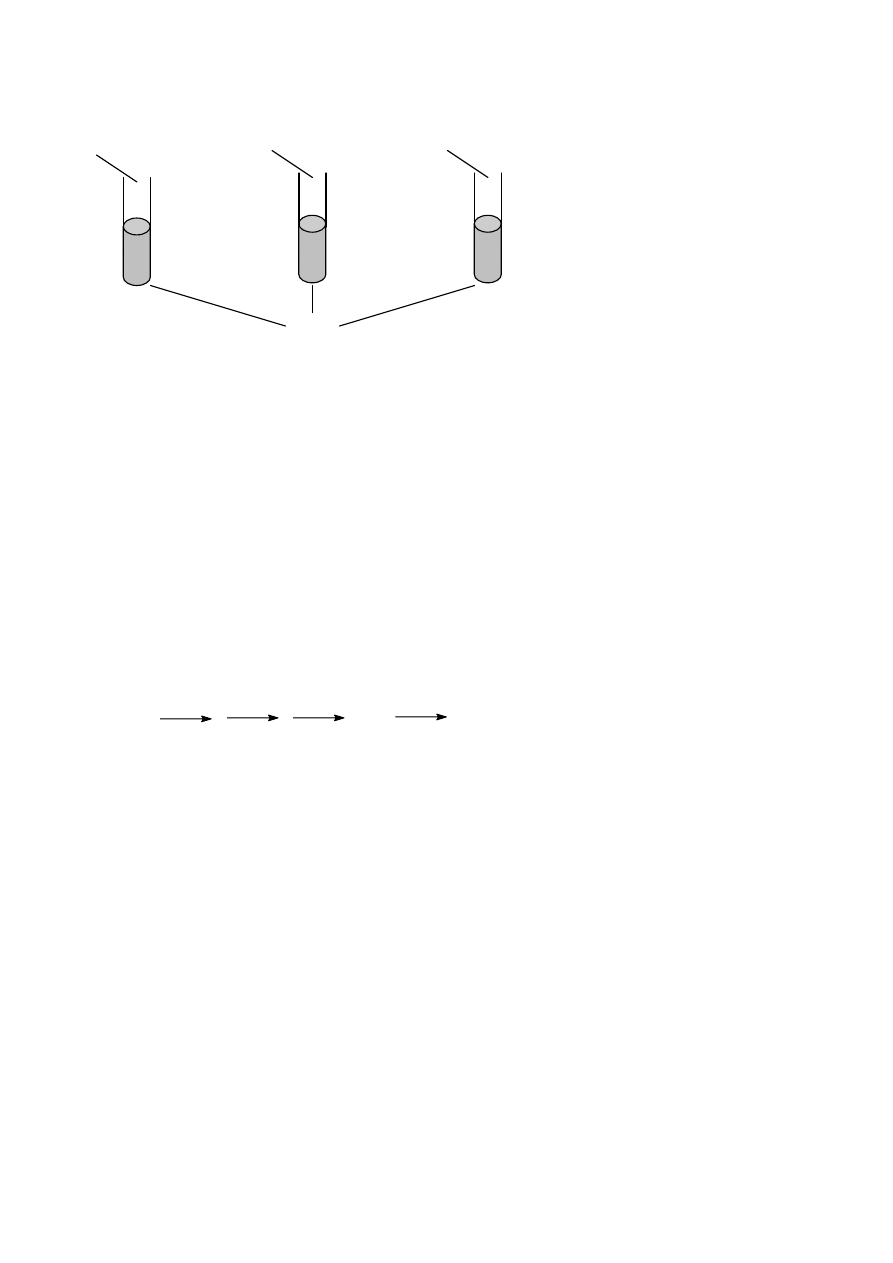
Przeprowadzono doświadczenie, które zostało przedstawione na rysunku.
K
Fe
Ca
H
2
O
a) Napisz, jakie zmiany zaobserwowano w poszczególnych probówkach uwzględniając szybkość przebiegu
reakcji.
……………………………………………………………………………………………………………………...
……………………………………………………………………………………………………………………...
……………………………………………………………………………………………………………………...
……………………………………………………………………………………………………………………...
……………………………………………………………………………………………………………………...
……………………………………………………………………………………………………………………...
b) Uszereguj wymienione metale według rosnącej aktywności chemicznej. ……………………………..……...
Zad.2 (0 – 4pkt)
Na schemacie przedstawiono przemiany, jakim ulega siarka i jej związki.
S
O
2
O
2
H
2
SO
4
X
Y
Z
NaOH
1
2
3
4
a) Podaj wzory sumaryczne i nazwy związków Y i Z
……………………………………………………………………………………………………………………...
b) Napisz w formie cząsteczkowej równania reakcji 1 i 4
……………………………………………………………………………………………………………………...
……………………………………………………………………………………………………………………...
Zad.3. (0 – 3pkt)
Zaprojektuj doświadczenie pozwalające określić charakter chemiczny tlenku siarki(IV).
a) narysuj schemat doświadczenia;
b) zapisz obserwacje;
c) podaj wniosek i równanie reakcji.
………………………………………………………………………
………………………………………………………………………
………………………………………………………………………
………………………………………………………………………

……………………………………………………………………………………………………………………...
……………………………………………………………………………………………………………………...
Zad.4 (0 – 3pkt)
Aby otrzymać 60 g siarczanu(VI) żelaza(III), zmieszano stechiometryczne ilości kwasu siarkowego(VI)
z tlenkiem żelaza(III). Napisz odpowiednie równanie reakcji i oblicz masę zużytego tlenku żelaza(III).
Zad.5. (0 – 1pkt)
Aby porównać aktywność fluorowców, przeprowadzono doświadczenie, z którego wniosek zapisano w postaci
równań reakcji. Uszereguj podane fluorowce według malejącej aktywności.
Cl
2
+ 2 NaBr
2 NaCl
Br
2
+
1)
Cl
2
+
I
2
2 NaI
2)
3)
2 NaCl +
Br
2
+ 2 NaI
2 NaBr + I
2
……………………………………………………………………………………………………………………...
Zad.6. (0 – 2pkt)
Stężony kwas azotowy(V) reaguje z węglem, w wyniku czego powstaje CO
2
, H
2
O i NO
2
.
a) Określ, jakie stopnie utlenienia mają atomy azotu w tej reakcji.
b) Określ, czy stężony kwas azotowy(V) jest w tej reakcji utleniaczem czy reduktorem.
……………………………………………………………………………………………………………………...
……………………………………………………………………………………………………………………...
……………………………………………………………………………………………………………………...
……………………………………………………………………………………………………………………...
……………………………………………………………………………………………………………………...
……………………………………………………………………………………………………………………...
……………………………………………………………………………………………………………………...
……………………………………………………………………………………………………………………...
……………………………………………………………………………………………………………
p i z_ć_p_28
Wyszukiwarka
Podobne podstrony:
pierwiastki i związki zadania4
pierwiastki i związki zadania
pierwiastki i związki zadania5
Pierwiastki Zadanie domowe [PDF], Pierwiastki Rozwiązanie zadania domowego
Właściwości niektórych pierwiastków i związków nieorganicznych(1), podręczniki szkoła średnia liceum
Pierwiastki i związki chemiczne a zanieczyszczenia środowiska
PIERWIASTKI I ZWIĄZKI CHEMICZNE
ChO Wykrywanie pierwiastków związków nienasyconych i pierścieniowych, Technologia Żywnośći UR, I rok
JAKOŚCIOWE OZNACZANIE WYBRANYCH PIERWIASTKÓW W ZWIĄZKACH ORGANICZNYCH
pierwiasti i związki chemiczne
ZESTAW II - pierwiastki, związki, 1) Związki azotu i wodoru: NH3, NH2OH, N2H4
Pierwiastki Zadanie domowe [PDF], Pierwiastki Rozwiązanie zadania domowego
06 4 Mangan i jego związki zadania do lekcji nr 2
Pierwiastki i związki chemiczne
07 4 Chrom i jego związki zadania do lekcji nr 2
więcej podobnych podstron