
SKRYPT DO LABORATORIUM
NAZWA PRZEDMIOTU
Polimery przewodzące
ĆWICZENIE 3: ELEKTROLITY ŻELOWE
autor: prof. dr hab. Anna Lisowska-Oleksiak
Gdańsk,

2
1.
Wymagania wstępne
1.1.Ustawienia
Znajomość instrukcji i treści wykładu dotyczącej zastosowania elektrolitów polimerowych
Cele ćwiczenia:
Wykaz przyrządów, materiałów i aparatury niezbędnej do przeprowadzenia ćwiczenia:
•
reaktor do syntezy materiału żelowego,
•
łaźnia wodna,
•
konduktometr,
Odczynniki chemiczne:
•
polimetakrylan metylu,
•
węglan propylenu,
•
węglan etylenu,
•
dimetyloformamid,
•
ferrocen, K
3
Fe(CN)
6
,
•
kwas salicylowy.
Spodziewane efekty kształcenia - umiejętności i kompetencje:
Poznanie metod wyznaczania przewodności zsyntezowanych materiałów.
Metody dydaktyczne:
Wykonanie syntezy przy kontrolowaniu parametrów fizycznych: mieszanie, temperatura. Pomiar
stałej naczynka. Pomiar przewodności 0.1 M KCl oraz zsyntezowanego elektrolitu żelowego.
Zasady oceniania/warunek zaliczenia ćwiczenia
Prawidłowe wykonanie ćwiczenia laboratoryjnego. Zaliczenie na ocenę pozytywną testu. Wykonanie
sprawozdania z ćwiczenia,.
Wykaz literatury podstawowej do ćwiczenia:
1. Skrypt do ćwiczeń
2. 1. A. Kisza, Elektrochemia Jonika WNT 2002

3
2.
Przebieg ćwiczenia
L.p. Zadanie
1.
Synteza materiału żelowego w reaktorze z kontrolowaną temperaturą
2.
Przygotowanie elektrolitu do pomiarów konduktywności
3.
Montaż celki do pomiaru przewodnictwa
4.
Analiza wyników
5.
Przygotowanie sprawozdania
UWAGI!
2.
Wprowadzenie do ćwiczenia
ELEKTROLITY śELOWE
Zapotrzebowanie na materiały o niskiej emisji par związków organicznych przyczyniło się do
postępu w dziedzinie elektrolitów polimerowych. Klasyczny elektrolit polimerowy to taki, w którym
rozpuszczalnikiem dla soli jest makrocząsteczka polimerowa. Archetypem dla tego typu elektrolitów
jest politlenek etylenu (nazwą zgodna z IUPAC poli(oksyetylen) (CH
3
(CH
2
CH
2
O)
n
CH
3
) z solami litu.
Jak dotąd (2011) nie znalazły one zastosowania komercyjnego w swej czystej formie.
Przyczyną tego faktu jest dość niska przewodność w temperaturach pokojowych. Proponowane są
różnego rodzaju modyfikacje elektrolitów polieterowych. Jednym z istotnych rozwiązań jest
zastosowanie żeli polimerowych, które osiągają znacznie lepsze parametry elektryczne w porównaniu
z elektrolitami bezrozpuszczalnikowymi.
Elektrolit żelowy można zaliczyć do kategorii elektrolitów polimerowych. Elektrolity żelowe
otrzymuje się poprzez spęcznianie polimeru roztworem elektrolitu wodnego lub niewodnego
w zależności od potrzeb. Elektrolity te posiadają przewodnictwo elektryczne porównywalne
z przewodnością elektrolitów ciekłych, jednak zawsze niższe od przewodnictwa użytego elektrolitu do
spęczniania. śelowe elektrolity polimerowe (gel polymer electrolyte ang.) znalazły zastosowanie
między innymi w konstrukcji baterii litowych, urządzeń elektrochromowych, superkondensatorów,
elektrod odniesienia. Konsystencja elektrolitów żelowych do pewnego stopnia zabezpiecza ogniwa
przed zwarciem i wyciekaniem. Elektrolity żelowe nazywane też są „plastycznymi elektrolitami
polimerowymi” lub też „elektrolitami polimerowymi trzeciej generacji”. Pod względem fizycznym są
to lepkie ciecze. Oddziaływania pomiędzy składnikami pozbawione są silnych wiązań chemicznych.
Energia oddziaływań mieści się w zakresie oddziaływań międzycząsteczkowych i najwyższą energią
charakteryzuje się to wiązanie wodorowe do 20 kcal/mol. Brak oddziaływań o wyższej energii
sprawia, iż układy te tracą swoje właściwości, w czasie. Pod wpływem zmian temperatury ulegają
często degradacji, rozwarstwiają się.
Elektrolity żelowe otrzymuje się poprzez wprowadzenie polimeru do elektrolitu ciekłego. śel
posiada kohezję przypisaną ciałom stałym natomiast dyfuzja jonów jest charakterystyczna dla cieczy.
4
Te unikalne właściwości powodują, że żel znalazł wiele istotnych zastosowań jako elektrolit o dużej
lepkości, w skali komercyjnej w akumulatorach bezobsługowych. Dzięki wprowadzeniu matrycy
polimerowej obniżona zostaje znacznie prężność par rozpuszczalników ( w tym wody) [1].
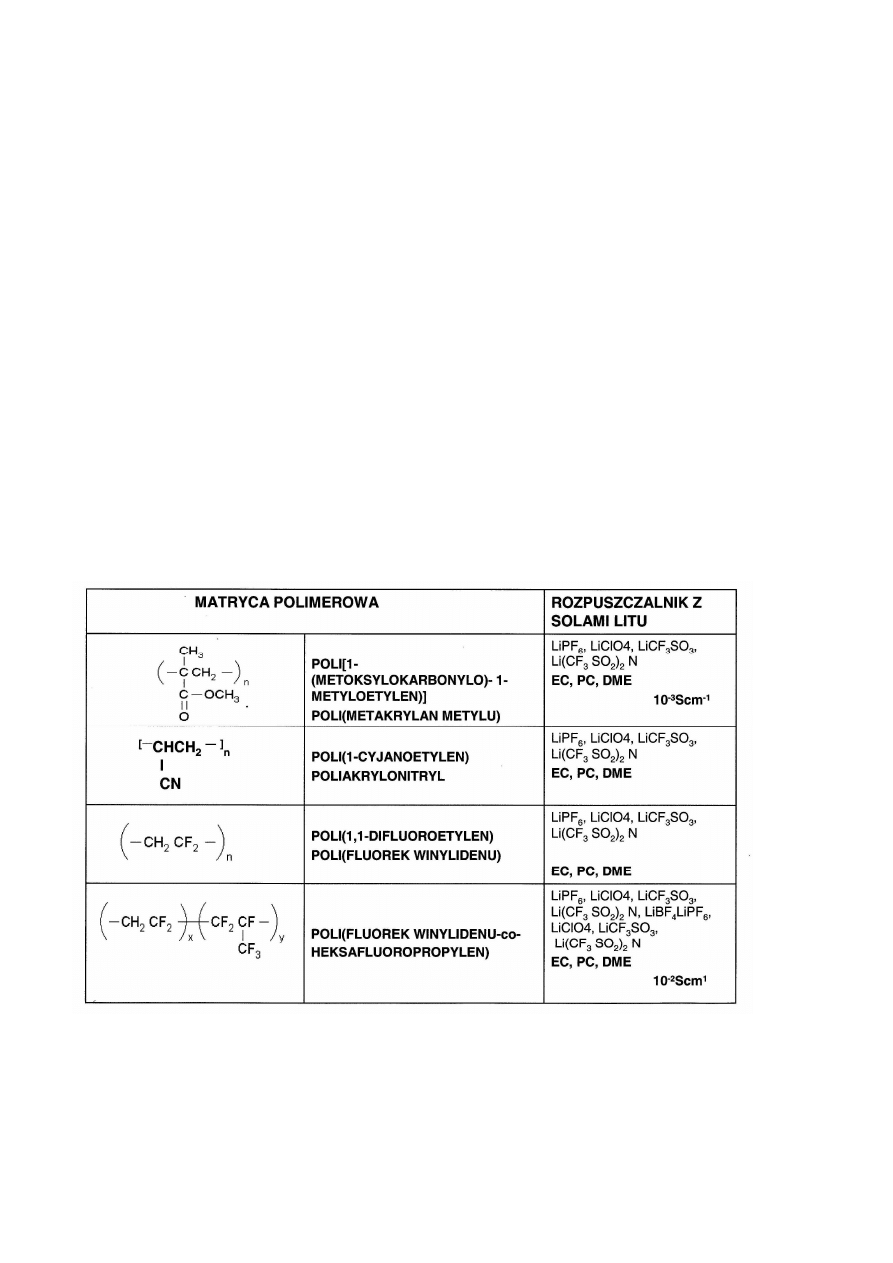
Najczęściej stosowane polimery do otrzymywania elektrolitów żelowych to:
poli(oksyetylen) (PEO), poli(oksypropylen) (PPO), poli(akrylonitryl) (PAN), poli(chlorek winylu)
(PVC), poli(fluorek winylidenu) (PVdF), poli(metakrylan metylu) (PMMA- popularnie zwany pleksi).
Rozpuszczalniki niewodne używane do spęczniania polimeru to węglan propylenu PC, węglan etylenu
EC, tertehydrofuran THF, dimetoksyeter. Rozpuszczalniki wraz z odpowiednimi solami stanowią
elektrolit spęczniający. Wprowadzenie innego rodzaju związków dysocjujących pozwala rozszerzyć
game zastosowań. I tak, wprowadzając do matrycy polimerowej roztwór kwasu, można uzyskać
elektrolit o znaczym przewodnictwie jonów protonowych. Elektrolit uzyskany przez zastosowanie
kwasu salicylowego został zaproponowany do budowy ogniw paliwowych w miejsce membrany
protonowej [ 2].
Tab 1.Przykłady elektrolitów żelowych
Z powyższych polimerów często stosowany ze względu na niska cenę jest PMMA. Polimer ten
wykazuje dobre właściwości żelujące. Lepkość elektrolitu żelowego zależy od ilości PMMA, co więcej
również przewodnictwo jest ściśle związane z ilością polimeru [
i
]. Im większa ilość PMMA tym
przewodnictwo polimeru żelowego jest mniejsze. Wartość przewodnictwa polimeru żelowego
składającego się z PMMA/LiClO
4
/PC mieściła się w granicach 5x10
-3
– 5x10
-5
S cm
-1
. Przy niskich
stężeniach, nie przekraczających 20% wagowych PMMA, układ traktowany jako ciekły elektrolit

5
zamknięty w matrycy polimerowej. Spadek przewodnictwa jonowego oraz wzrost w energii aktywacji
przewodnictwa dla wysokich stężeń PMMA powyżej 45% jest przypisany pewnym oddziaływaniom
pomiędzy łańcuchem polimerowym a pozostałymi składnikami elektrolitu. Za ciekły elektrolit uważa
się układ, w którym ilość PMMA nie przekracza 20% wagowych całości materiału.
Praktyczne zastosowanie uzyskały żelowe elektrolity polimerowe z solami litu stosowane
w odwracalnych i pierwotnych ogniwach litowych. śelowe polimery przewodzące z kwasowymi
elektrolitami wodnymi stosowane są w ogniwach paliwowych typu PMFC (polymer membrane fuel
cell ang.)
Część praktyczna
Materiały i sprzęt
Odczynniki
Poli(metakrylan metylu) – PMMA
Dimetyloformamid - DMF
Węglan propylenu –PC
Węglan etylenu –EC
kwas salicylowy KS
Ferrocen Fc
K
3
Fe(CN)
6
Barwnik z grupy barwników azowych
Celem ćwiczenia jest:
A)
sporządzenie polimeru żelowego oraz
B)
wyznaczenie przewodności właściwej
C)
pomiar krzywej polaryzacyjnej dla reakcji redoks ferrocenu Fc/Fc
+
lub Fe(CN)6
3-/4-
A) Przygotowanie elektrolitu żelowego:
Elektrolit żelowy należy otrzymać w trzech etapach. Etap pierwszy polega na otrzymaniu elektrolitu
ciekłego poprzez rozpuszczenie odpowiedniej soli w mieszaninie rozpuszczalników: np: EC: PC:DMF
w stosunku wagowym 1:1:1. Całość umieścić w kolbie dwuszyjnej małej (50 cm
3
) pod chłodnicą
zwrotną (małą) (Dipol mieszający ma wrócić do szuflady po skończonych ćwiczeniach). Kolbę
umieścić na mieszadle magnetycznym i mieszać do całkowitego rozpuszczenia soli. W etapie drugim
należy stopniowo, bardzo powoli, dodać sproszkowany polimer PMMA do ogrzanego do temp 85
o
C
roztworu. Termopara ma być umieszczona w łaźni wodnej, a nie w kolbie reakcyjnej. Nie wolno
dopuścić do wsypania całości PMMA w jednej porcji! W etapie trzecim należy dalej ogrzewać
6
mieszając w temp 85
o
C przez 45-60 minut, aby doprowadzić do całkowitego rozpuszczenia PMMA.
Temperatura nie może przekroczyć 100
o
C. Po rozpuszczeni finalny produkt użyć w kolejnych etapach
prac laboratoryjnych (punkt B, C)
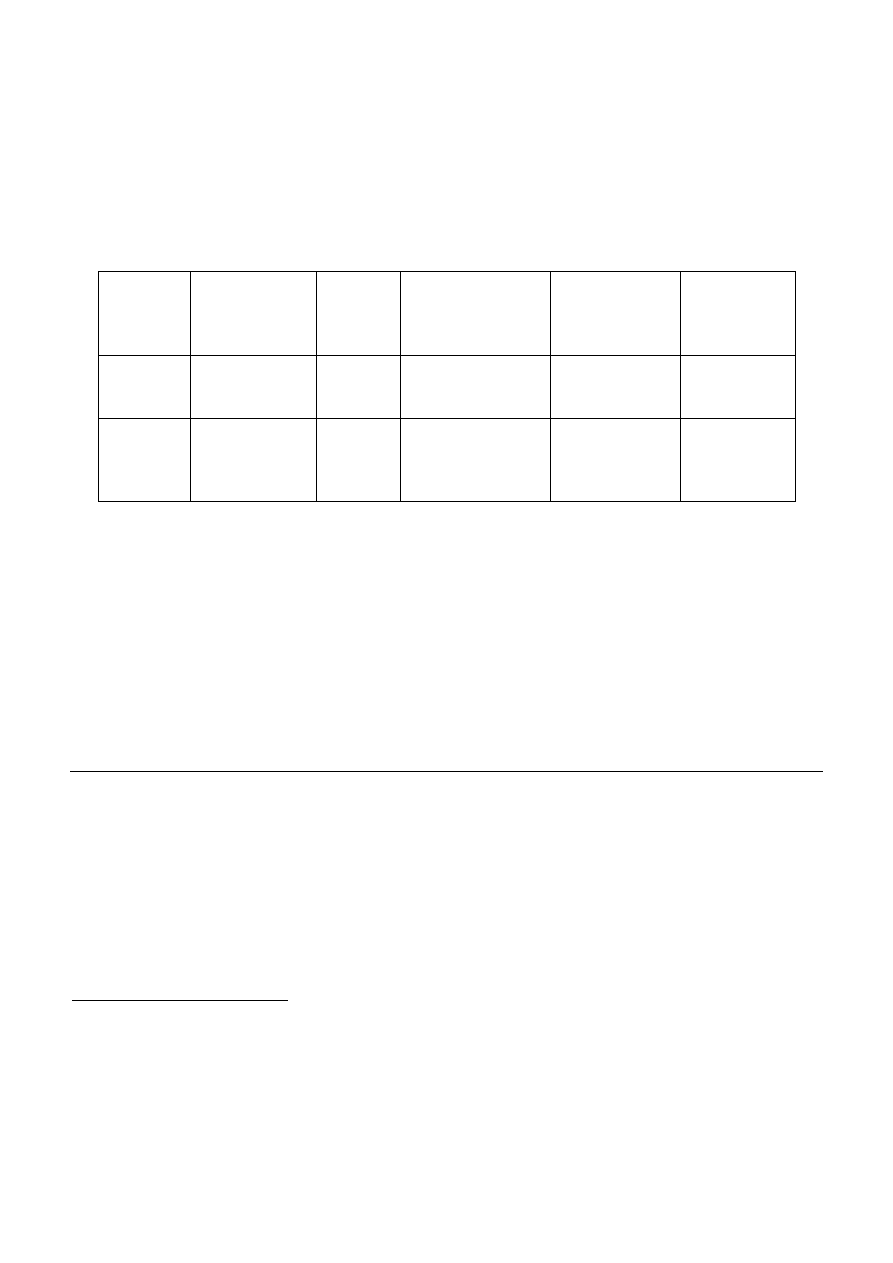
W Tabeli 2 podano skład polimeru żelowego.
Tabela 2
PMMA [g]
EC [g]
Węglan etylenu
(cialo stałe)
PC
Węglan
propylenu
[mL]
DMF
Dimetyloformamid
mL
Kwas
salicylowy [g]
Substancja
barwna
[mg]
1
12.5
10.2
0.5
1.0
1
g
wg
wskazań
prowadzącego
1
12.5
10.2
1
−
-
Ferrocen 0.1
Lub
K3Fe(CN)6
0.1
Ad B
1)Wyznaczyć stałą naczynka konduktometrycznego wykonując pomiar przewodności elektrolitu o
znanej wartości
κ
np. : 0.1 M KCl – należy odszukać dane w Tablicach Fizykochemicznych dla
zadanej temperatury.
2) Umieścić elektrody naczynia konduktometrycznego w uzyskanym elektrolicie żelowym. Podłączyć
do konduktometru. Odczytać wartość przewodnictwa. Obliczyć przewodność właściwą.
3) Wyznaczenie stałej naczynka z jego geometrii.
4) Wyznaczenie przewodności elektrolitu żelowego na dwa sposoby.
Literatura
1.
F.M. Gray, Polymer electrolytes, VCH 1998
2.
A. M. Stephan, Review on gel polymer electrolytes for lithium batteries, European Polymer
Journal 42(2006)21-42
3.
B.
Scrosatti,
et
al.
Proton
polymeric
gel
electrolyte
membranes
based
on
polymethylmethacrylate, Journal ofThe Electrochemical Society 146(1)27-31(1999)._
Materiały do przedmiotu PMOR , Anna Lisowska-Oleksiak, 2011
Wyszukiwarka
Podobne podstrony:
ZHP PP 1
Firma PP
Farmakologia cw2 s
Zagrożenia powodziowe zachowanie podczas powodzi PP
Lasery pp
Nawigacja fragmenty wykładu 4 ( PP 2003 )
osobowosc wyklad 4 pp
FM zaocz W7 8 pp
Psychologia Medyczna 1 pp
osobowosc wyklad 8 pp
Odpowiedzi Przykladowy arkusz PP Fizyka (2)
Matematyka PG PP kl2 MPZ sprawdzian 04A instrukcja
cw2
PP wykład w pigułce
cw2 3
2 BO 2 1 PP Przykłady Segregator [v1]
więcej podobnych podstron