
Korozja wysokotemperaturowa w kotłach pyłowych
Spalanie paliw stałych w paleniskach kotłowych wiąże się ze zjawiskiem
korozji wysoko-temperaturowej powierzchni ogrzewalnych.
Korozja ta występuje zawsze w kotle, ale w warunkach normalnych spalania
tempo ubywania metalu jest 8-10 nm/h, natomiast w warunkach niekorzystnych
może przekroczyć 600 nm/h (1 nm = 10
–9
m).
Zagrożone są nią parowniki i przegrzewacze.
jm
1h
24h
31dni
364dni
5lat
10lat
15lat
m
0.0000000100 0.0000002400 0.0000074400 0.0000873600 0.0004368000 0.0008736000 0.0013104000
mm
0.00001
0.00024
0.00744
0.08736
0.4368
0.8736
1.3104
jm
1h
24h
31dni
364dni
5lat
10lat
m
0.0000006000 0.0000144000 0.0004464000 0.0052416000 0.0262080000 0.0524160000
mm
0.0006
0.0144
0.4464
5.2416
26.208
52.416
10 nm/h
600 nm/h

Problem korozji wysokotemperaturowej stał się ważny w energetyce zawodowej
z trzech powodów:
•
stosowanie niskoemisyjnych technik spalania dla obniżenia emisji NOx
wiążące się z występowaniem w części paleniska stref redukcyjnych,
będących przyczyną tzw. korozji niskotlenowej lub niskoemisyjnej,
• spalanie paliw mających znaczny udział chloru i alkaliów, jak biomasa,
odpady i niektóre węgle (Cl > 0,2%)
•
podnoszenie temperatury pary w celu poprawy sprawności bloku energetycznego
.
Korozja niskoemisyjna praktycznie nie dotyczy kotłów opalanych węglem brunatnym.

Ubytki rur parownika kotła BP-1150 w wyniku korozji

Korozyjne działanie składników spalin
Ubytki metalu w wyniku korozji wysokotemperaturowej są wynikiem działania
wielu mechanizmów korozyjnych.
Czynnikami korozyjnymi są:
niektóre składniki gazowe spalin
(O
2
, SO
2
, H
2
S, Cl
2
,HCl i CO)
oraz
osady na rurach zawierające metale alkaliczne K i Na.

Związki siarki
Związki siarki w paliwach ulegają podczas spalania utlenieniu głównie do SO
2
,
SO
3
występuje tylko w niewielkim stężeniu (około 35 ppm).
W warunkach niedoboru tlenu pojawia się także H
2
S (0,1-0,15%).
Na stal działają korozyjnie ponadto:
siarka (S),
piryt (FeS
2
)
siarczek żelaza (FeS).
Najważniejsza jest jednak
korozja siarczanowa,
będąca rezultatem obecności
w osadach
siarczanów potasu i sodu
.

Związki chloru
Chlor (Cl
2
) jest szczególnie korozyjny względem stali w wysokiej temperaturze.
Powoduje tzw. aktywne utlenianie metalu niszczące ochronną warstwę tlenków.
Źródłem chloru molekularnego (Cl
2
) przy powierzchni metalu może być:
chlorowodór (HCl) obecny w spalinach
chlorki metali alkalicznych (K i Na) występujące w osadach

Związki metali alkalicznych (K, Na)
Obecne w substancji mineralnej węgli (głównie w węglach kamiennych,
w mniejszym stopniu w węglach brunatnych) i w wielu gatunkach biomasy
metale alkaliczne, K i Na, pełnią ważną rolę w mechanizmach
korozji wysokotemperaturowej.
Ich działanie zależy jednak nie tylko od ich udziału w paliwie,
ale także od tego, jak łatwo są uwalniane ze związków w których występują,
podczas spalania.

Wpływ warunków spalania
Ważne znaczenie dla tempa korozji w palenisku ma atmosfera:
utleniająca (λ > 1) lub redukująca (λ < 1).
W atmosferze utleniającej występuje ochronne działanie tlenków metali,
natomiast w
atmosferze redukcyjnej następuje intensyfikacja korozji
.
We współczesnych kotłach pyłowych w dużej części paleniska panuje
atmosfera redukcyjna, stworzona dla ograniczenia emisji NOx
Objawia się ona zmniejszonym udziałem tlenu (O
2
< 1%) i dużym udziałem
tlenku węgla (CO przekraczające 2%) w spalinach.
Czynnikami sprzyjającymi korozji są także:
duże obciążenie cieplne ścian paleniska
żużlowanie ścian.
Groźne jest bezpośrednie oddziaływanie płomienia na rury parownika, ponieważ:
· lokalnie obniża koncentrację tlenu i zwiększa koncentrację CO, H
2
S i SO
3
,
· powoduje bezpośrednie oddziaływanie pirytu na rury parownika,
· wywołuje lokalne, gwałtowne zmiany temperatury.

Znaczenie materiału rur parownika
Tempo korozji wysokotemperaturowej zależy od materiału rur parownika.
Dodatki stopowe poprawiające odporność na korozję:
Cr, Ni, Al i Si.
Zwłaszcza chrom, ponieważ umożliwia wytworzenie warstwy ochronnej tlenku
Cr
2
O
3
.
Stosowane powszechnie niskostopowe stale ferrytyczne na rury parownika
o niewielkiej zawartości chromu (Cr poniżej 2%) są mało odporne na korozję.
Lepszą odporność mają wysokostopowe stale martenzytyczne (Cr = 9,12%),
a zwłaszcza stale austenityczne (Cr = 15¸27%, Ni około 25%) które
są odporne na działanie korozji siarkowej i chlorowej.
Odporność rur parownika na działanie korozji wysokotemperaturowej można
znacznie poprawić przez zastosowanie pokryć ochronnych,
wykonanych przede wszystkim ze stopów chromu i niklu.

Mechanizmy korozji wysokotemperaturowej
Najbardziej znaczące dla kotłów opalanych paliwem stałym są
dwa mechanizmy korozji wysokotemperaturowej,
wywołane obecnością siarki i chloru w paliwie:
•
siarczanowo-siarkowy,
• chlorkowy.
Tempo ubywania metalu spowodowane korozją wymienionymi mechanizmami
jest o kilka rzędów większe od tempa utleniania metalu.

Korozja siarczanowo-siarkowa
Podczas normalnej pracy kotła powierzchnię rur szczelnie pokrywa ochronna
warstwa magnetytu Fe
3
O
4
i na niej hematytu Fe
2
O
3
.
Warstwę tlenków pokrywa warstwa osadów popiołowych.
Rola osadów
W kotłach węglowych korozja wysokotemperaturowa związana jest z osadami
na powierzchniach rur, a kryterium wysokiego tempa korozji jest
występowanie ciekłej fazy osadu na rurach.
Stopiona faza tworzy elektrolit dla elektrochemicznego ataku na metal.
Ze względu na to kryterium rozróżnia się mechanizmy
korozji rur parownika
korozji przegrzewacza,
ponieważ są w nich różne temperatury.

Korozja siarczanowa ma związek z występowaniem w substancji mineralnej
metali alkalicznych K i Na, które z siarką tworzą w palenisku siarczany
Na
2
SO
4
i K
2
SO
4
kondensujące na powierzchni rur.
Nie są one bezpośrednio korozyjne ze względu na wysoką temperaturę
topnienia (Na
2
SO
4
– 884
o
C i K
2
SO
4
- 1069
°C),
ale w obecności SO
3
w pobliżu powierzchni rur powstają pirosiarczany:
Na
2
SO
4
+ SO
3
--> Na
2
S
2
O
7
(temperatura topnienia 389
°C)
K
2
SO
4
+ SO
3
--> K
2
S
2
O
7
(temperatura topnienia 404
°C)
oraz trójsiarczany: sodowo- i potasowo-żelazowy o niższej temperaturze topnienia:
3Na
2
SO
4
+ Fe
2
O
3
+ 3SO
3
--> 2Na
3
Fe(SO
4
)
3
(temperatura topnienia 624
°C)
3K
2
SO
4
+ Fe
2
O
3
+ 3SO
3
--> 2K3Fe(SO
4
)
3
(temperatura topnienia 618
°C)
Fe
2
O
3
w ostatnich reakcjach pochodzi z popiołu, ale może także pochodzić
z warstwy ochronnej stali.

Istota korozyjnego oddziaływania
pirosiarczanów i trójsiarczanów
polega na tym,
że ze względu na niską temperaturę topnienia mogą one występować
na powierzchni rur, odpowiednio parownika i przegrzewacza, w stanie ciekłym.
Pirosiarczany
są agresywne w stosunku do metalu, ale ich korozyjne
działanie polega także na niszczeniu ochronnej warstwy tlenków rur parownika:
3Me
2
S
2
O
7
+ Fe
2
O
3
--> 2Me
3
Fe(SO
4
)
3
(Me = K, Na)
Trójsiarczany
, których obecność stwierdzono w osadach rur przegrzewaczy,
mogą bezpośrednio atakować metal rur przegrzewacza:
2Me
3
Fe(SO
4
)
3
+ 6Fe --> Fe
2
O
3
+ 3/2Fe
3
O
4
+ 3Me
2
SO
4
+ 3/2FeS (Me = K, Na)
(1)
lub, mając zdolność rozpuszczania tlenków żelaza, odsłaniają metal do utleniania:
3Fe + 2O
2
--> Fe
3
O
4
i 4Fe + 3O
2
--> 2Fe
2
O
3
(2)
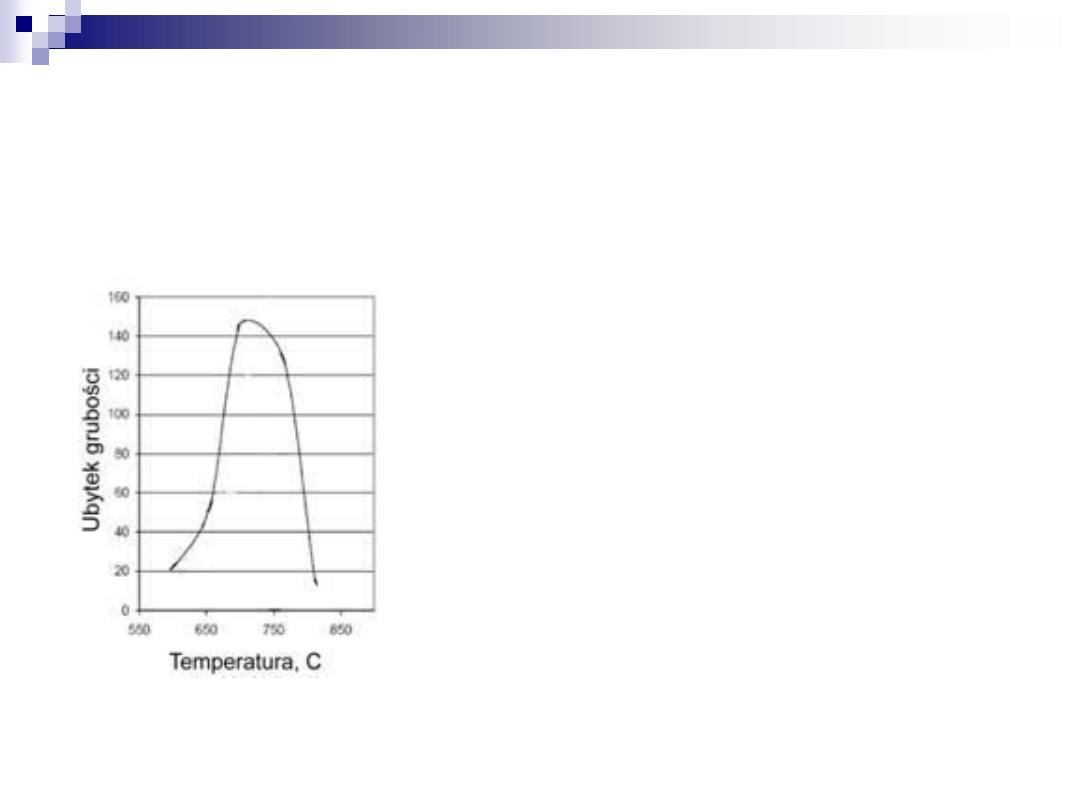
Ze względu na zakres temperatury:
pirosiarczany są przyczyną korozji parownika,
trójsiarczany (ich topnienie w 537 °C, a rozkład w 701 °C) występują
na powierzchniach przegrzewacza.
Rys.2. Zakres temperaturowy korozyjnego oddziaływania
trójsiarczanu potasowo-żelazowego na rury przegrzewacza

Kluczowy w tym mechanizmie jest SO
3
, którego udział w spalinach
jest bardzo mały (~35 ppm), ale na powierzchni rur może być o kilka rzędów
większy.
Prawdopodobne źródła SO
3
przy powierzchni to:
-
topnienie zewnętrznej warstwy osadu z wydzielaniem SO
3
oraz
- katalityczne utlenianie SO
2
na warstwie Fe
2
O
3
.

Rola atmosfery
Obserwuje się przyspieszenie korozji wysokotemperaturowej w wyniku
stopniowania powietrza w kotle pyłowym celem ograniczenia emisji NOx .
Mechanizm tego przyspieszenia nie jest jednak całkiem znany.
Przypuszcza się, że w atmosferze redukcyjnej po zniszczeniu warstwy tlenków
na powierzchni rury w wyniku działania korozji siarczanowej,
metal zamiast reagować tlenem
3Fe + 2O
2
--> Fe
3
O
4
i 4Fe + 3O
2
--> 2Fe
2
O
3
(2),
reaguje intensywniej z H
2
S,
którego stężenie wzrasta w warunkach redukujących:
Fe + H
2
S --> FeS + H
2
W warunkach spalania niskoemisyjnego stwierdzono także intensyfikację
korozji przegrzewaczy, która normalnie jest łączona z trójsiarczanami (1) .
Może ona być wywołana powierzchniowym nawęgleniem metalu rur
częściami palnymi w popiele, których zwiększenie udziału jest wynikiem
spalania z niedomiarem powietrza.

Rola pirytu
Kontakt płomienia z ścianami kotła powoduje
żużlowanie i osadzanie się niespalonych cząstek węgla na powierzchni ekranów.
Największym zagrożeniem jest, będący przyczyną korozji siarkowej,
piryt FeS
2
oraz uwalniany w atmosferze redukcyjnej siarkowodór
H
2
S,
które mogą bezpośrednio reagować z żelazem
Fe + FeS
2
--> 2FeS,
Fe + H
2
S --> FeS + H
2
Warstwa siarczku żelazawego FeS na powierzchni metalu nie ma charakteru
ochronnego, ponieważ tworzy zgorzelinę umożliwiającą dyfuzję jonów metali.
Efektem jest siarkowa korozja międzykrystaliczna i wżerowa.
Zasadnicze znaczenie dla korozji siarkowej ma obecność tlenu:
w atmosferze redukcyjnej jej szybkość jest kilkukrotnie większa niż
w atmosferze utleniającej.
Odporność rur na korozję siarkową znacznie poprawia stosowanie stali
z dodatkami chromu i niklu.

Korozja chlorkowa
W obecności
HCl
w spalinach lub chlorków w osadach utlenianie żelaza i stali
ulega silnemu przyspieszeniu za przyczyną mechanizmu aktywnego utleniania
(w atmosferze utleniającej).
Na różnych etapach powstawania złóż węgla, towarzyszyły im związki chloru. Głównymi źródłami tego
pierwiastka w pokładach węgla były:
rośliny stanowiące materiał wyjściowym procesie tworzenia węgla (głównie algi oraz rośliny
okrytozalążkowe), zawierające w swoim składzie chlor w postaci minerałów tego pierwiastka
(głównie chlorku sodu oraz mniejszej ilości chlorków potasu, magnezu i wapnia), który został
zaabsorbowany z gleby;
na etapie syngenetycznym
– minerały rozpuszczone lub zawieszone w wodach (siarczany,
węglany, chlorki) przepływające przez tworzące się pokłady węgla. Następowała redystrybucja i
wychwytywanie chloru przez bardziej stabilne i nowopowstałe krzemiany i wodorotlenki (illit,
kaolinit, chloryt, muskowit oraz wodorotlenki żelaza);
na etapie epigenetycznym
– minerały rozpuszczone lub zawieszone w wodach (siarczany, węglany,
chlorki) przepływające przez pory, szczeliny i pęknięcia w utworzonych pokładach węgla.
Na ilość chloru w pokładach węgla wpływa również zawartość tego pierwiastka w wodach
kopalnianych. W miarę wzrostu głębokości zalegania pokładów, wzrasta w nich zawartość chloru

Formy występowania chloru w węglu
W węglu chlor może występować w formie połączeń organicznych i nieorganicznych:
• jako główna forma – w substancji organicznej w postaci jonowej w wodzie zawartej w
węglu;
• w postaci bezwodnych i uwodnionych chlorków. Wśród form bezwodnych najczęściej w
węglu występuje halit, sylvit, chloromagnezyt, hydrofilit i fluoryt.
Natomiast wśród form uwodnionych najczęściej spotykane są:
bischofit (MgCl
2
· 6H
2
O)
oraz carnallit (KMgCl
3
· 6H
2
O);
• w postaci składnika mineralnego w chloroapatycie ((Ca(PO4)3(Cl, F, OH)), sodalicie
(Na
8
(AlSiO
4
)
6
Cl
2
) oraz w siarczanach, węglanach i amorficznych składnikach
nieorganicznych;
• sporadycznie może występować w postaci NaCl, jako formy powstałej w wyniku
wstępnej przeróbki węgla – mielenia i suszenia bezpooerednio po wydobyciu .

Według Mieleckiego zawartość chloru w polskich węglach wynosiła średnio
0,01% Cl (od 0 do 0,025% Cl)
w pokładach warstw łękowych i siodłowych (typ limniczny) GZW, zaś w warstwach brzeżnych (typ
paraliczny) GZW
– zawartość chloru dochodziła do
0,175% Cl
– zazwyczaj nie przekraczając
0,1% Cl
.
Wyjątek stanowiły niektóre pokłady kopalń Brzeszcze i Dębieńsko, w których zawartość tego pierwiastka
dochodziła do 0,19%.
Kuśmierska podaje, że niektóre węgle GZW zawierają około 0,3% Cl.
Natomiast Rożkowska po przebadaniu prób węgli z rdzeni wiertniczych i wykonaniu 818
oznaczeń zawartości chloru stwierdziła, że zawartość chloru całkowitego waha się w granicach od 63 do
18 871 g/Mg.
Najwięcej chloru posiadają węgle pochodzące ze wschodniej i południowo-wschodniej części GZW (rzędu
4000
–9000 g/Mg), najmniej – z części południowo-zachodniej (średnio 400–700 g/Mg). Ponadto węgle
pochodzące z Górnośląskiego Zagłębia Węglowego cechuje również regionalne zróżnicowanie oraz
stratyfikacja pionowa zawartości chloru.
Stratyfikacja pionowa zawartości Cl w węglach karbońskich zależna jest od przepuszczalności nadkładu
oraz od głębokości zalegania. Natomiast jest niezależna od granic litostratygraficznych poszczególnych
ogniw karbonu.
Według Strugały (1998) zawartość chloru w polskich węglach zawiera się w przedziale od
0,02 do 0,4% Cl
.
Regułą jest również, że zawartość chloru wzrasta wraz ze stopniem zasolenia wód podziemnych oraz
zwiększania się stopnia metamorfizmu.

Wpływ zawartości chloru na użytkowanie węgla kamiennego
W procesach pirolizy i spalania, oddziaływanie temperatury na węgiel powoduje wydzielanie
zawartego w nim chloru w postaci chlorowodoru, będącego związkiem agresywnym
dla urządzeń przetwórstwa węgla oraz czynnikiem zakwaszającym środowisko.
Emitowane związki chloru są także przyczyną powstawania silnego i trudnego do usunięcia
zasolenia wód ściekowych.
Również w przypadku węgli koksowych chlor jest składnikiem niepożądanym, gdyż
od 40 do 60% chloru pozostaje w koksie.
W wyniku spalania węgla zawierającego chlor, na powierzchniach urządzeń grzewczych
tworzą się uciążliwe naloty.
Za proces ten odpowiedzialne są dwa pierwiastki zawarte w węglu: chlor i siarka.
Mechanizm tworzenia nalotów przebiega przez reakcję degradacji chlorku sodu i wydzielanie
chlorowodoru:
Zdecydowany wpływ na zachowanie się chloru podczas procesów spalania mają formy
występowania tego pierwiastka w węglu oraz połączenia chloru z sodem, a także potasem,
magnezem czy wapniem. Rodzaj tych połączeń determinuje temperaturę i formę wydzielania
chloru z węgla podczas pirolizy
Węgiel energetyczny
NaCl + H
2
O (para) NaOH + HCl
Temperatury topnienia chlorków

4NaCl + 2SO
2
+ O
2
+ H
2
O (para) 2Na
2
SO
4
+ 4HCl
Siarczan sodu(VI)
– Na
2
SO
4
– jest głównym składnikiem nalotów na urządzeniach grzewczych.
Choćby wydzielał się chlor gazowy, to i tak byłby redukowany do chlorowodoru w obecności
dwutlenku siarki i pary wodnej:
SO
2
+ Cl
2
+ H
2
O SO
3
+ 2HCl
Poprzez ogrzewanie w wilgotnym powietrzu lignitów zawierających chlor wykazano, że
w temperaturze około 573K mogą tworzyć się związki chloroorganiczne zgodnie z syntezą
de novo
, (warunkiem koniecznym jest połączenie typu C–Cl na powierzchni lignitu).
Fiedler i Herzschuh (1993) udowodnili, że na powierzchni lignitu z jonów chlorkowych tworzą się
takie formy, które pod wpływem powietrza przemieszczają się na jego powierzchnię, gdzie tworzą
wiązania C–Cl i następnie umożliwiają uwalnianie toksycznych związków chloroorganicznych.

Mechanizm aktywnego utleniania
Pierwszym krokiem w tym mechanizmie jest pojawienie się molekularnego chloru (Cl
2
),
który może być wynikiem utleniania HCl (reakcja Deacona),
4HCl +O
2
--> 2Cl
2
+ 2H
2
O
(3)
W wysokiej temperaturze równowaga tej reakcji leży po lewej stronie (dużo HCl i mało Cl
2
),
ale na skutek katalitycznego działania tlenków osadu (proces Weltona) równowaga
przesuwa się ku stronie prawej.
Źródłem Cl
2
mogą być reakcje kondensujących na rurach chlorków K i Na
z tlenkami żelaza w osadzie:
4(K, Na)Cl + 2Fe
2
O
3
+ O
2
--> 2(K, Na)
2
Fe
2
O
4
+ 2Cl
2
(4)
W obu reakcjach (3, 4) niezbędny jest tlen.
Chlor dyfunduje przez osady do metalu i reaguje z nim
Fe + Cl
2
--> FeCl
2
(s)
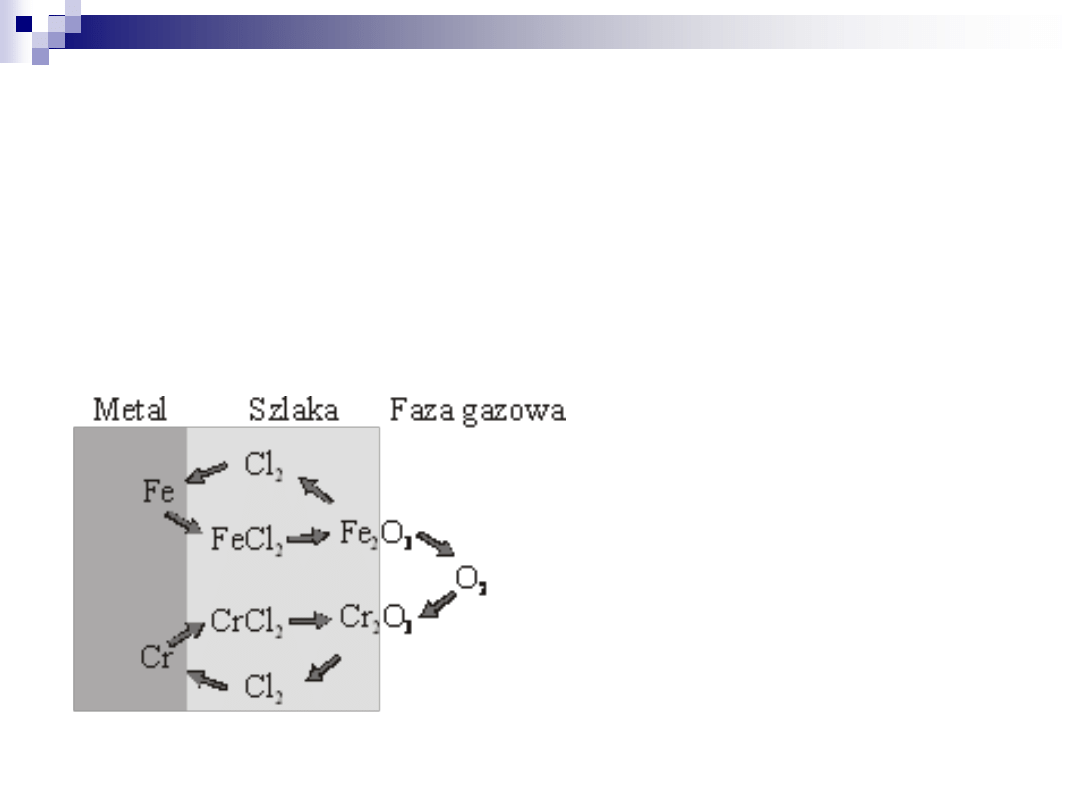
Powstające na powierzchni metalu chlorki mają duże ciśnienie par w temperaturze 500 °C,
co powoduje, że przechodzą do fazy gazowej oraz dyfundując przez ochronną warstwę
magnetytu uszkadzają ją.
Na drodze napotykają obszar bogaty w tlen, w którym chlorki są utleniane:
4FeCl
2
(g) + 3O
2
--> 2Fe
2
O
3
(s) + 4Cl
2
3FeCl
2
(g) + 2O
2
--> Fe
3
O
4
(s) + 3Cl
2
odtwarzając warstwę tlenku żelaza przy powierzchni rur, która jednak nie ma już właściwości
ochronnych, ponieważ jest porowata.
Uwolniony w tej reakcji cząsteczkowy chlor dyfunduje z powrotem przez warstwę tlenków
do metalu (rys. 3).
Rys. 3. Mechanizm aktywnego utleniania
w korozji chlorkowej

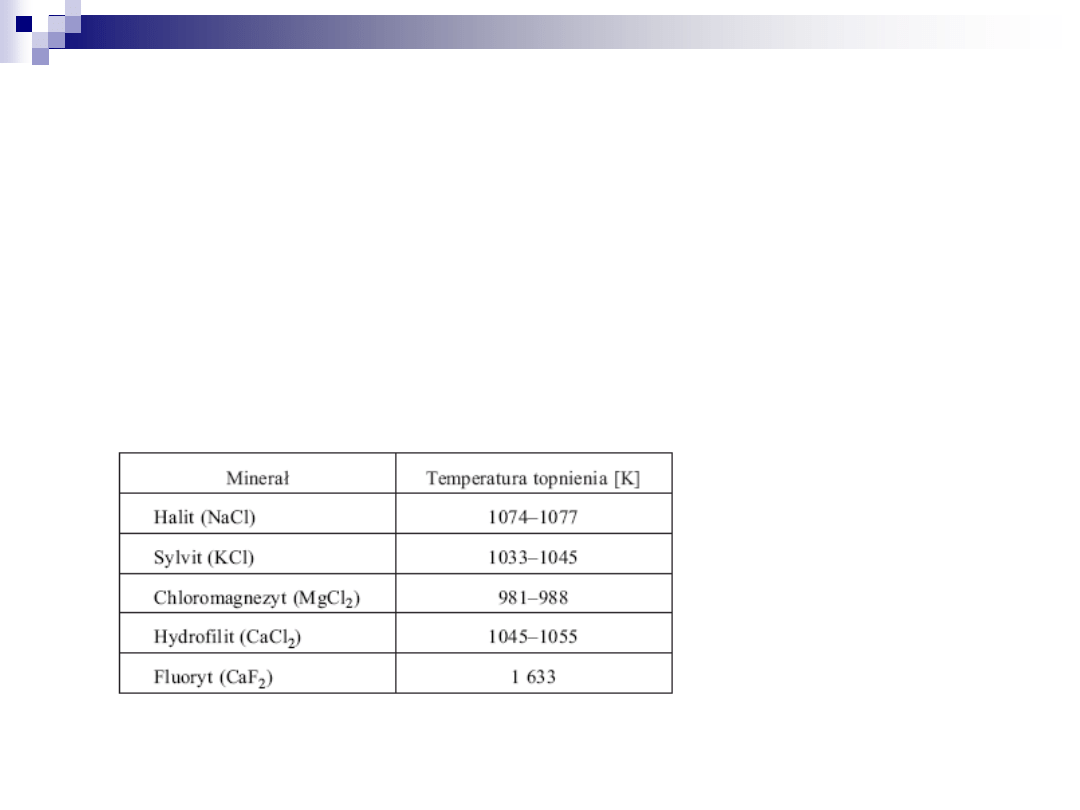
Korozja chlorkowa ulega intensyfikacji, gdy na rurach są osady zawierające
chlorki potasu i sodu, jest szczególnie intensywna jeżeli występują one w fazie ciekłej.
Temperatura topnienia chlorków K i Na jest wysoka,
ale ich eutektyki z chlorkami innych metali mają znacznie niższą temperaturę
topnienia (tabela 1) .
Na skutek tego w kotłach, w których spala się odpady zawierające chlor, alkalia i metale ciężkie,
zagrożenie korozją występuje już w temperaturze 250 °C .
Chlorki K i Na intensyfikują korozję także, kiedy występują na powierzchni
metalu w stanie stałym .
Skład, % mas.
Temperatura, °C
100KCl
774
100NaCl
802
48ZnCl
2
-52KCl
250
79PbCl
2
-21KCl
411
69PbCl
2
-31NaCl
410
39ZnCl
2
-50KCl-11PbCl
2
275
35ZnCl
2
-48NaCl-17PbCl
2
350
Tabela 1. Temperatura topnienia eutektyk metali ciężkich

Rola siarki w korozji chlorkowej
Jeżeli w układzie jest siarka, chlorki ulegają także konwersji do siarczanów
(K
2
SO
4
i Na
2
SO
4
):
4(K, Na)Cl + 2SO
2
+ O
2
--> 2(K, Na)
2
SO
4
+ 2Cl
2
(5)
W temperaturze ok. 500
°C siarczany są jeszcze stabilne, więc mniej korozyjne
od chlorków, natomiast wyzwalany w reakcji (5) chlor Cl
2
powstaje na powierzchni
osadu i jest tracony do spalin, a tylko niewielka jego część wnika do osadu.
Usiarczenie chlorków zachodzi o rząd szybciej z udziałem SO
3
, niż z udziałem SO
2
,
dlatego kluczowa jest katalizowana przez żelazo reakcja utleniania SO
2
do SO
3
.
Ograniczające korozję chlorkową działanie siarki polega na zastąpieniu
w osadach chlorków KCl i NaCl bardziej stabilnymi siarczanami.
Przyjmuje się, że przy stosunku molowym S/Cl > 2,2 korozja chlorowa
przestaje być groźna.

W ogólnym przypadku na powierzchni rur mogą zachodzić następujące reakcje,
w których bierze udział żelazo:
3Fe + 2O
2
↔ Fe
3
O
4
(powstania ochronnej warstwy magnetytu)
Fe + S ↔ FeS
(zjawiska korozyjne)
Fe + Cl
2
↔ FeCl
2
(zjawiska korozyjne)
przy czym w zależności od panujących warunków termodynamicznych tylko jedna
z tych reakcji przeważa.

Oprócz korozji chlorowej w warunkach redukcyjnych może się pojawiać także
korozja siarkowa
, zarówno na skutek reakcji z siarką elementarną, jak i z
siarkowodorem.
Korozja ta zachodzi w temperaturach wyższych od temperatury topnienia i niższych od
temperatury nasycenia soli, tzn. w zakresie ok. 400
–700°C.
Sulfatyzacja chlorków prowadzi do powstania mieszanin o niskich temperaturach
topnienia, zdolnych do tworzenia eutektyk z materiałem rur
Katalityczne działanie tlenków żelaza występujących w popiele lotnym (np. z osadów
ściekowych), a także obecnych na powierzchni rur, zwiększa udział powstającego SO
3
,
który reagując z osadzonymi na rurach chlorkami alkalicznymi powoduje ich
sulfatyzację, np. dla chlorku potasu:2KCl + SO3 + 1/2 O2 → K2SO4 + Cl2

Katalityczne tworzenie większych stężeń SO
3
w spalinach może doprowadzić
w temperaturach 320
–480°C do powstawania w osadach pirosiarczanów
alkalicznych:
K
2
SO
4
+ SO
3
→ K
2
S
2
O
7
atakujących warstwę ochronną tlenków:
3K
2
S
2
O
7
+ Fe
2
O
3
→ 2K
3
Fe(SO
4
)
3
4K
2
S
2
O
7
+ Fe
3
O
4
→ 4K
2
SO
4
+ FeSO
4
+Fe
2
(SO
4
)
3
oraz materiał rur:
3K
2
S
2
O
7
+ 3Fe → Fe
2
O
3
+ FeS + 2K
2
SO
4
Mechanizm ten występuje zazwyczaj na rurach parowników i podgrzewaczy wody.
Jednak powstałe w wyniku reakcji trójsiarczany
K
2
S
2
O
7
występują w stanie ciekłym w temperaturach wyższych (565–676°C ) i mogą
uszkadzać rury końcowych stopni przegrzewaczy.

Znaczenie atmosfery
Uznawano, że korozja chlorowa występuje kiedy udział chloru w węglu przekracza 0,3%.
Ostatnie doświadczenia ze współspalaniem węgli z odpadami i biomasą
pokazały jednak, że korozja chlorowa jest groźna w warunkach redukujących (O
2
< 0,2%),
szczególnie jeżeli występują cyklicznie warunki utleniająco-redukcyjne.
W warunkach utleniających chlor występuje w spalinach głównie w postaci chlorowodoru (HCl),
którego bezpośredni atak
Fe + 2HCl --> FeCl
2
(g) + H
2
nie jest tak groźny, jak bardziej agresywne działanie chloru molekularnego Cl
2
.
W warunkach redukcyjnych, chlorowodór rozkłada się, a uwolniony Cl
2
atakuje metal zgodnie
z przedstawionym mechanizmem aktywnego utleniania.
Intensywnej korozji chlorkowej towarzyszy CO.
Reakcje sumaryczne rozkładu HCl z udziałem CO i ataku na warstwę ochronną tlenków
można zapisać następująco:
Fe
2
O
3
+ 2HCl + CO --> FeO + FeCl
2
+ H
2
O + CO
2
Fe
3
O
4
+ 2HCl + CO --> 2FeO + FeCl
2
+ H
2
O + CO
2
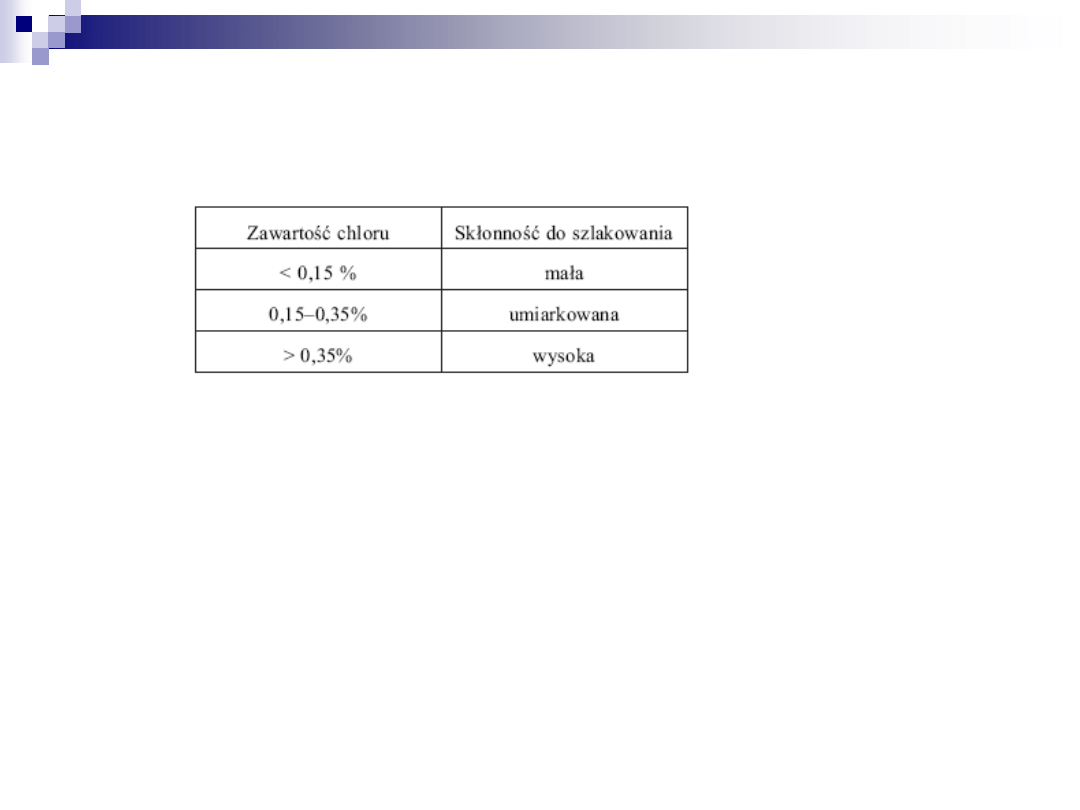
Według klasyfikacji Croslleya istnieje następujący podział węgli z uwagi na
skłonność do szlakowania, powiązaną z zawartością chloru:
Przeprowadzono obliczenia dotyczące wpływu chloru na skłonnooeć do
szlakowania.
Analizy te dotyczyły węgli z kopalń wchodzących w skład Kompanii Węglowej SA.
Z uwagi na klasyfikację Crossleya, tylko 11% badanych węgli cechuje się wysoką
skłonnością do szlakowania (> 0,35% Cl). Są to węgle pochodzące z kopalń:
Ziemowit, Piast 1, Piast 2 oraz Brzeszcze-
Silesia Ruch 1. Natomiast małą
skłonnością do szlakowania będzie się cechowało prawie 20% omawianych węgli.
Są to węgle pochodzące z kopalń: Pokój, Ruch Centrum, Bolesław Śmiały, Ruch
Wirek, Ruch Bobrek.
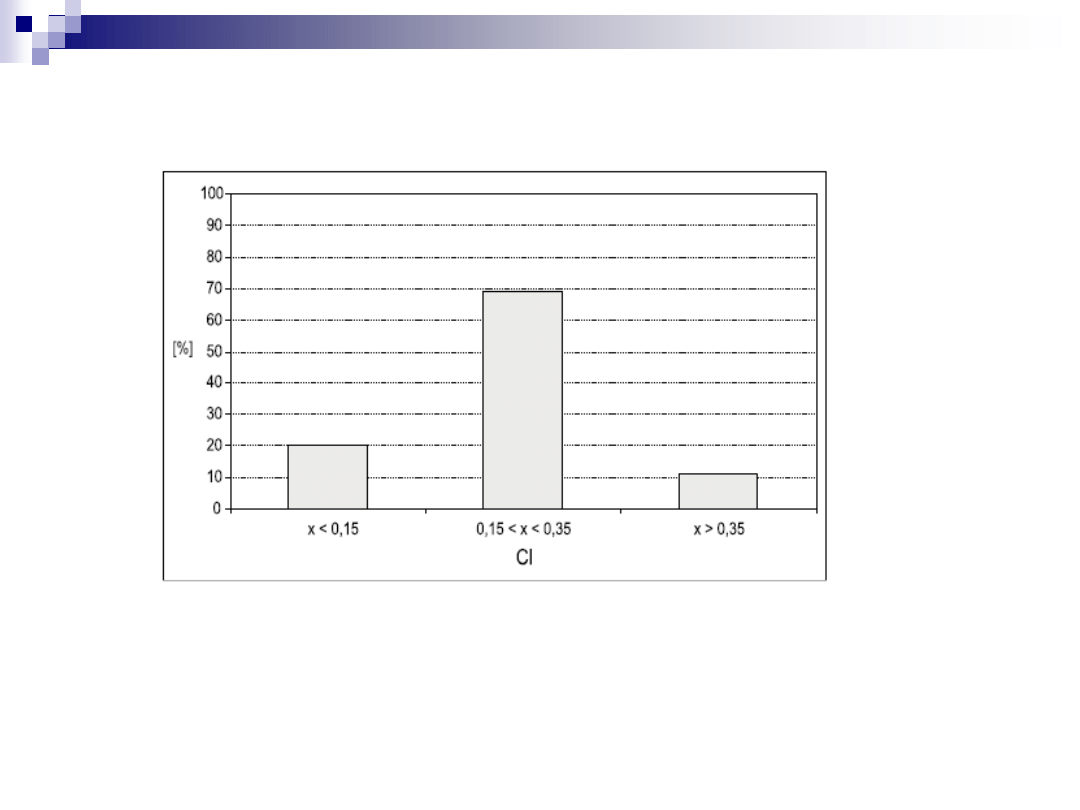
Rozkład zawartości chloru, jako wskaźnika skłonności do szlakowania

Korozja towarzysząca spalaniu biomasy
Stwarzającym zagrożenie korozyjne składnikiem biomasy jest potas.
Jeżeli w biomasie (trawa, słoma) jest także chlor, to uwalniany podczas spalania
potas występuje w spalinach w postaci par chlorku.
Kondensujący na rurach KCl stanowi groźny prekursor korozji chlorkowej.
Przedsięwzięcia antykorozyjne w kotłach
Można ograniczyć korozję wysokotemperaturową w kotłach przez:
· Zapewnienie utleniającej atmosfery przy powierzchniach ogrzewalnych przez:
-
zwiększenie współczynnika nadmiaru powietrza,
-
zmianę rozpływu powietrza w palenisku (powietrze osłonowe).
· Ograniczenie temperatury pary do około 537 °C.
· Stosowanie powłok ochronnych na rury.
· Wprowadzenie do spalin dodatków (np. siarczanu amonu)
w przypadku korozji chlorkowej
(NH4)
2
SO
4
temperaturze rozkładu 513°C (786K), wydziela amoniak

Składniki i
parametry
Jednost
ka
Słoma żółta
Słoma szara
Drewno
Węgiel
kamienny
Wilgotność
% wag
15
15
30
12
Popiół
% wag
4
3
1
12
Węgiel
% wag
42
43
35
75
Tlen
% wag
37
38
43
7,3
Wodór
% wag
5
5,2
4
3,5
Chlor
% wag
0,75
0,2
0,1
0,08
Azot
% wag
0,35
0,41
0,1
1
Siarka
% wag
0,16
0,13
0,1
0,8
Części lotne
% wag
70
73
55
25
Rzeczywista
wartość
opałowa
MJ/kg
14,4
15
10,5
25
Teoretyczna
wartość
opałowa
MJ/kg
18,2
18,7
13
32
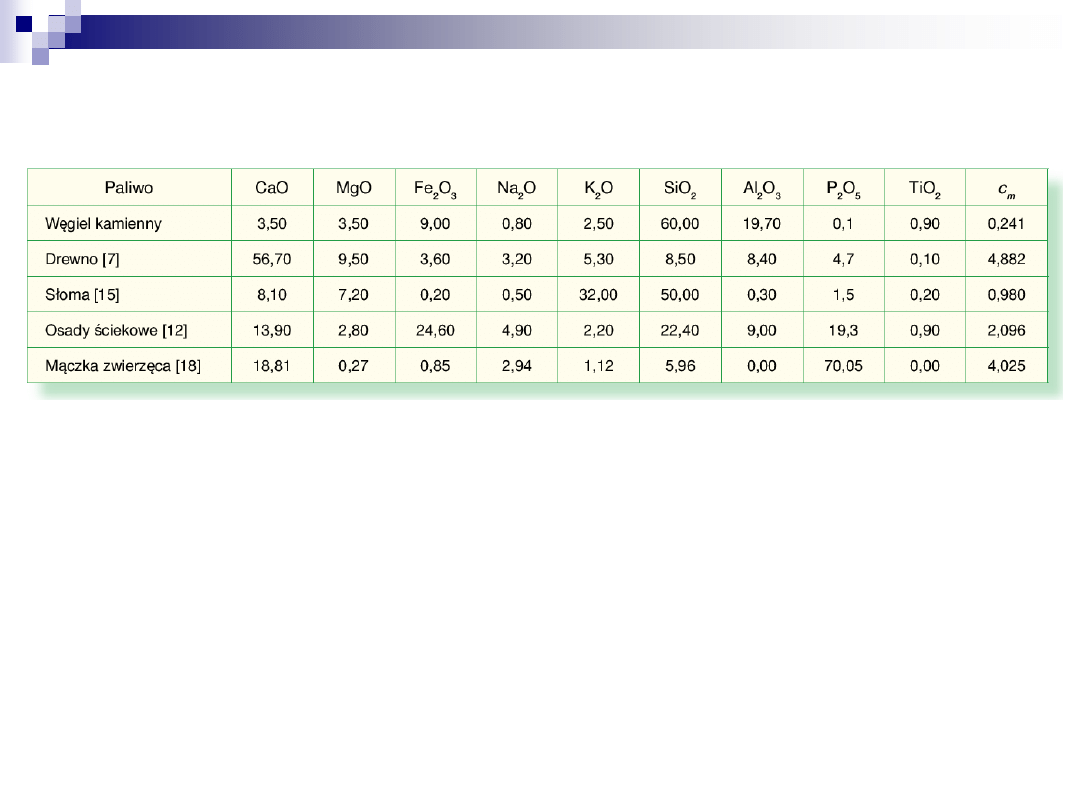
Skład chemiczny % popiołów z węgla i biomasy
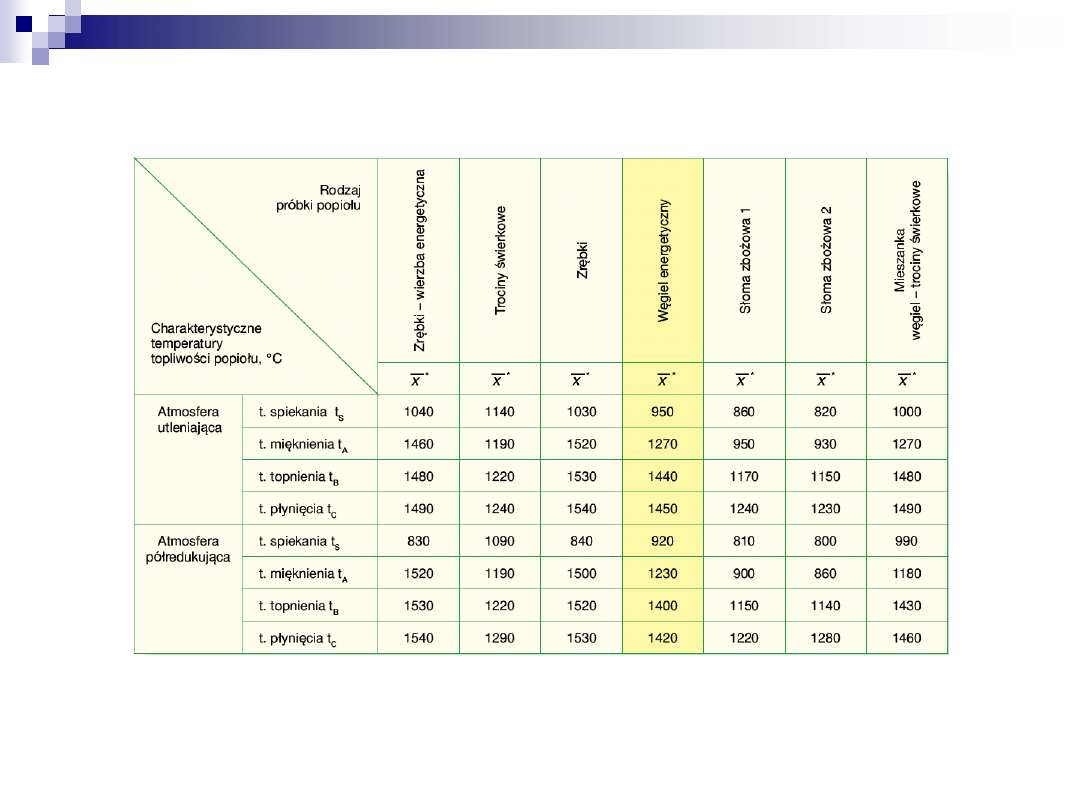
Charakterystyczne temperatury topliwości popiołów (badania własne IChPW)
Wyszukiwarka
Podobne podstrony:
Metody określania zagrożenia korozją wysokotemperaturową powierzchni ogrzewalnych kotłów spalających
Plazmowy rozruch kotlow pylowych
Projekt ochrony przed korozją wysokotemperaturową elementów zaworów cieplnych e2
1 Projekt ochrony przed korozją wysokotemperaturową elementów zaworów cieplnych
Projekt ochrony przed korozją wysokotemperaturową elementów zaworów cieplnych e3
D19250025 Rozporządzenie Ministra Przemysłu i Handlu z dnia 31 grudnia 1924 r o wysokości opłat za
D19240614 Rozporządzenie Ministra Przemysłu i Handlu w porozumieniu z Ministrem Skarbu z dnia 2 lip
D19250403 Rozporządzenie Ministra Przemysłu i Handlu z dnia 28 maja 1925 r o wysokości opłat pobier
Korozja chemiczna, utlenianie wysokotemperaturowe i utlenianie wewnętrzne
KOROZJA PODSTAWY TEORETYCZNE I SPOSOBY ZAPOBIEGANIA
Technologia spawania stali wysokostopowych 97 2003
wyklad 12nowy procesy elektrodowe i korozja
BHP przy pracach na wysokości
KOROZJA BIOLOGICZNA II
korozja i tarcie
Systemy wysokości w niwelacji precyzyjnej
Pomiar odpylaczy kotłowych
więcej podobnych podstron