
Ogólnotechniczne podstawy biotechnologii z grafiką inżynierską, Studium inżynierskie
Wydział Chemiczny Politechniki Wrocławskiej, 2009/2010, Prof. Antoni Kozioł
OGÓLNOTECHNICZNE
PODSTAWY BIOTECHNOLOGII
Z GRAFIKĄ INŻYNIERSKĄ
Wykład IX i X
Zasady termodynamiki
Proste przemiany termodynamiczne
Obiegi termodynamiczne
Ogólnotechniczne podstawy biotechnologii z grafiką inżynierską, Wydział Chemiczny Politechniki Wrocławskiej, 2009/2010, prof. Antoni Kozioł
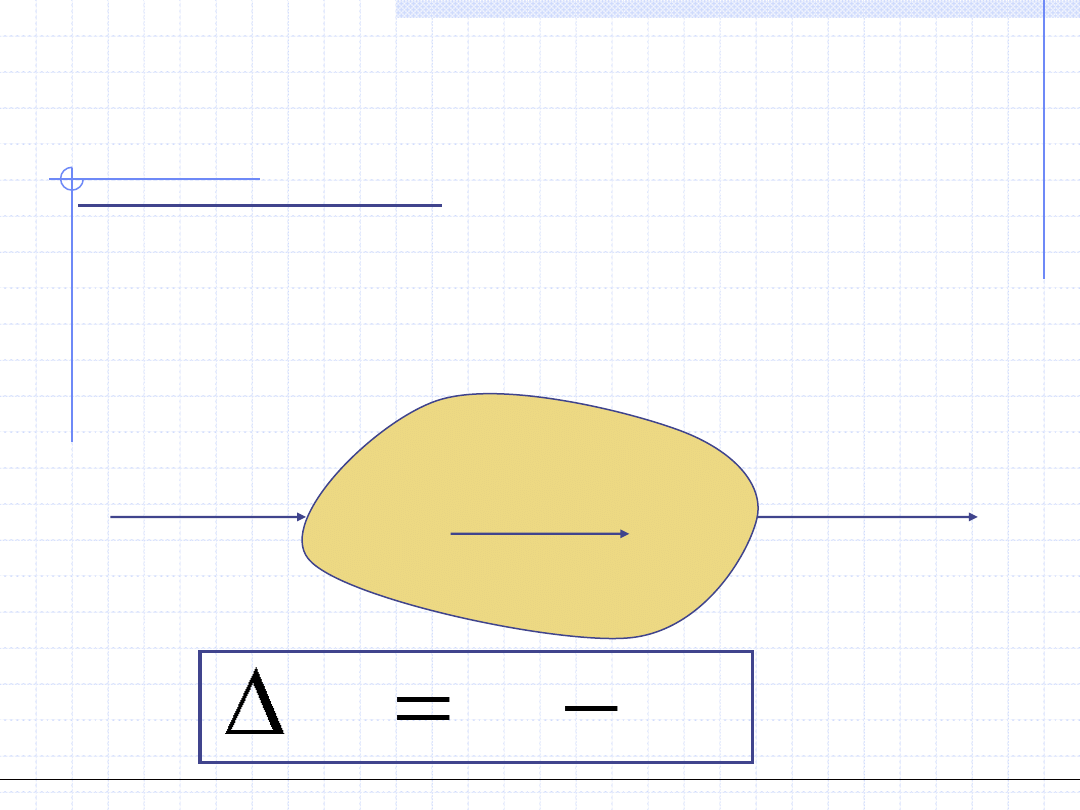
I ZASADA TERMODYNAMIKI
I zasada termodynamiki jest to w swojej istocie prawo zachowania
energii sformułowane dla dowolnej przemiany układu termodynamicznego.
I zasadę można formułować dla układów zamkniętych i otwartych.
Istnieje bardzo wiele matematycznych zapisów tej zasady. Przykładowo
napiszmy tą zasadę dla całkowej (nieróżniczkowej) przemiany układu
zamkniętego bazując na energii wewnętrznej.
Stan 1
U
1
Stan 2
U
2
ΔU=U
2
-U
1
Q
W
W
Q
U
Ogólnotechniczne podstawy biotechnologii z grafiką inżynierską, Wydział Chemiczny Politechniki Wrocławskiej, 2009/2010, prof. Antoni Kozioł
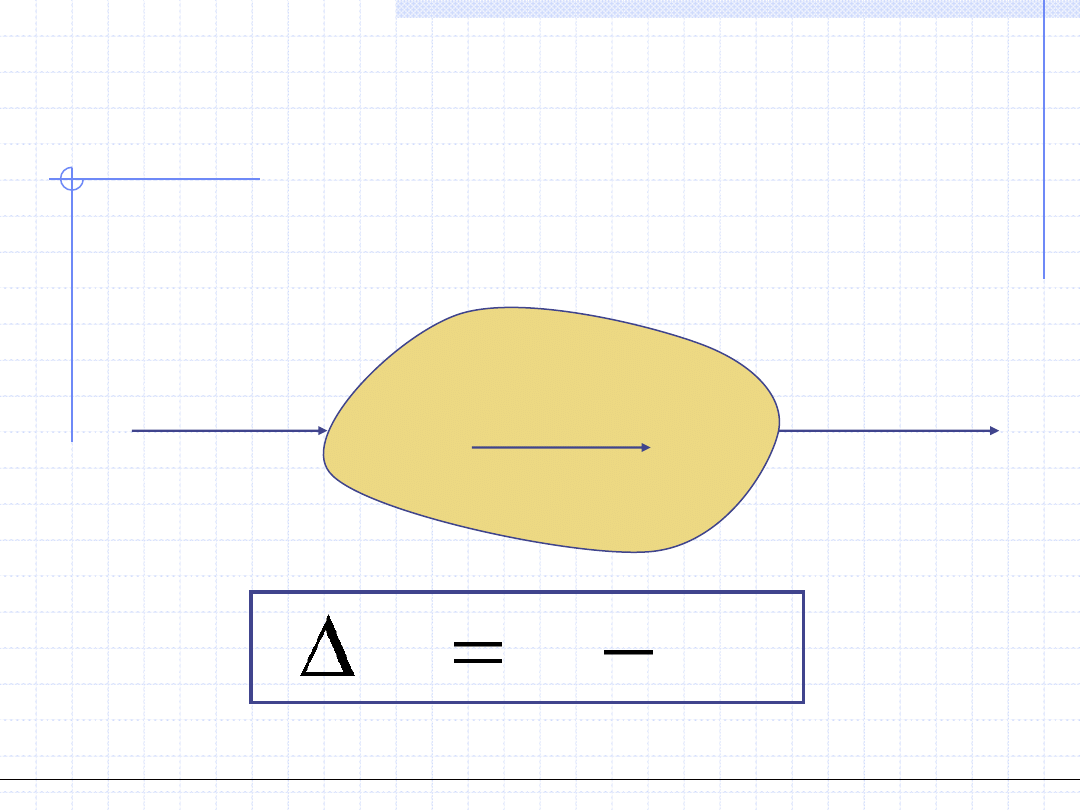
I ZASADA TERMODYNAMIKI
Stosunkowo często I zasada jest formułowana na bazie entalpii.
W takim przypadku w bilansie energetycznym zamiast pracy
objętościowej używa się pracy technicznej
Stan 1
H
1
Stan 2
H
2
ΔH=H
2
-H
1
Q
W
t
t
W
Q
H
Ogólnotechniczne podstawy biotechnologii z grafiką inżynierską, Wydział Chemiczny Politechniki Wrocławskiej, 2009/2010, prof. Antoni Kozioł
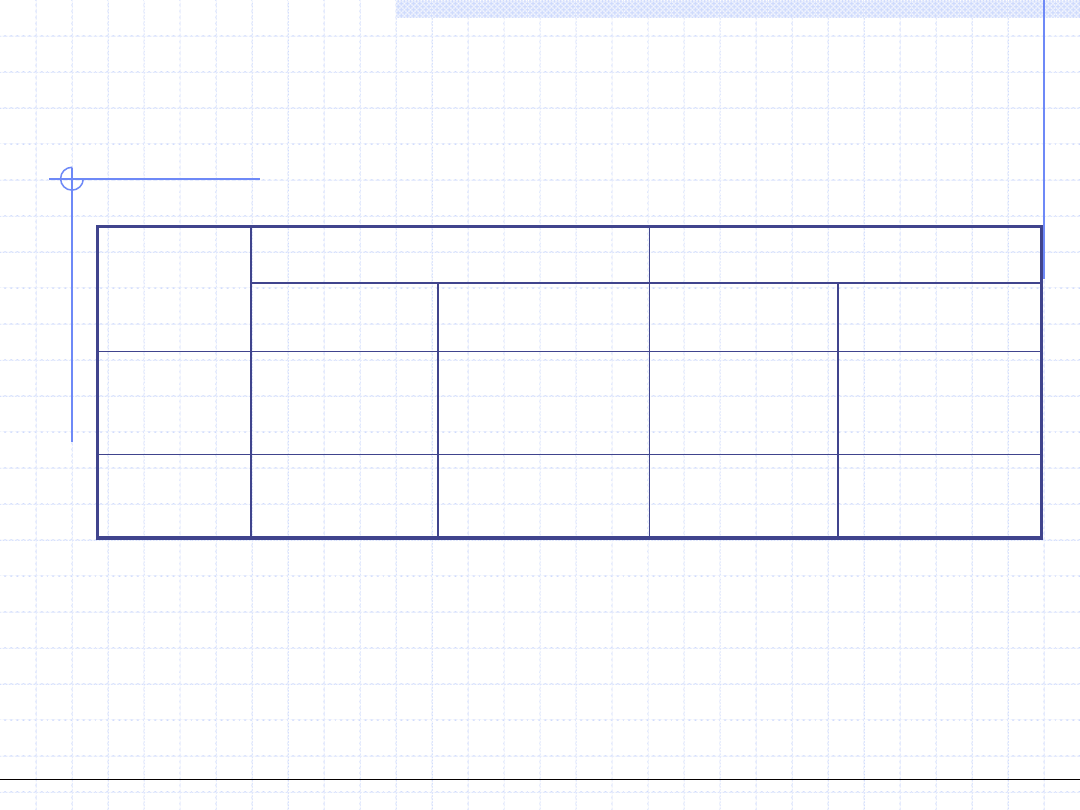
INNE SFORMUŁOWANIA PIERWSZEJ
ZASADY TERMODYNAMIKI
dh=δq-δw
t
Δh=q-w
t
dH=δQ-δW
t
ΔH=Q-W
t
Baza:
Entalpia
du=δq-δw
Δu=q-w
dU=δQ-δW
ΔU=Q-W
Baza:
Energia
wewnętrzna
Przem. różnicz.
Przem. całk.
Przem. różniczk.
Przem.
całkowa
Wielkości właściwe
Wielkości ekstensywne
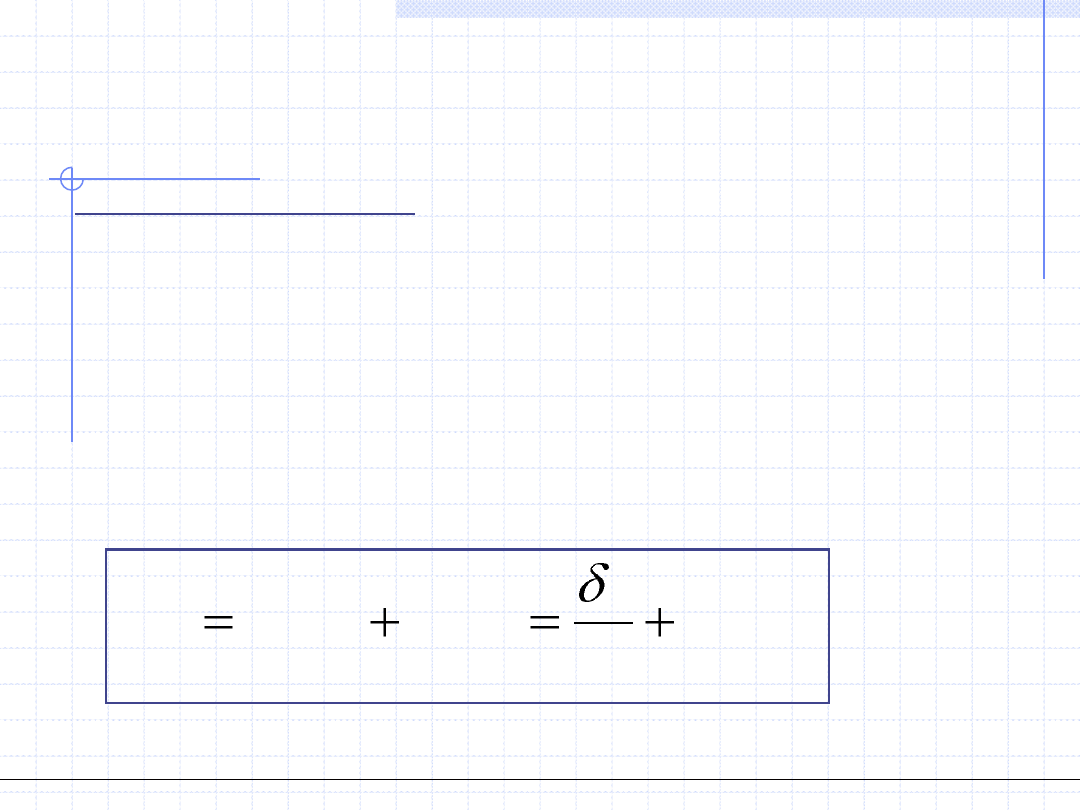
Ogólnotechniczne podstawy biotechnologii z grafiką inżynierską, Wydział Chemiczny Politechniki Wrocławskiej, 2009/2010, prof. Antoni Kozioł
II ZASADA TERMODYNAMIKI
II zasada termodynamiki posiada ogromną liczbę bardzo różnych sformułowań.
Dla celów termodynamiki procesowej podam sformułowanie oparte na tzw.
nierówności Clausiusa. Sformułowanie to opisuje zjawisko nieodwracalności
przemian termodynamicznych oraz uwzględnia klasyczną definicję entropii.
Załóżmy, że układ ulega dowolnej (odwracalnej lub nieodwracalnej) różniczkowej
przemianie termodynamicznej. W tej przemianie układ wymienia z otoczeniem
ciepło δq. W czasie przemiany zmieniać się mogą wszystkie parametry stanu.
Zmiana entropii wyniesie ds. Istnieją dwie przyczyny zmiany entropii:
1 - zmiana stanu energetycznego układu związana z wymianą ciepła,
2 - zmiana liczby dostępnych stanów energetycznych związana z
nieodwracalnymi efektami przemiany. Fakt ten można zapisać równaniem:
i
i
r
ds
T
q
ds
ds
ds
)
(
)
(
)
(
r – oznacza zmiany związane z odwracalnością przemiany (reversible)
i – oznacza zmiany związane z nieodwracalnością przemiany (irreversible)
Ogólnotechniczne podstawy biotechnologii z grafiką inżynierską, Wydział Chemiczny Politechniki Wrocławskiej, 2009/2010, prof. Antoni Kozioł
II ZASADA TERMODYNAMIKI cd.
Nierówność Clausiusa dotyczy tej części zmiany entropii, która jest związana
z nieodwracalnością przemian i stanowi jedno z wielu sformułowań II zasady
termodynamiki.
0
i
ds
Słownie oznacza to, że każda nieodwracalność powoduje wzrost entropii.
Ponieważ wszystkie przemiany samorzutne (odbywające się bez ingerencji
z zewnątrz) są nieodwracalne, z nierówności Clausiusa wynika, że w takich
przemianach entropia rośnie osiągając wartość maksymalną w stanie
równowagi, w którym mogą zachodzić tylko przemiany odwracalne.
Równość zachodzi tylko
w przypadku przemian
odwracalnych
Ogólnotechniczne podstawy biotechnologii z grafiką inżynierską, Wydział Chemiczny Politechniki Wrocławskiej, 2009/2010, prof. Antoni Kozioł
Proste przemiany
termodynamiczne
Spośród bardzo wielu możliwych przemian termodynamicznych szczególną
rolę odgrywają przemiany spełniające pewien prosty warunek. Warunek
ten najczęściej określa stałość określonego parametru lub funkcji stanu.
W nazwie stałość ta jest opisana za pomocą przedrostka „izo”.
Mamy zatem następujące przemiany proste:
1. Przemiana izochoryczna – V=const.
2. Przemiana izobaryczna – p=const.
3. Przemiana izotermiczna – T=const.
4. Przemiana izentropowa – S=const. (przemiana adiabatyczna)
5. Przemiana politropowa – C=const.
Teraz omówimy po kolei omówimy poszczególne przemiany.
Przemiany te będziemy ilustrować wykresami w układzie p – v
tzn. ciśnienie – objętość właściwa (będziemy zakładać przemiany
w układach zamkniętych czyli n=const.)
Ogólnotechniczne podstawy biotechnologii z grafiką inżynierską, Wydział Chemiczny Politechniki Wrocławskiej, 2009/2010, prof. Antoni Kozioł
Przemiana izochoryczna
.)
(
0
0
.
1
2
1
2
const
n
dla
v
v
dv
V
V
dV
const
V
0
0
0
0
.
w
w
pdv
w
dv
const
v
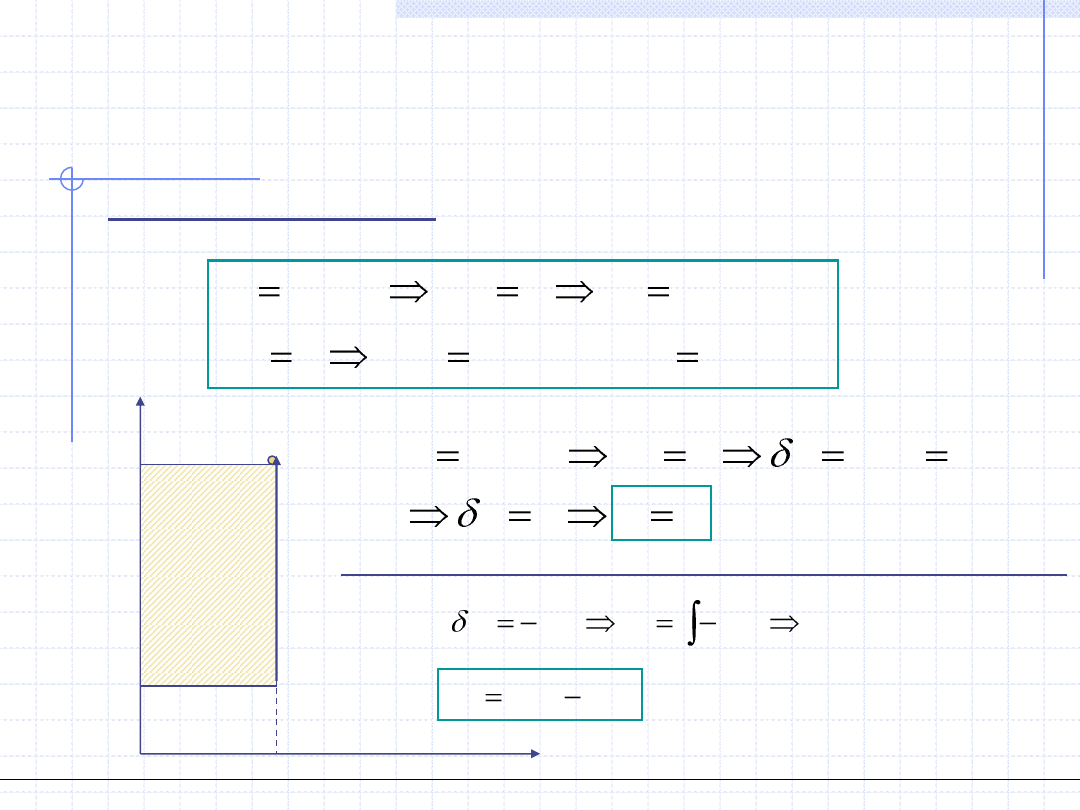
Przemiana izochoryczna odbywa się przy stałej objętości:
p
v
w
t
v=const.
p
1
,T
1
p
2
,T
2
Praca objętościowa w przemianie izochorycznej jest równa 0.
)
(
2
1
2
1
p
p
v
w
vdp
w
vdp
w
t
p
p
t
t
Wartość pracy technicznej przemiany
izochorycznej jest równa polu
zakreskowanego prostokąta.
Ogólnotechniczne podstawy biotechnologii z grafiką inżynierską, Wydział Chemiczny Politechniki Wrocławskiej, 2009/2010, prof. Antoni Kozioł
Przemiana izochoryczna cd.
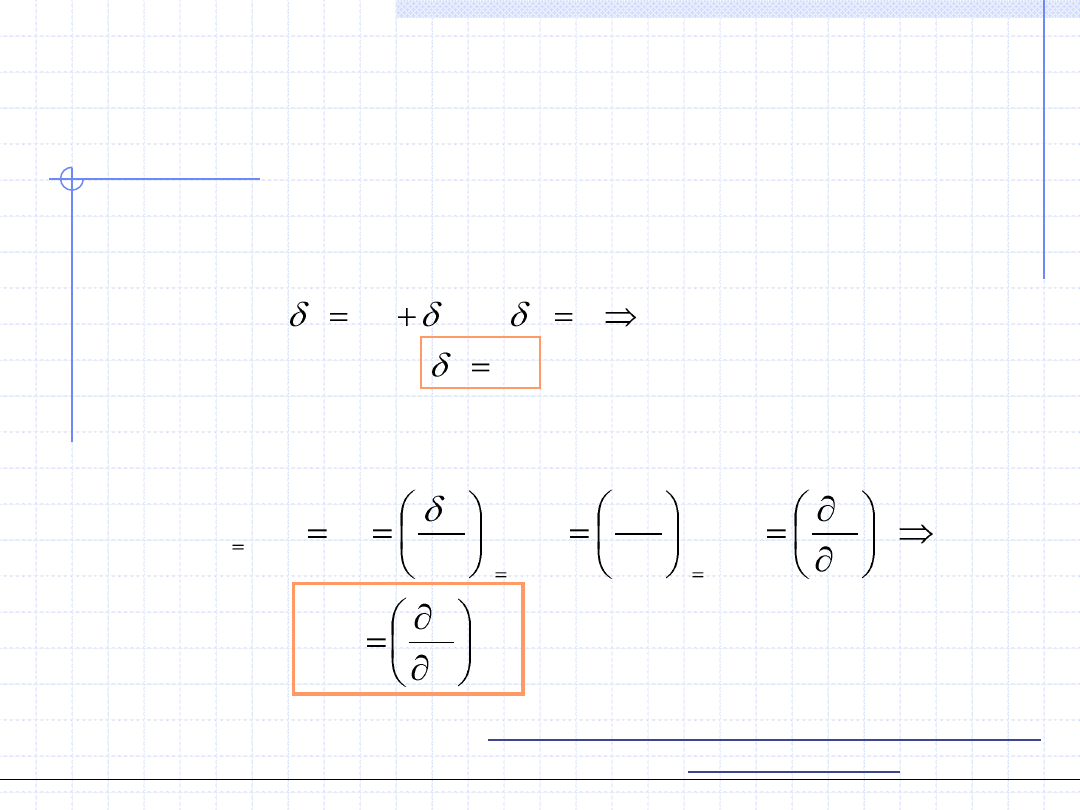
du
q
w
w
du
q
0
Rozpatrzmy teraz pojemność cieplną układu podczas przemiany
izochorycznej. Na mocy I zasady termodynamiki dla różniczkowej
przemiany można napisać:
Przypomnijmy teraz definicję właściwej pojemności cieplnej dla
rozważanej przemiany:
v
v
v
const
v
const
v
v
const
v
T
u
c
T
u
dT
du
dT
q
c
c
.
.
.
)
(
Wzór powyższy dowodzi, że pojemność cieplna w przemianie izochorycznej
jest pochodną funkcji stanu a zatem również jest funkcją stanu.
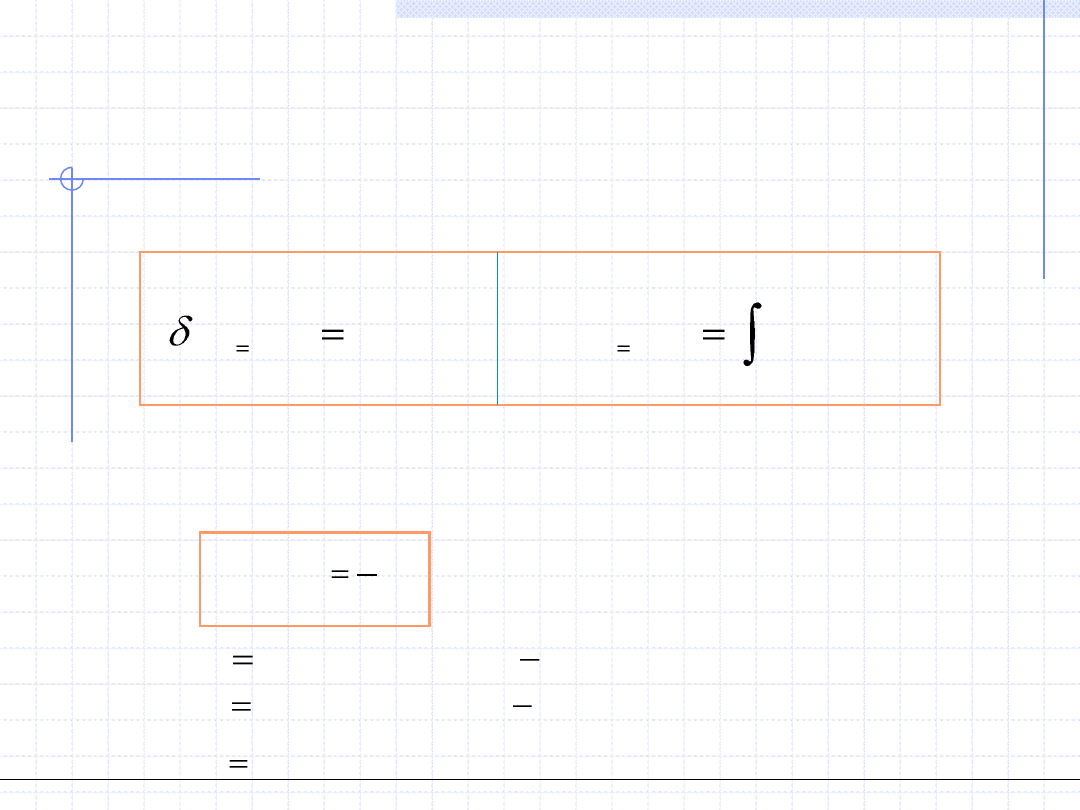
Ogólnotechniczne podstawy biotechnologii z grafiką inżynierską, Wydział Chemiczny Politechniki Wrocławskiej, 2009/2010, prof. Antoni Kozioł
Przemiana izochoryczna cd.
2
1
)
(
)
(
)
(
.
.
T
T
v
const
v
v
const
v
dT
T
c
q
dT
c
q
:
2
)
(
)
(
gdzie
R
k
c
GD
v
atomowych
gazów
dla
k
1
3
Wielkość c
v
zależy od temperatury, ciśnienia i rodzaju ośrodka. Zależność
od temperatury pozwala na wyznaczenie ciepła przemiany izochorycznej:
Dla gazów doskonałych, z teorii kinetycznej wynika że wielkość c
v
powinna
być stała i równa:
atomowych
gazów
dla
k
2
5
wych
wieloatomo
gazów
dla
k
6
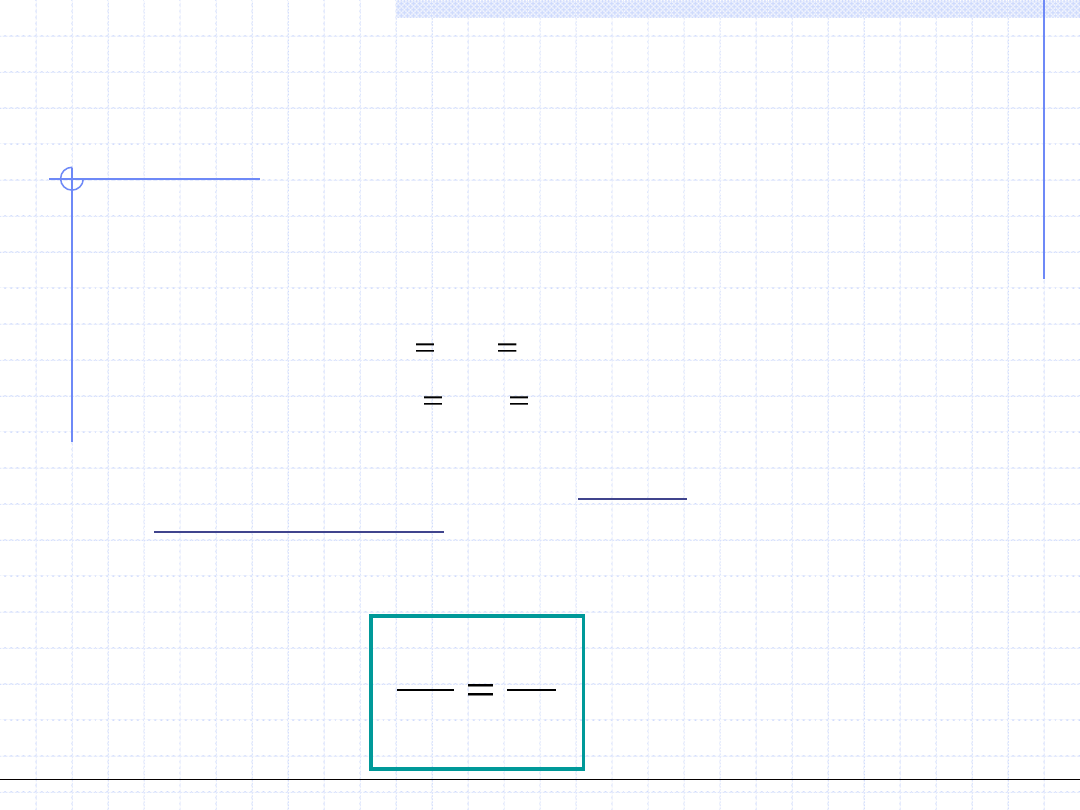
Ogólnotechniczne podstawy biotechnologii z grafiką inżynierską, Wydział Chemiczny Politechniki Wrocławskiej, 2009/2010, prof. Antoni Kozioł
Przemiana izochoryczna cd.
2
2
2
2
1
1
1
1
RT
v
p
v
p
RT
v
p
v
p
Rozpatrzmy jeszcze dokładniej przemianę izochoryczną gazów doskonałych.
W każdy punkcie takiej przemiany musi być spełnione równanie stanu gazu
doskonałego. Dla punku początkowego i końcowego mamy:
Dzieląc stronami otrzymujemy tzw. równanie
przemiany izochorycznej uzależniające ciśnienie
i temperaturę w skrajnych punktach przemiany:
1
2
1
2
T
T
p
p
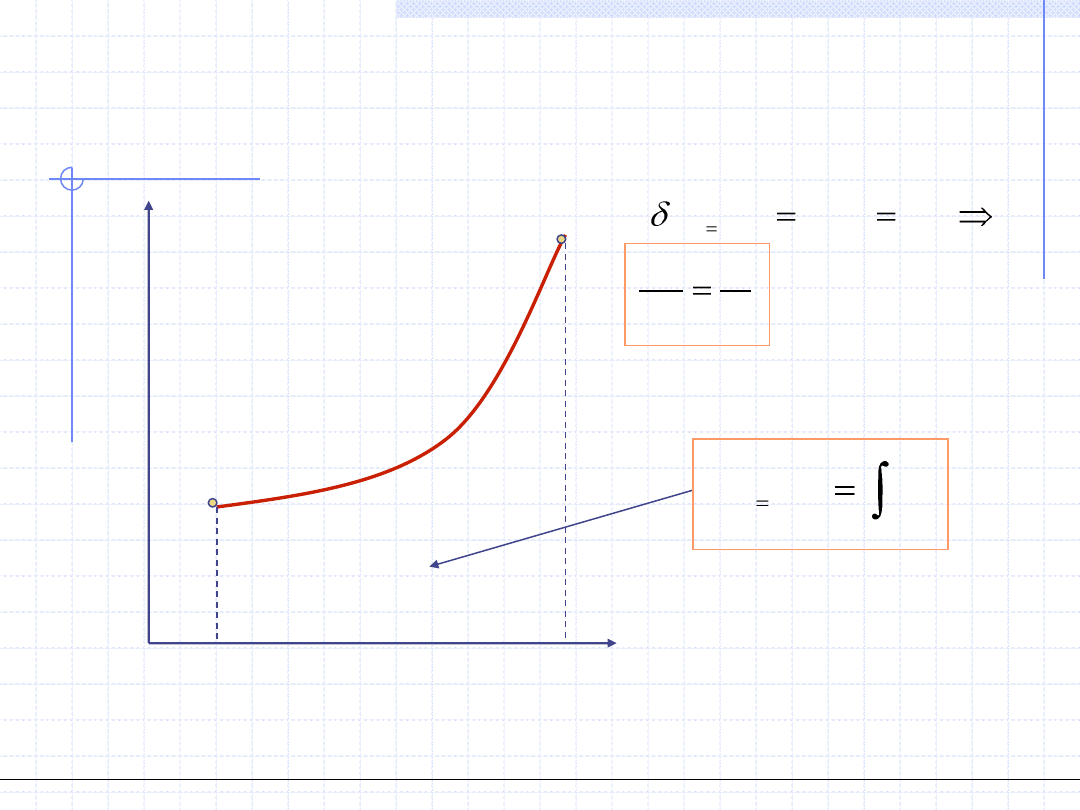
Ogólnotechniczne podstawy biotechnologii z grafiką inżynierską, Wydział Chemiczny Politechniki Wrocławskiej, 2009/2010, prof. Antoni Kozioł
Przemiana izochoryczna cd.
2
1
.
)
(
s
s
const
v
Tds
q
T
s
1
2
s
1
s
2
v
v
const
v
c
T
ds
dT
Tds
dT
c
q
.
)
(
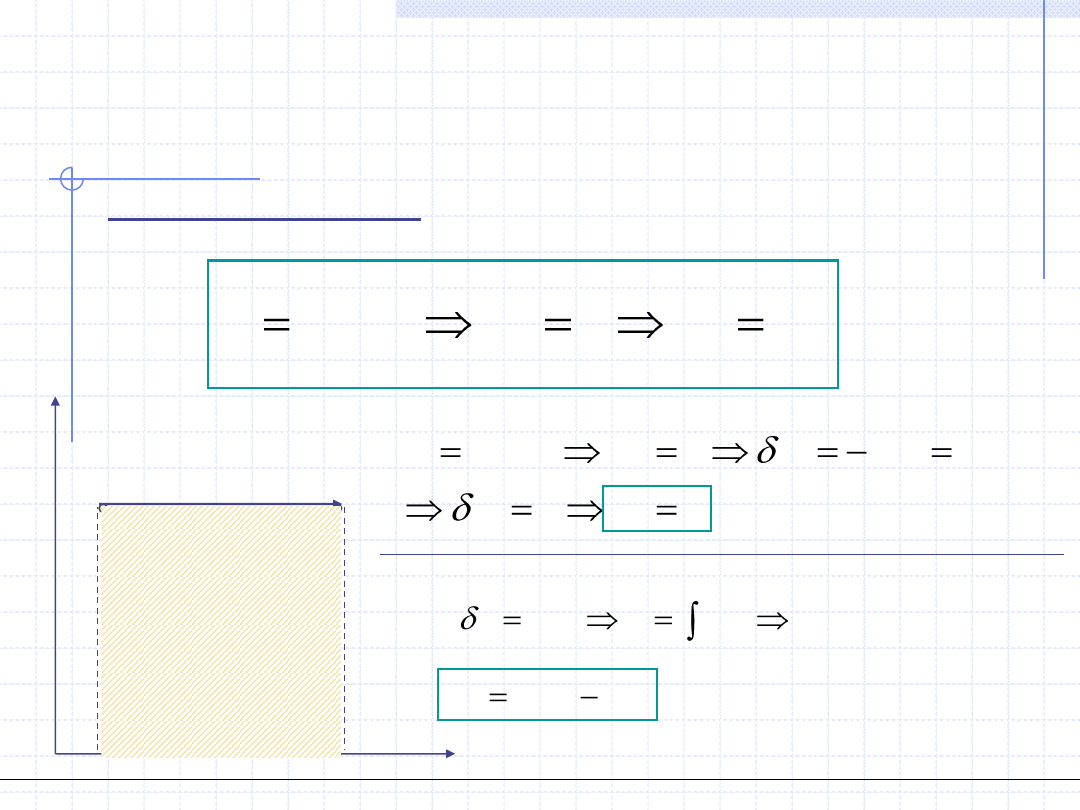
Ogólnotechniczne podstawy biotechnologii z grafiką inżynierską, Wydział Chemiczny Politechniki Wrocławskiej, 2009/2010, prof. Antoni Kozioł
Przemiana izobaryczna
1
2
0
.
p
p
dp
const
p
0
0
0
0
.
t
t
t
w
w
vdp
w
dp
const
p
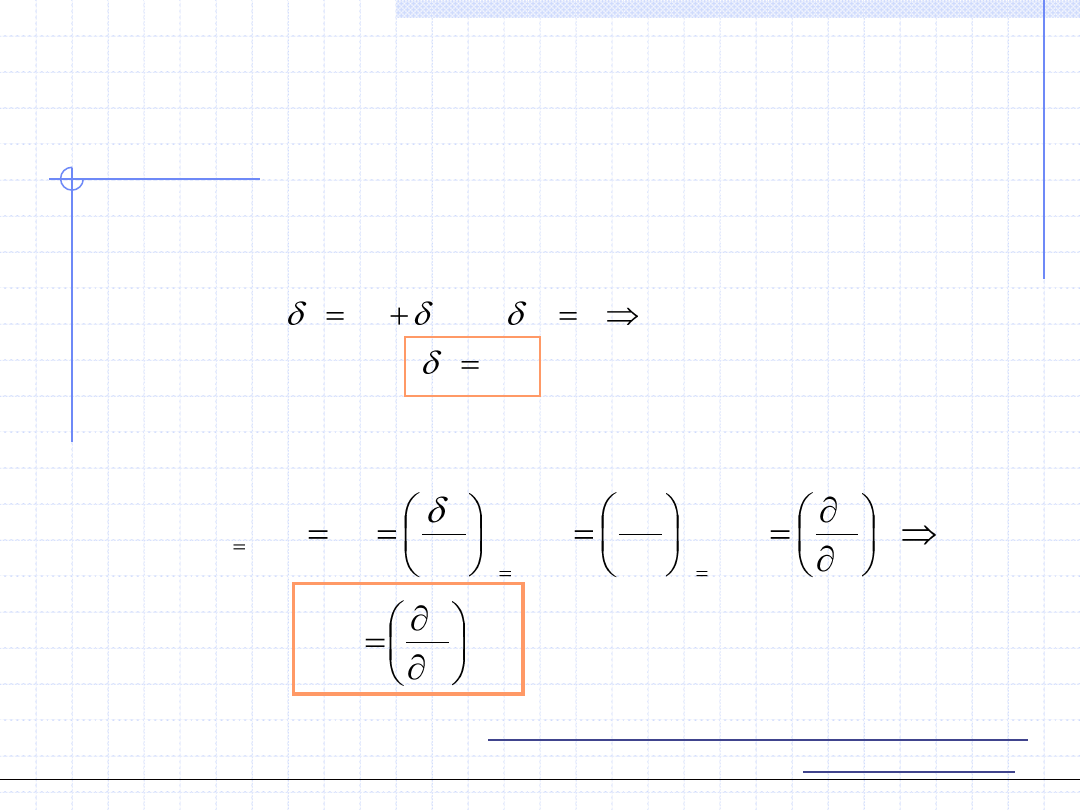
Przemiana izobaryczna odbywa się przy stałym ciśnieniu:
p
v
p=const.
v
1
,T
1
v
2
,T
2
Praca techniczna w przemianie izobarycznej jest równa 0.
)
(
1
2
2
1
v
v
p
w
pdv
w
pdv
w
v
v
Praca objętościowa przemiany
izobarycznej jest równa polu
zakreskowanego prostokąta.
w
Ogólnotechniczne podstawy biotechnologii z grafiką inżynierską, Wydział Chemiczny Politechniki Wrocławskiej, 2009/2010, prof. Antoni Kozioł
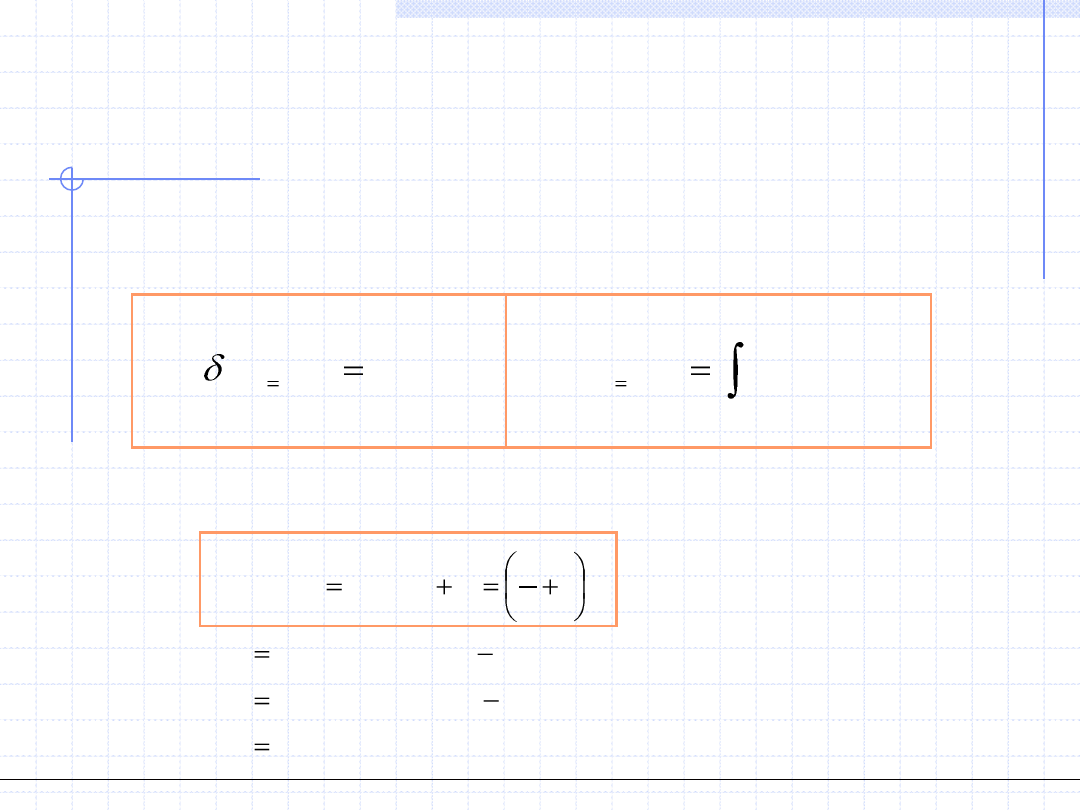
Przemiana izobaryczna cd.
dh
q
w
w
dh
q
t
t
0
Rozpatrzmy teraz pojemność cieplną układu podczas przemiany
izobarycznej. Na mocy I zasady termodynamiki dla różniczkowej
przemiany można napisać:
Przypomnijmy teraz definicję właściwej pojemności cieplnej dla
rozważanej przemiany:
v
p
p
const
p
const
p
p
const
p
T
h
c
T
h
dT
dh
dT
q
c
c
.
.
.
)
(
Wzór powyższy dowodzi, że pojemność cieplna w przemianie izobarycznej
jest pochodną funkcji stanu (entalpii) a zatem również jest funkcją stanu.
Ogólnotechniczne podstawy biotechnologii z grafiką inżynierską, Wydział Chemiczny Politechniki Wrocławskiej, 2009/2010, prof. Antoni Kozioł
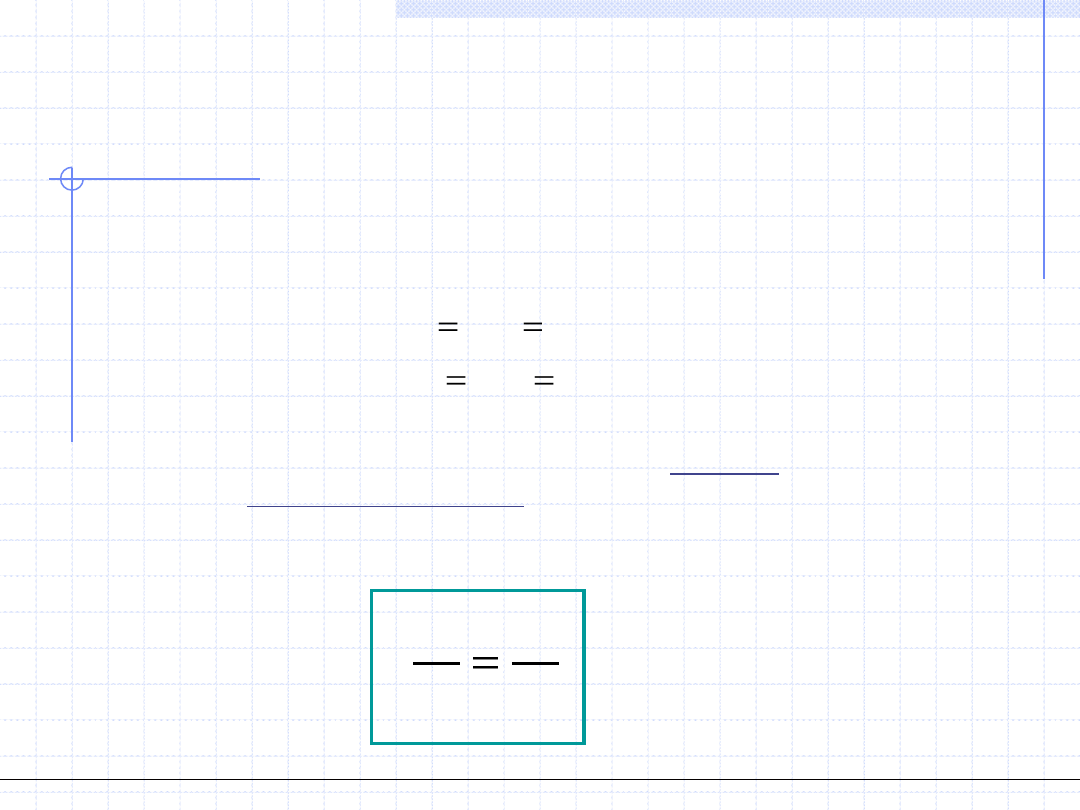
Przemiana izobaryczna cd.
2
1
)
(
)
(
)
(
.
.
T
T
p
const
p
p
const
p
dT
T
c
q
dT
c
q
Wielkość c
p
zależy od temperatury, ciśnienia i rodzaju ośrodka. Zależność
od temperatury pozwala na wyznaczenie ciepła przemiany izobarycznej:
Dla gazów doskonałych, z teorii kinetycznej wynika że wielkość c
p
powinna
być stała i równa:
wych
wieloatomo
gazów
dla
k
atomowych
gazów
dla
k
atomowych
gazów
dla
k
gdzie
R
k
R
c
c
GD
v
GD
p
6
2
5
1
3
:
1
2
)
(
)
(
)
(
)
(
Ogólnotechniczne podstawy biotechnologii z grafiką inżynierską, Wydział Chemiczny Politechniki Wrocławskiej, 2009/2010, prof. Antoni Kozioł
Przemiana izobaryczna cd.
2
2
2
2
1
1
1
1
RT
pv
v
p
RT
pv
v
p
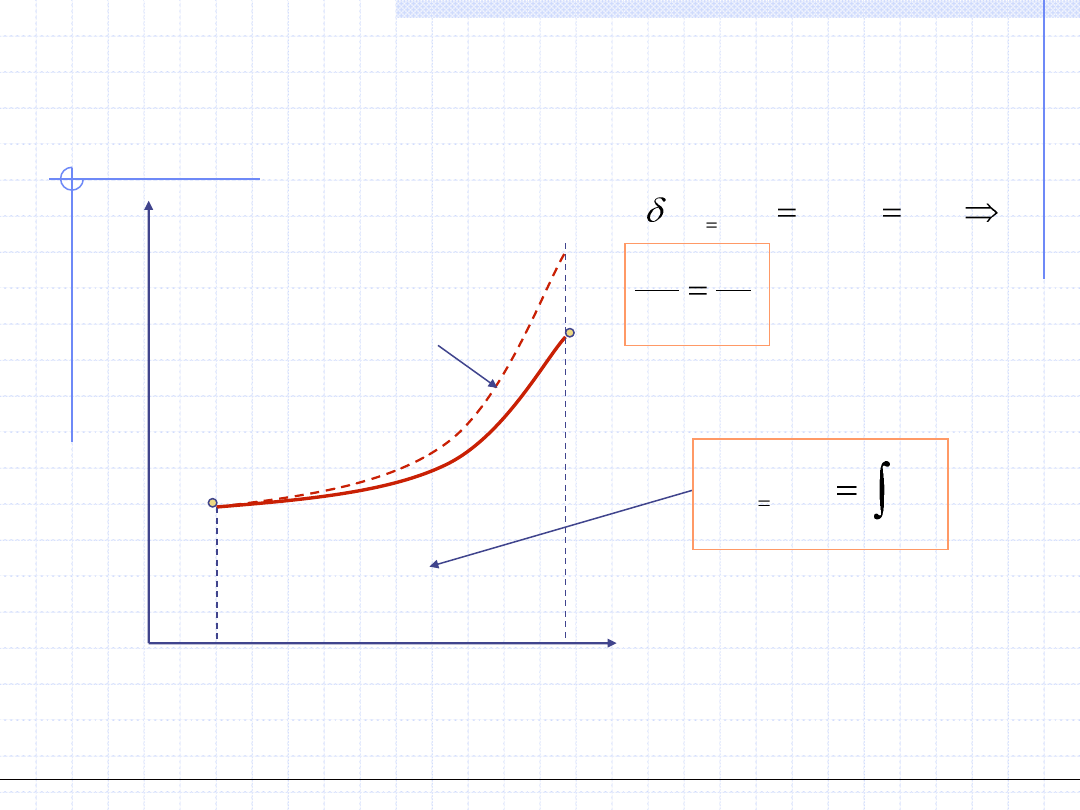
Rozpatrzmy jeszcze dokładniej przemianę izobaryczną gazów doskonałych.
W każdy punkcie takiej przemiany musi być spełnione równanie stanu gazu
doskonałego. Dla punku początkowego i końcowego mamy:
Dzieląc stronami otrzymujemy tzw. równanie
przemiany izobarycznej uzależniające objętość
i temperaturę w skrajnych punktach przemiany:
1
2
1
2
T
T
v
v
Ogólnotechniczne podstawy biotechnologii z grafiką inżynierską, Wydział Chemiczny Politechniki Wrocławskiej, 2009/2010, prof. Antoni Kozioł
2
1
.
)
(
s
s
const
p
Tds
q
T
s
1
2
s
1
s
2
p
p
const
p
c
T
ds
dT
Tds
dT
c
q
.
)
(
v=const.
Przemiana izobaryczna cd.
Ale c
p
>c
v
Ogólnotechniczne podstawy biotechnologii z grafiką inżynierską, Wydział Chemiczny Politechniki Wrocławskiej, 2009/2010, prof. Antoni Kozioł
18
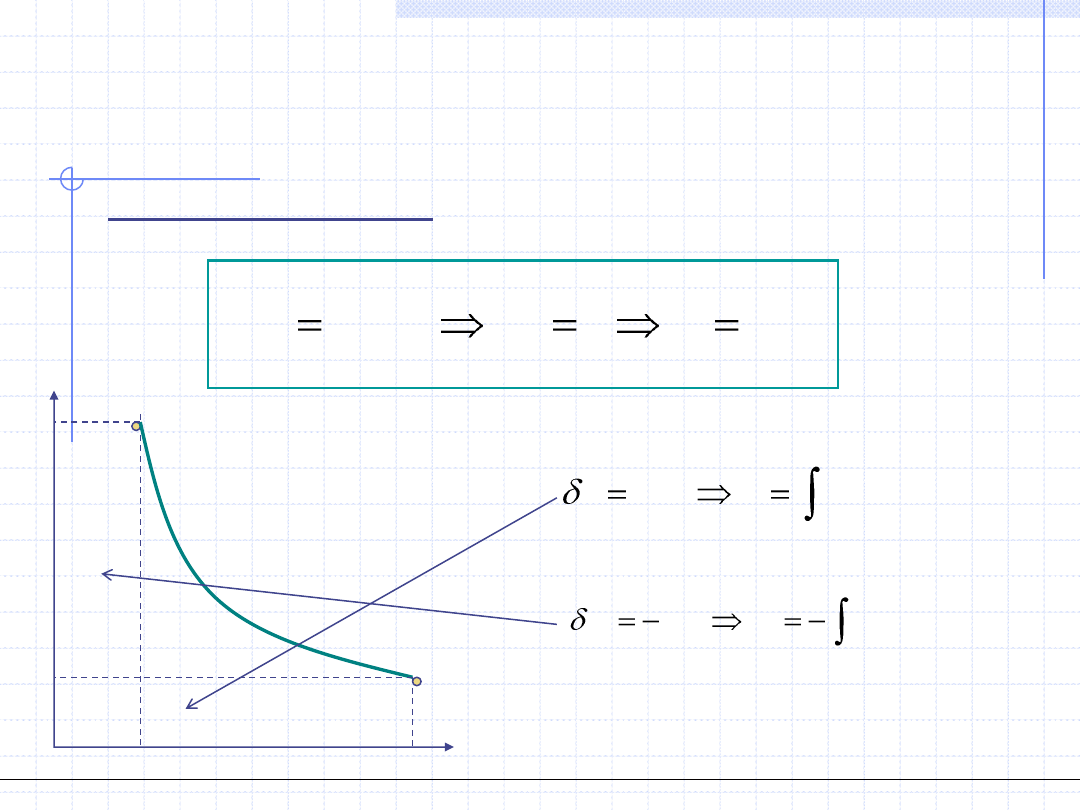
Przemiana izotermiczna
1
2
0
.
T
T
dT
const
T
2
1
)
(
v
v
dv
v
p
w
pdv
w
Przemiana izotermiczna odbywa się w stałej temperaturze:
p
v
v
1
,p
1
v
2
,p
2
2
1
)
(
p
p
t
t
dp
p
v
w
vdp
w
Ogólnotechniczne podstawy biotechnologii z grafiką inżynierską, Wydział Chemiczny Politechniki Wrocławskiej, 2009/2010, prof. Antoni Kozioł
19
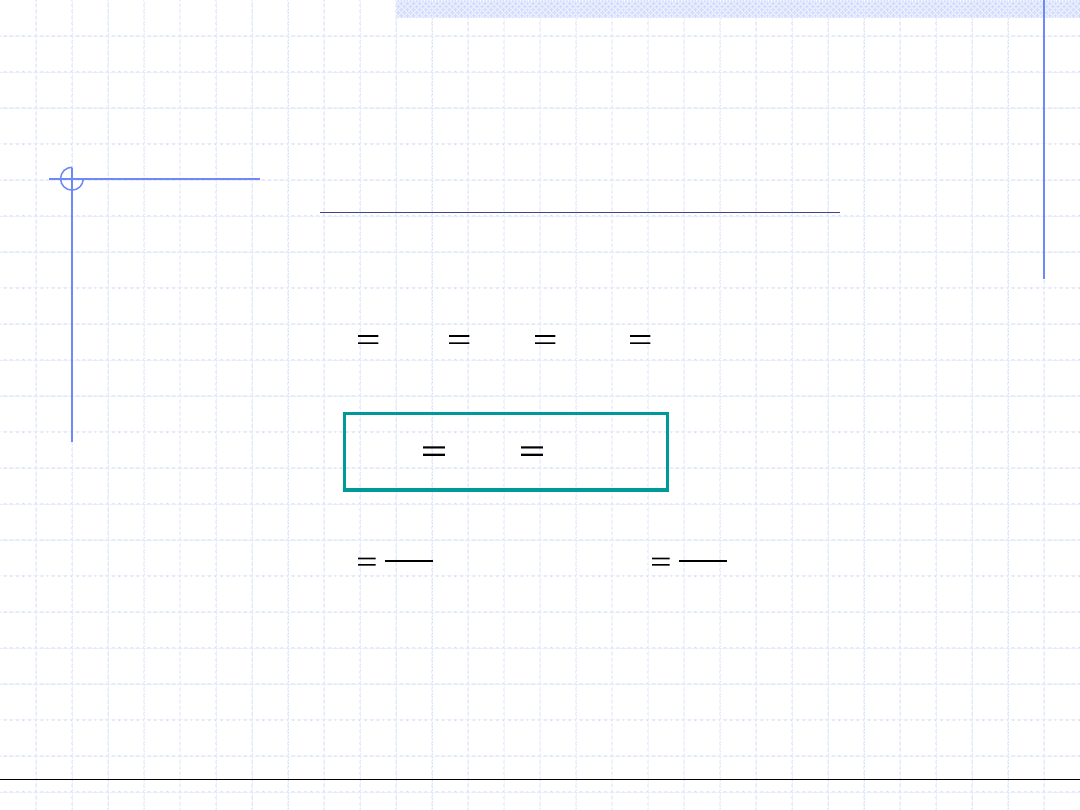
Przemiana izotermiczna cd.
2
2
2
1
1
1
v
p
RT
RT
RT
v
p
p
RT
p
v
v
RT
v
p
GD
GD
)
(
)
(
)
(
)
(
Rozpatrzmy teraz przemianę izotermiczną gazów doskonałych.
W każdy punkcie takiej przemiany musi być spełnione równanie stanu gazu
doskonałego. Dla punku początkowego i końcowego mamy:
Wyrażenia powyższe pozwalają na wyprowadzenie wzorów określających
pracę oraz pracę techniczną w przemianie izotermicznej gazów doskonałych:
.
const
RT
pv
Ogólnotechniczne podstawy biotechnologii z grafiką inżynierską, Wydział Chemiczny Politechniki Wrocławskiej, 2009/2010, prof. Antoni Kozioł
20
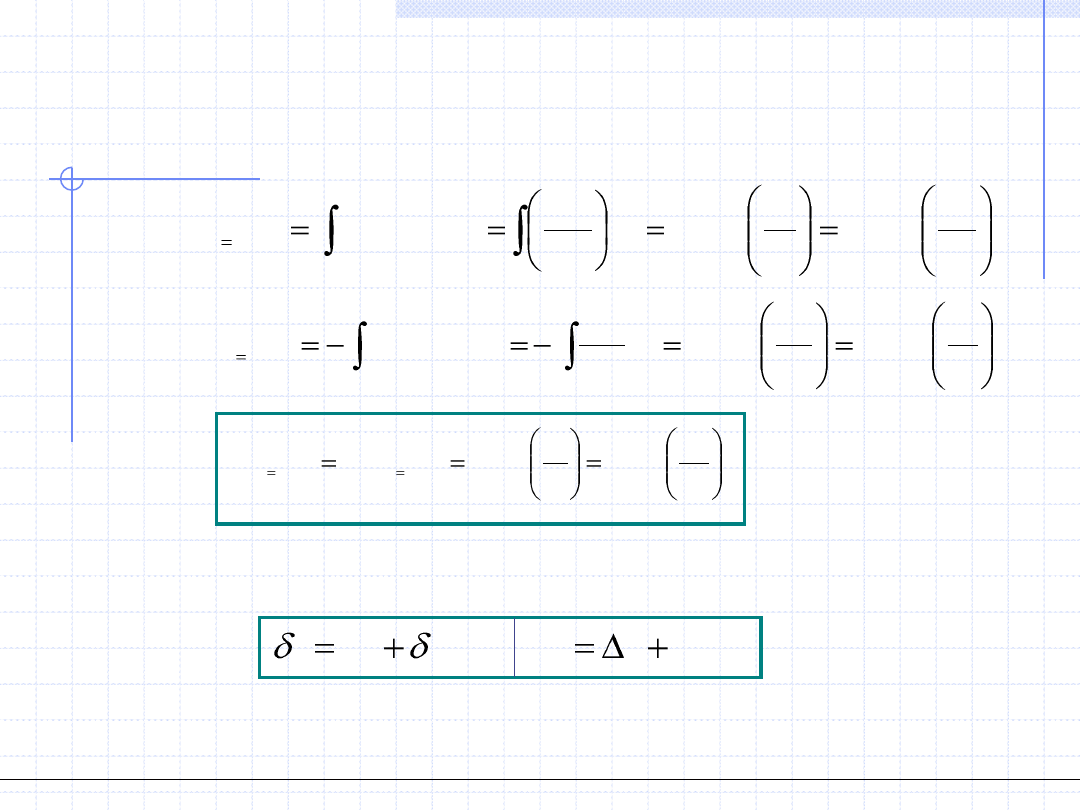
Przemiana izotermiczna cd.
w
u
q
w
du
q
2
1
1
2
)
(
)
(
.
ln
ln
)
(
)
(
2
1
2
1
p
p
RT
v
v
RT
dv
v
RT
dv
v
p
w
v
v
v
v
GD
GD
const
T
2
1
1
2
)
(
.
)
(
.
ln
ln
)
(
)
(
p
p
RT
v
v
RT
w
w
GD
const
T
t
GD
const
T
W celu wyznaczenia ciepła przemiany izotermicznej należy zastosować
I zasadę termodynamiki:
1
2
2
1
)
(
)
(
.
ln
ln
)
(
)
(
2
1
2
1
v
v
RT
p
p
RT
dp
p
RT
dp
p
v
w
p
p
p
p
GD
GD
const
T
t
Ogólnotechniczne podstawy biotechnologii z grafiką inżynierską, Wydział Chemiczny Politechniki Wrocławskiej, 2009/2010, prof. Antoni Kozioł
21
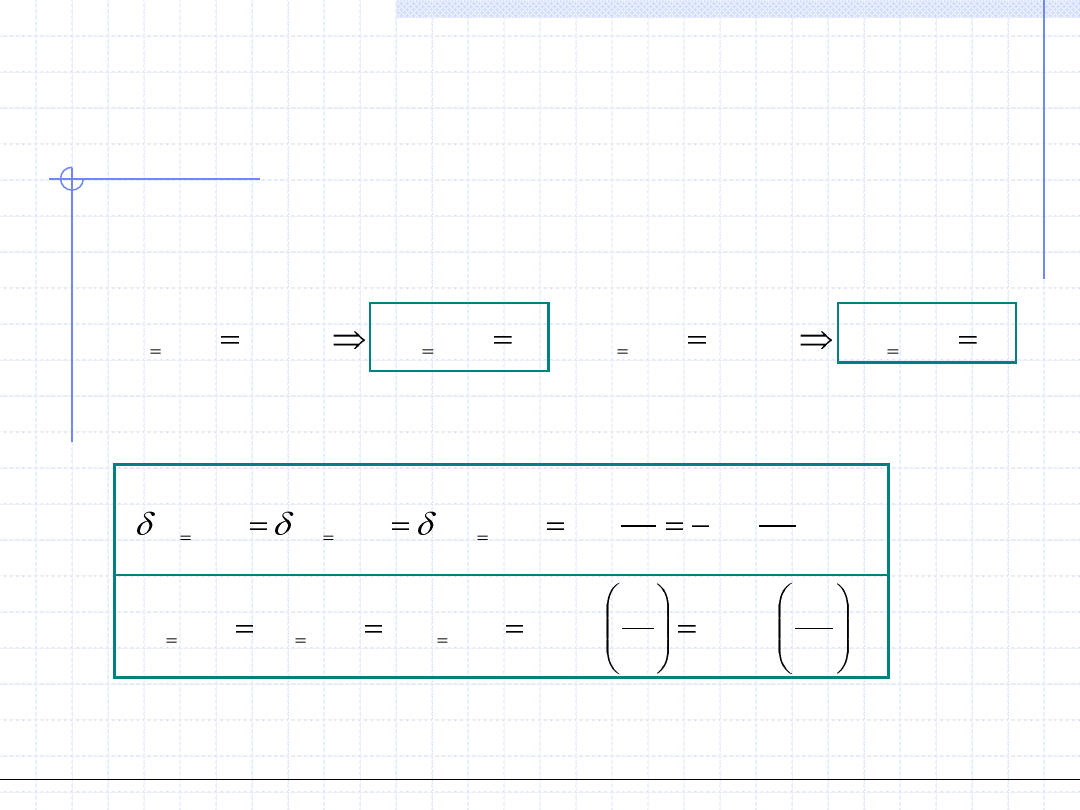
Przemiana izotermiczna cd.
2
1
1
2
)
(
.
,
)
(
.
)
(
.
)
(
.
,
)
(
.
)
(
.
ln
ln
p
p
RT
v
v
RT
w
w
q
p
dp
RT
v
dv
RT
w
w
q
GD
const
T
t
GD
const
T
GD
const
T
GD
const
T
t
GD
const
T
GD
const
T
W przypadku przemiany gazu doskonałego można zauważyć, że jego
energia wewnętrzna i entalpia zależą tylko od temperatury. Zatem w stałej
temperaturze zarówno „u” jak i „h” są stałe czyli:
0
.
0
.
)
(
.
)
(
.
)
(
.
)
(
.
GD
const
T
GD
const
T
GD
const
T
GD
const
T
dh
const
h
du
const
u
Uwzględniając I zasadę termodynamiki otrzymujemy wzory określające
ciepło przemiany izotermicznej gazów doskonałych:
Ogólnotechniczne podstawy biotechnologii z grafiką inżynierską, Wydział Chemiczny Politechniki Wrocławskiej, 2009/2010, prof. Antoni Kozioł
22
)
(
)
(
1
2
.
2
1
s
s
T
Tds
q
s
s
const
T
T
s
1
2
s
1
s
2
Przemiana izotermiczna cd.
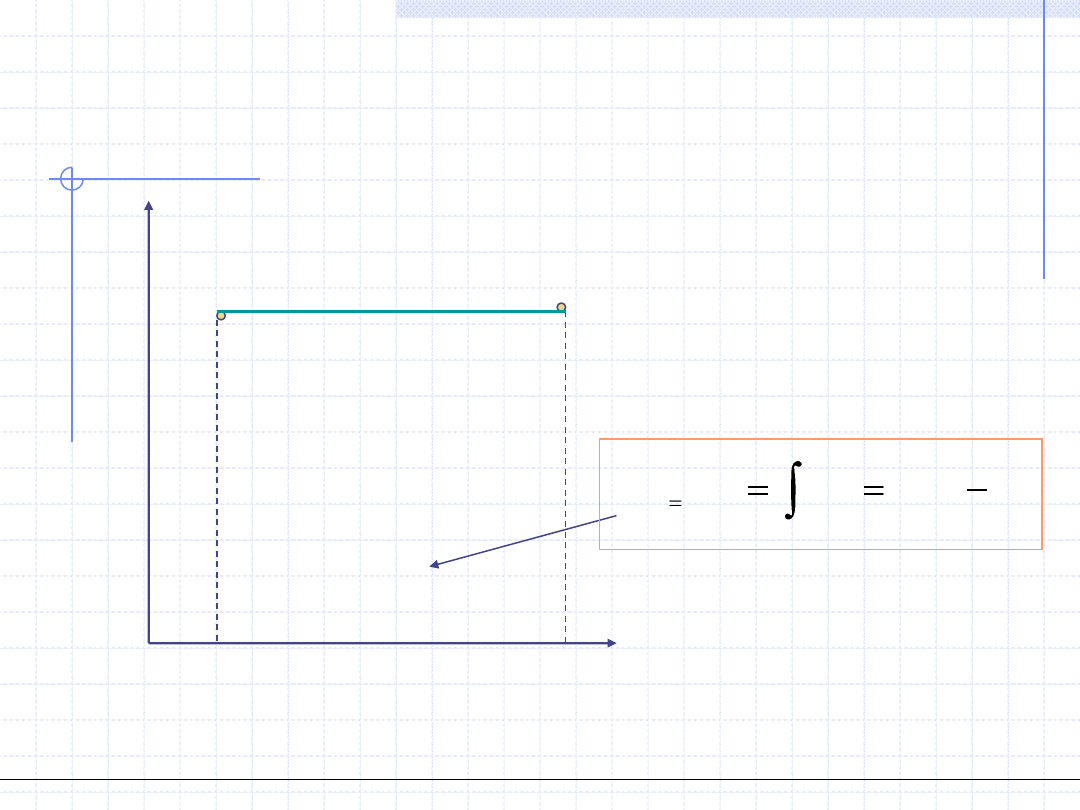
T=const.
Wykres przemiany izotermicznej w układzie T – s jest
szczególnie prosty:
Ogólnotechniczne podstawy biotechnologii z grafiką inżynierską, Wydział Chemiczny Politechniki Wrocławskiej, 2009/2010, prof. Antoni Kozioł
23
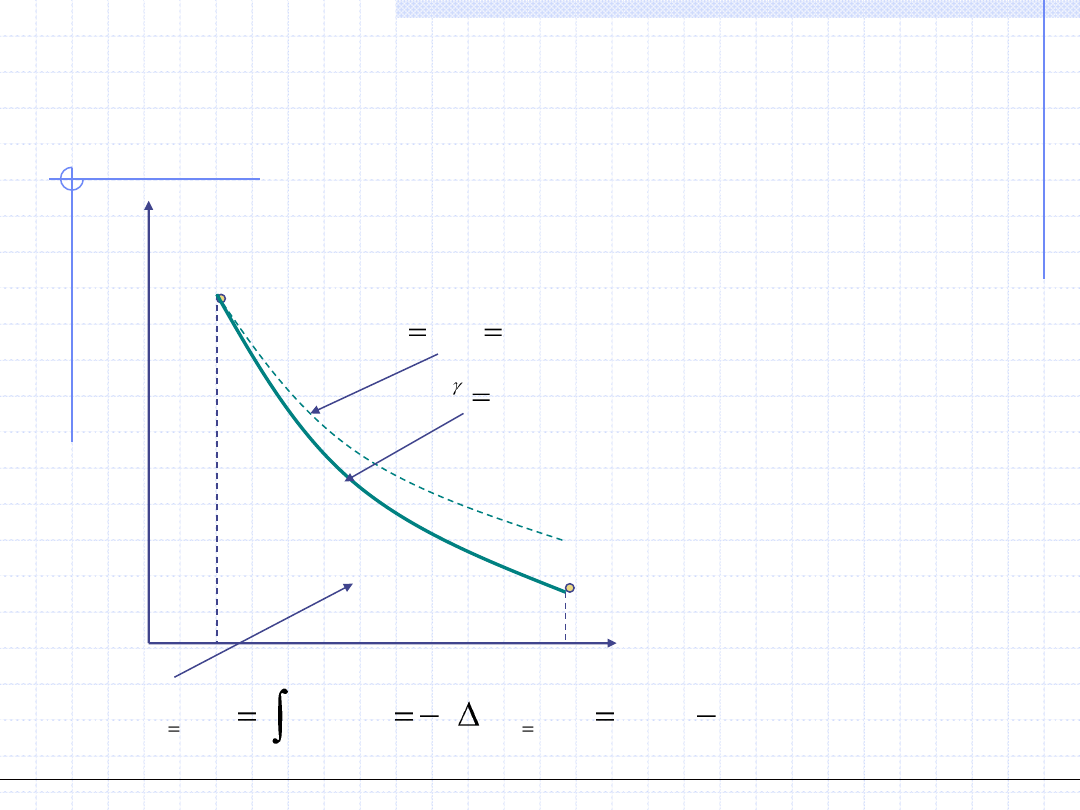
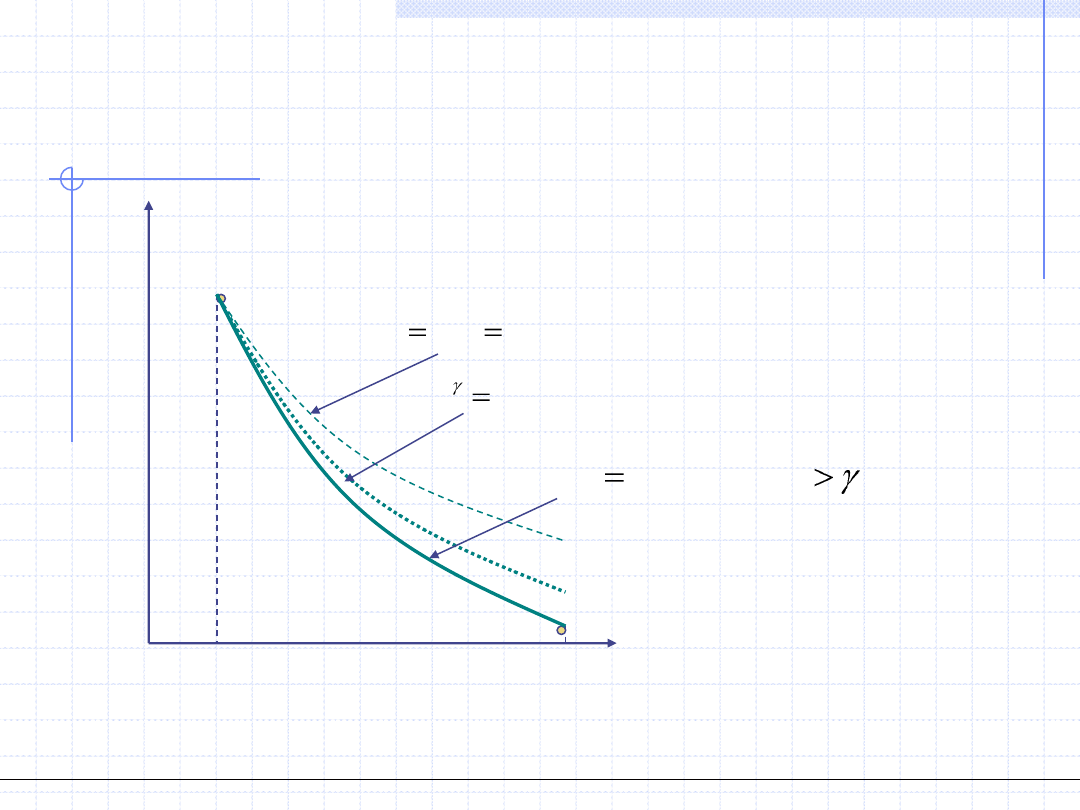
Przemiana adiabatyczna
(izentropowa)
1
2
0
0
s
s
const
s
ds
q
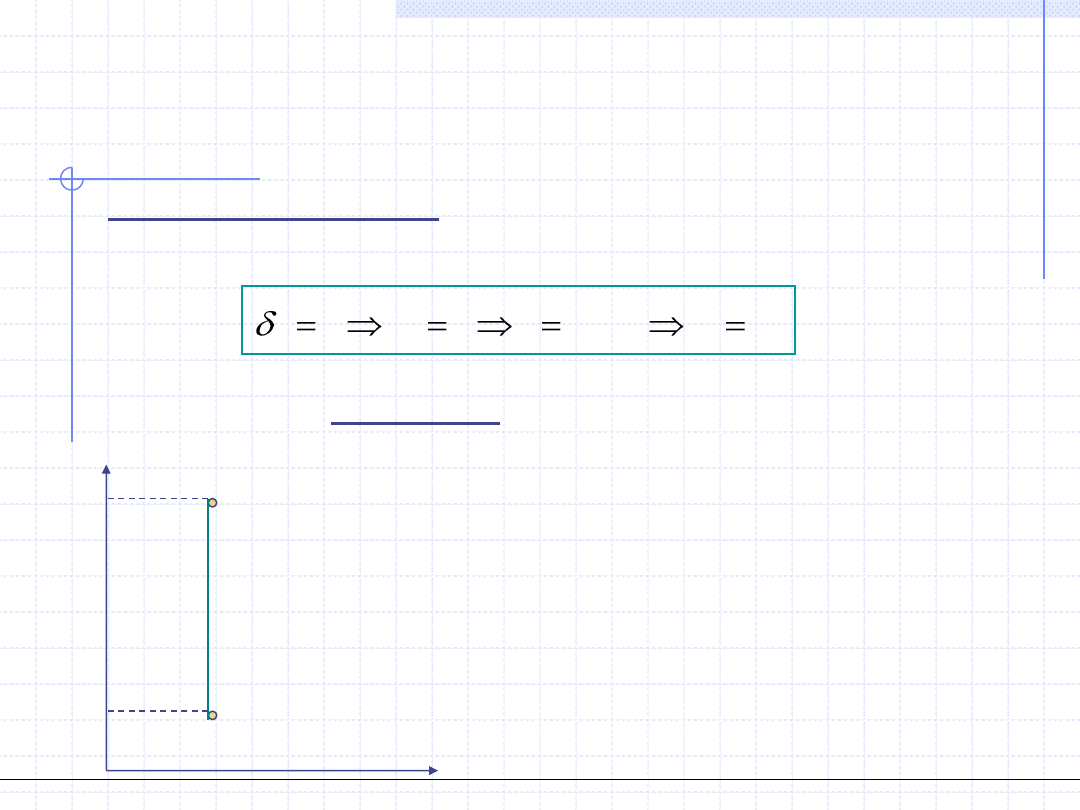
Przemiana adiabatyczna odbywa się w układzie adiabatycznym tzn. bez
wymiany ciepła z otoczeniem. Jeżeli jednocześnie jest to przemiana
odwracalna to wtedy:
Oznacza to, że odwracalna przemiana adiabatyczna odbywa się przy stałej
entropii czyli jest izentropowa. Wykres przemiany izentropowej jest
szczególnie prosty w układzie T – s.
T
s
1
2
W przemianie adiabatycznej układ może
wymieniać z otoczeniem energię mechaniczną
czyli wykonywać pracę (lub praca może być
wykonana na układzie). W celu wyznaczenia
tej pracy konieczna jest znajomość zależności
ciśnienia od objętości czyli konieczna jest
znajomość tzw. równania przemiany. Równanie
to można wyprowadzić dla gazu doskonałego.
Ogólnotechniczne podstawy biotechnologii z grafiką inżynierską, Wydział Chemiczny Politechniki Wrocławskiej, 2009/2010, prof. Antoni Kozioł
24
Przemiana adiabatyczna gazu
doskonałego
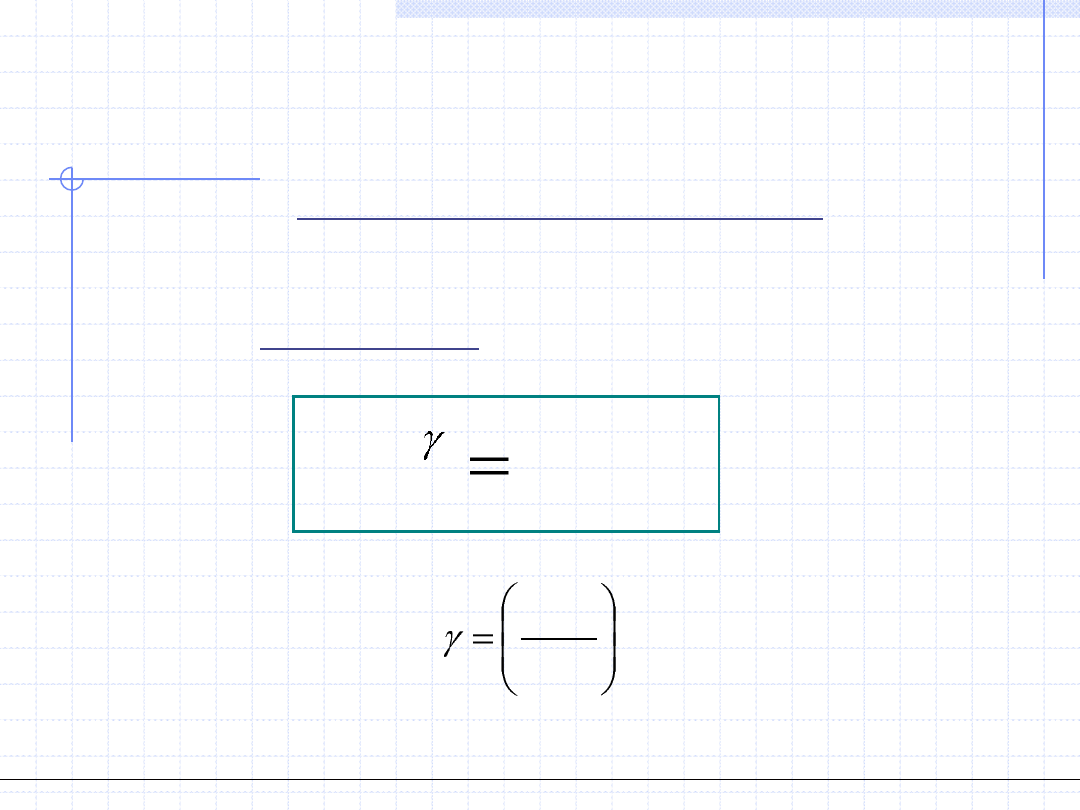
Rozpatrzmy teraz przemianę adiabatyczną gazów doskonałych.
Wychodząc z I zasady termodynamiki oraz uwzględniając własności gazów
doskonałych można wyprowadzić zależność między ciśnieniem a objętością
w postaci tzw. równania adiabaty:
const
pv
)
(
)
(
GD
v
GD
p
c
c
gdzie
Ogólnotechniczne podstawy biotechnologii z grafiką inżynierską, Wydział Chemiczny Politechniki Wrocławskiej, 2009/2010, prof. Antoni Kozioł
25
Przemiana adiabatyczna gazu
doskonałego
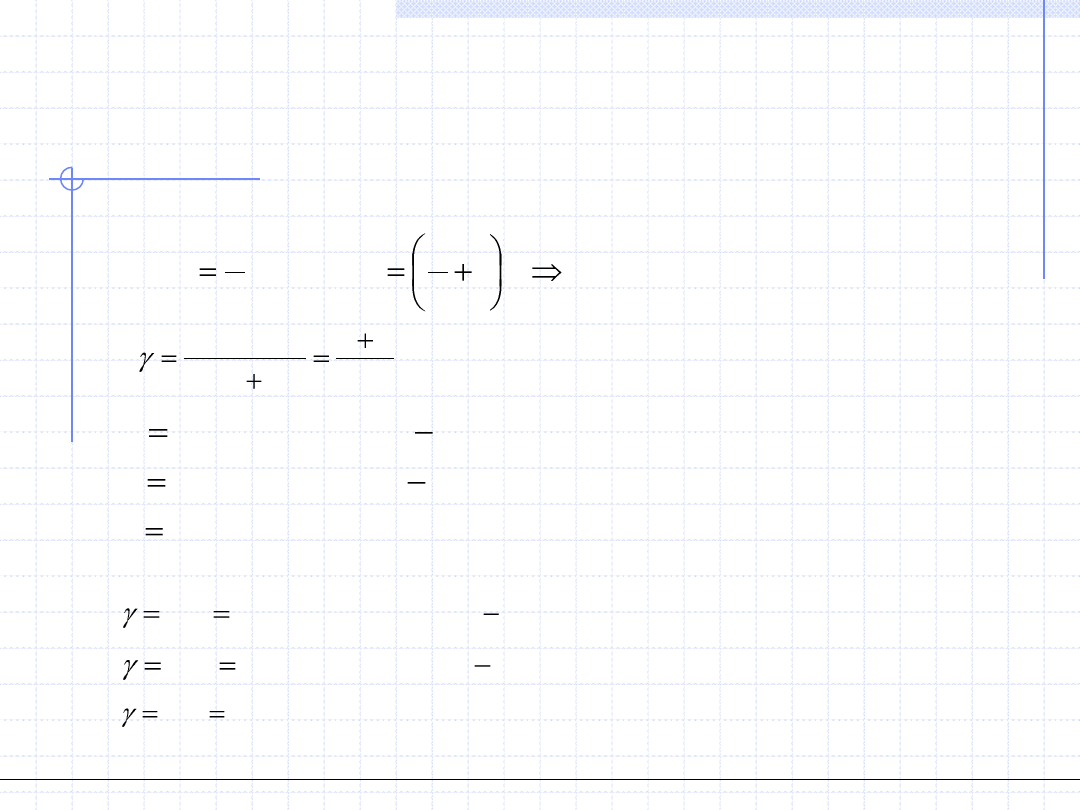
Wielkość γ dla gazów doskonałych jest stała i wynosi:
R
k
c
R
k
c
GD
p
GD
v
1
2
2
)
(
)
(
:
2
)
1
2
/
(
)
2
/
(
gdzie
k
k
R
k
R
k
atomowych
gazów
dla
k
1
3
atomowych
gazów
dla
k
2
5
wych
wieloatomo
gazów
dla
k
6
atomowych
gazów
dla
1
667
.
1
3
/
5
atomowych
gazów
dla
2
4
.
1
5
/
7
wych
wieloatomo
gazów
dla
333
.
1
6
/
8
Ogólnotechniczne podstawy biotechnologii z grafiką inżynierską, Wydział Chemiczny Politechniki Wrocławskiej, 2009/2010, prof. Antoni Kozioł
26
)
(
)
(
)
(
)
(
2
1
)
(
.
)
(
2
1
T
T
c
u
dv
v
p
w
v
GD
const
s
v
v
GD
const
s
p
v
1(p
1
,v
1
,T
1
)
2(p
2
,v
2
,T
2
)
Przemiana adiabatyczna cd.
.
const
RT
pv
.
const
pv
Ogólnotechniczne podstawy biotechnologii z grafiką inżynierską, Wydział Chemiczny Politechniki Wrocławskiej, 2009/2010, prof. Antoni Kozioł
27
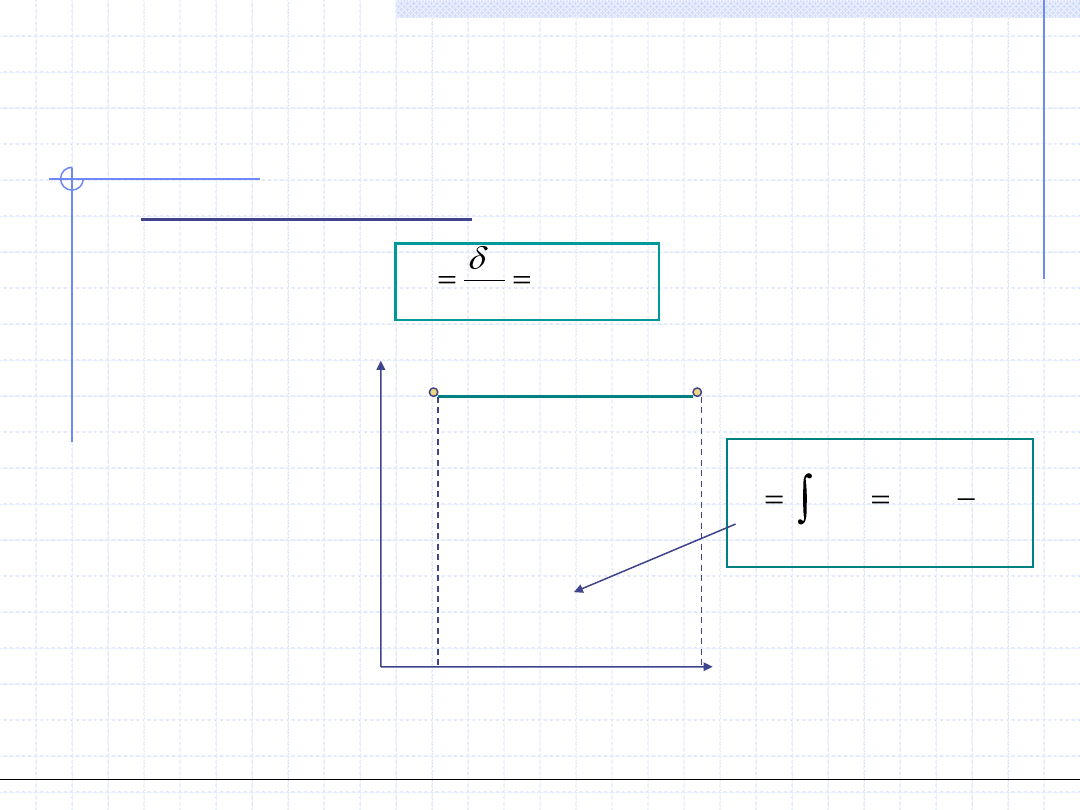
Przemiana politropowa
.
const
dT
q
c
W przemianie politropowej stała jest pojemność cieplna układu:
T
1(p
1
,v
1
,T
1
)
2(p
2
,v
2
,T
2
)
c
2
1
)
(
1
2
T
T
T
T
c
cdT
q
Szczególnie proste do obliczenia w przemianie politropowej jest ciepło przemiany,
które jest równe polu prostokąta na wykresie c – T.
Ogólnotechniczne podstawy biotechnologii z grafiką inżynierską, Wydział Chemiczny Politechniki Wrocławskiej, 2009/2010, prof. Antoni Kozioł
28
Przemiana politropowa gazu
doskonałego
Rozpatrzmy teraz przemianę politropową gazów doskonałych.
Podobnie jak dla przemiany adiabatycznej wychodząc z I zasady termodynamiki
i uwzględniając własności gazów doskonałych oraz definicję pojemności cieplnej
można wyprowadzić tzw. równanie politropy:
const
pv
m
)
(
)
(
)
(
)
(
GD
GD
v
GD
GD
p
c
c
c
c
m
gdzie
Bezwymiarowa wielkość „m” jest to wykładnik politropy i ma znaczenie
analogiczne jak wykładnik adiabaty.
Ogólnotechniczne podstawy biotechnologii z grafiką inżynierską, Wydział Chemiczny Politechniki Wrocławskiej, 2009/2010, prof. Antoni Kozioł
29
)
(
.
m
const
pv
m
p
1(p
1
,v
1
,T
1
)
2(p
2
,v
2
,T
2
)
Przemiana politropowa
Wykres w układzie p - v
.
const
RT
pv
.
const
pv
v
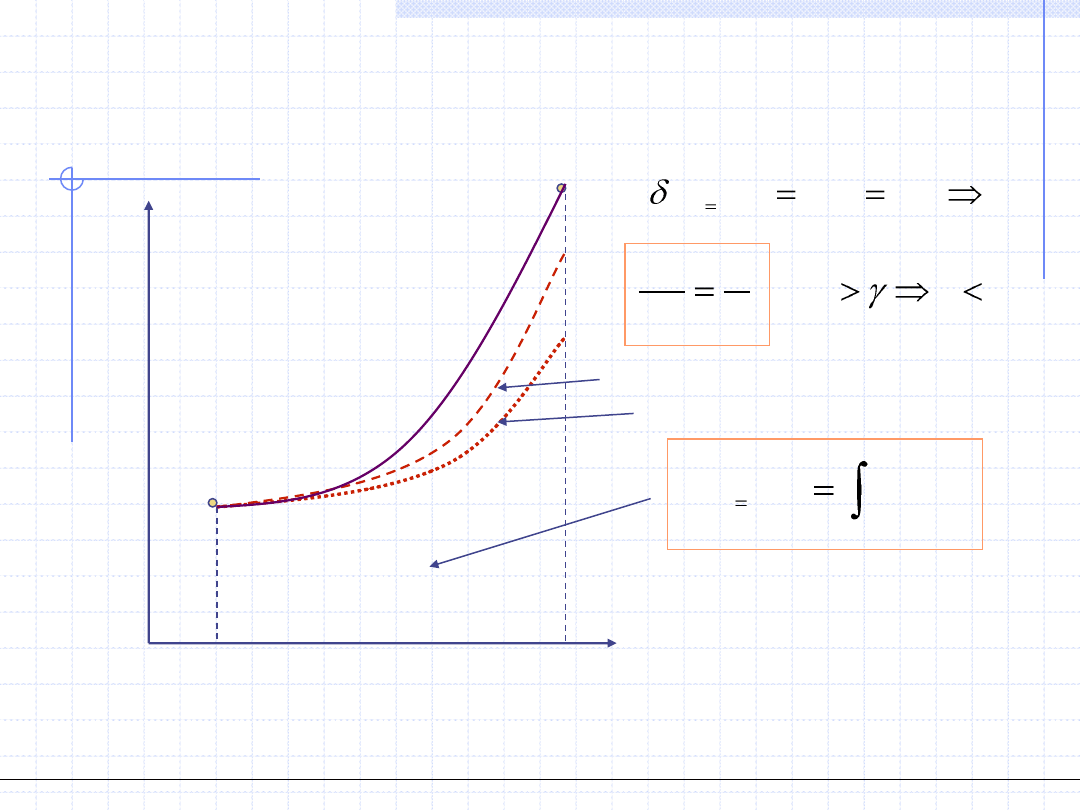
Ogólnotechniczne podstawy biotechnologii z grafiką inżynierską, Wydział Chemiczny Politechniki Wrocławskiej, 2009/2010, prof. Antoni Kozioł
30
2
1
)
(
)
(
.
s
s
const
c
ds
s
T
q
T
s
1
2
s
1
s
2
Tds
cdT
q
const
c
.
)
(
v=const.
Przemiana politropowa
Wykres w układzie T - s
p=const.
v
c
c
m
c
T
ds
dT
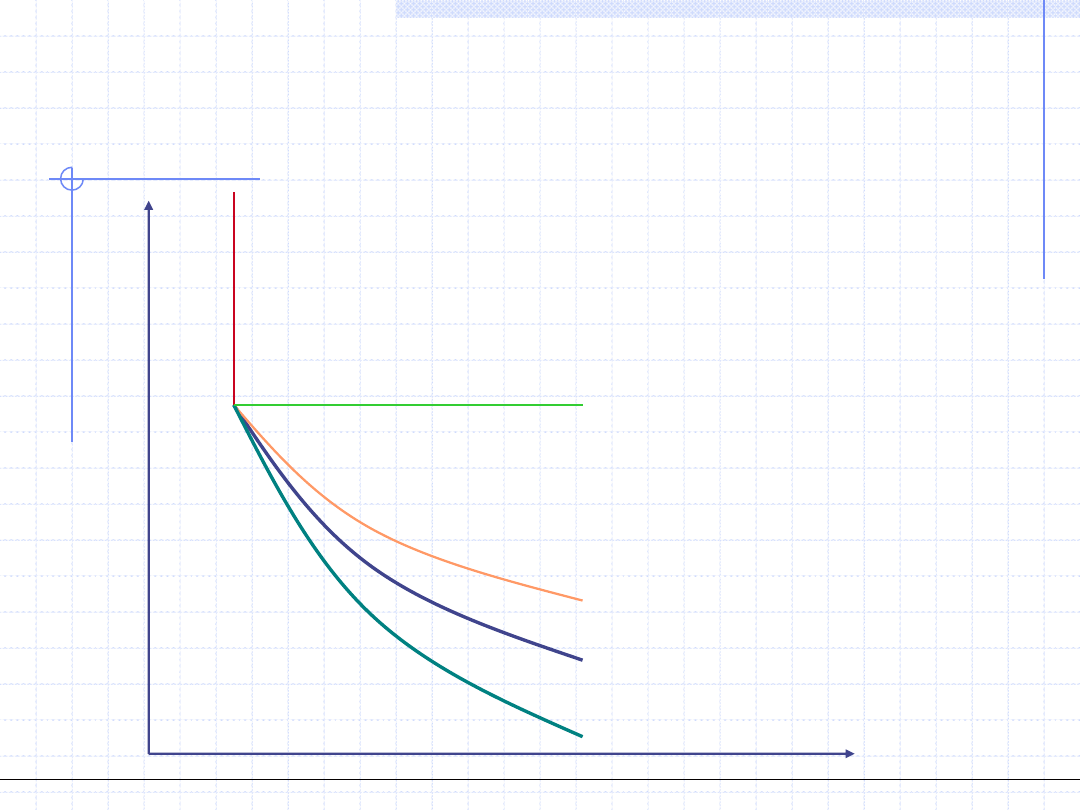
Ogólnotechniczne podstawy biotechnologii z grafiką inżynierską, Wydział Chemiczny Politechniki Wrocławskiej, 2009/2010, prof. Antoni Kozioł
31
p
Porównanie przemian na
wykresie p -v
v
v=const., izochora
p=const., izobara
T=const., izoterma
s=const., izentropa(adiabata)
c=const., politropa (m>γ)
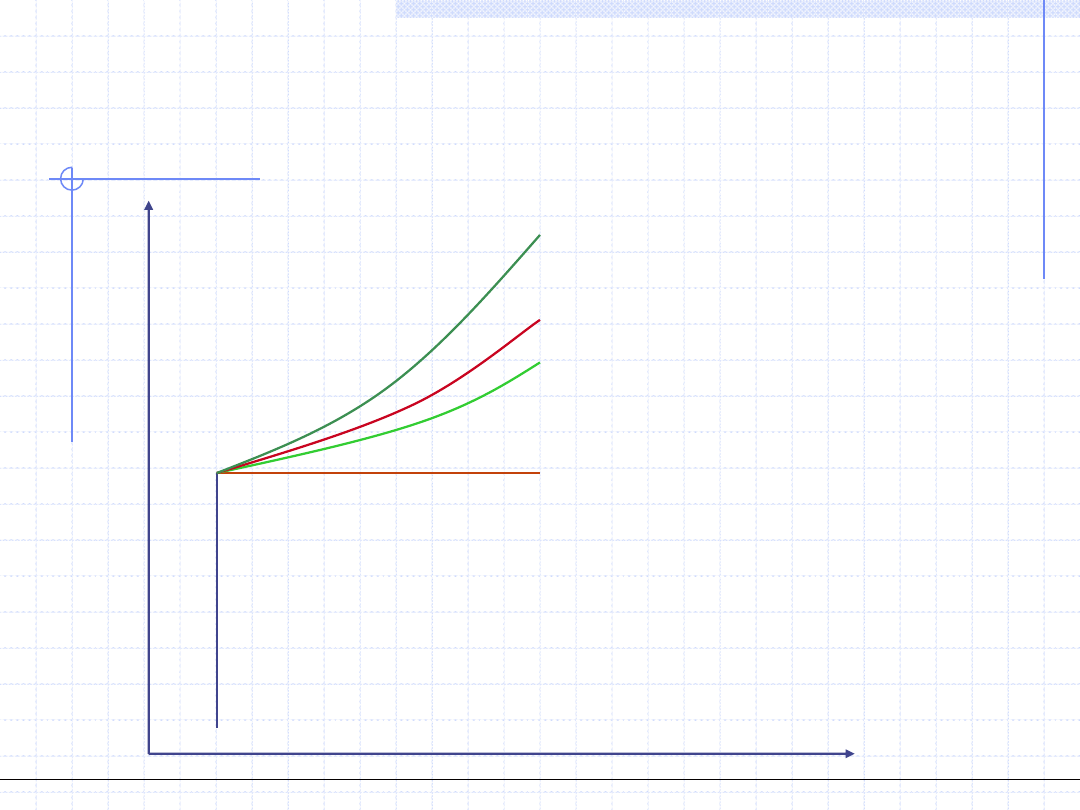
Ogólnotechniczne podstawy biotechnologii z grafiką inżynierską, Wydział Chemiczny Politechniki Wrocławskiej, 2009/2010, prof. Antoni Kozioł
32
T
Porównanie przemian na
wykresie T - s
s
v=const., izochora
p=const., izobara
T=const., izoterma
s=const., izentropa(adiabata)
c=const., politropa (m>γ)
Ogólnotechniczne podstawy biotechnologii z grafiką inżynierską, Wydział Chemiczny Politechniki Wrocławskiej, 2009/2010, prof. Antoni Kozioł
33
4
3
2
1
5
33
Obiegi termodynamiczne
Definicja i ilustracja
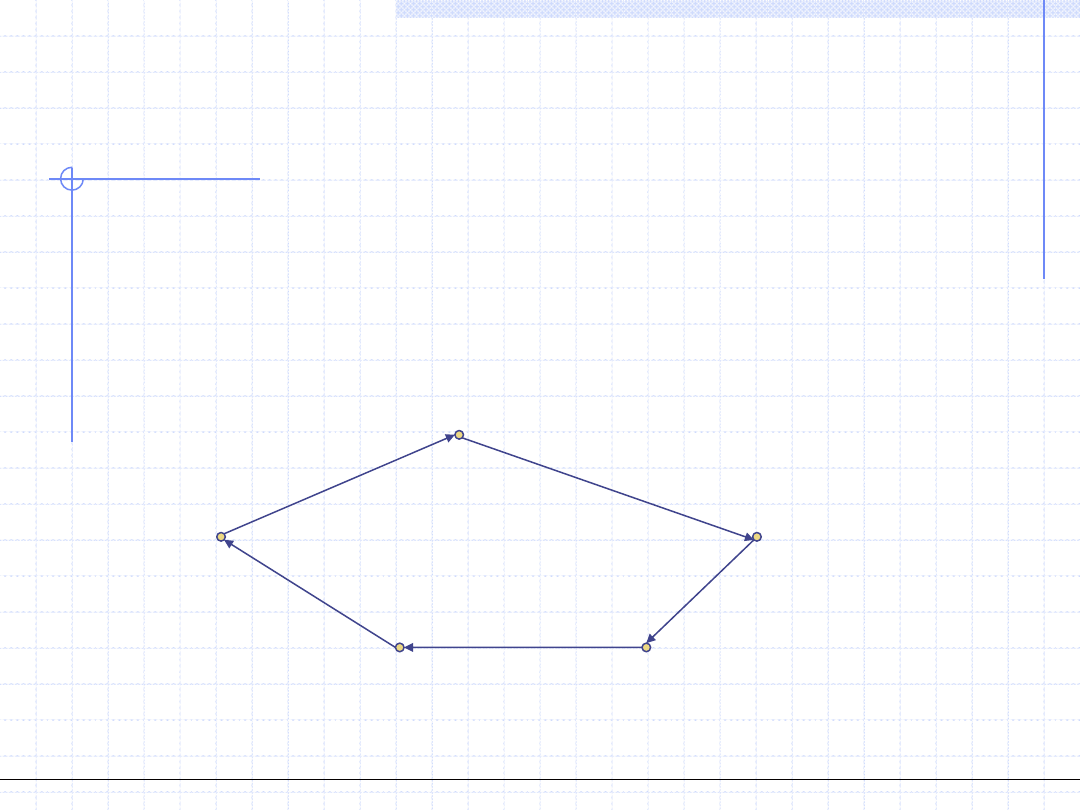
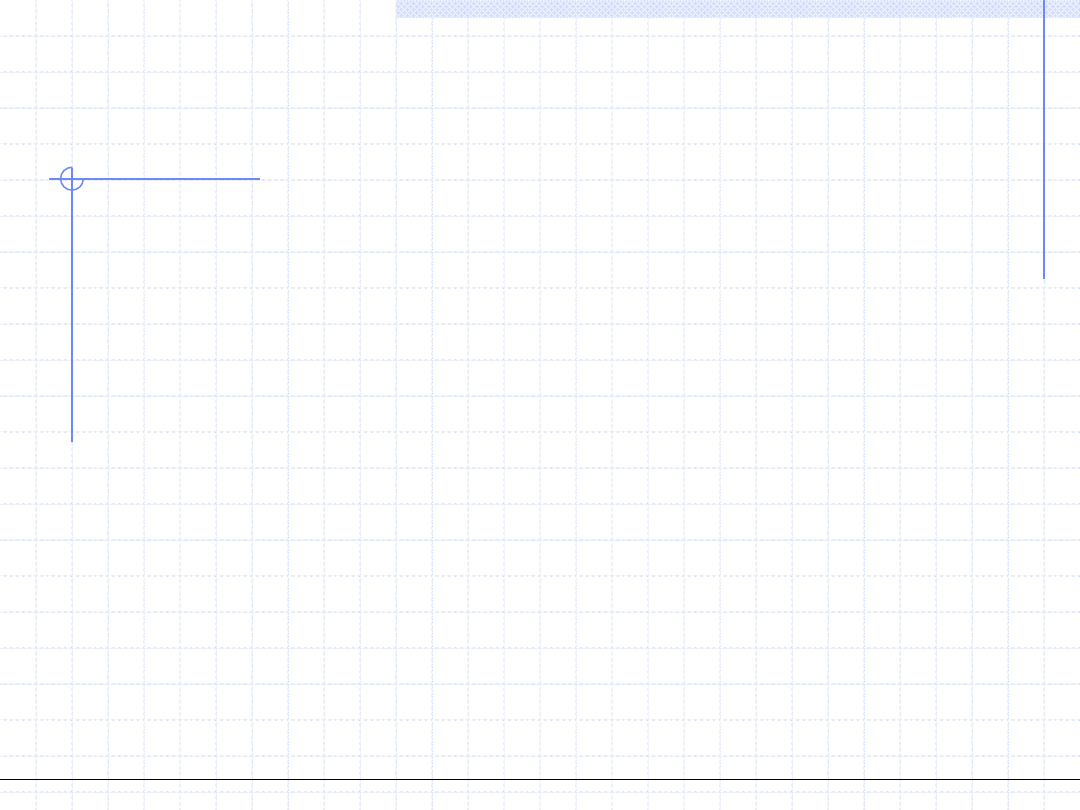
Obiegiem (cyklem) termodynamicznym nazywamy szereg następujących
po sobie przemian, w wyniku których układ wraca do stanu wyjściowego.
Pojęcie obiegu (cyklu) termodynamicznego jest bardzo ważne dla zrozumienia
istoty działania zarówno silników cieplnych jak i urządzeń chłodniczych.
Ogólnotechniczne podstawy biotechnologii z grafiką inżynierską, Wydział Chemiczny Politechniki Wrocławskiej, 2009/2010, prof. Antoni Kozioł
34
Ilustracja cyklu
termodynamicznego
Ogólnotechniczne podstawy biotechnologii z grafiką inżynierską, Wydział Chemiczny Politechniki Wrocławskiej, 2009/2010, prof. Antoni Kozioł
35
35
Obiegi termodynamiczne
Uwagi ogólne
Jeżeli wszystkie przemiany są odwracalne to również obieg nazywamy
odwracalnym. Jeżeli chociaż jedna z przemian cyklu jest nieodwracalna to
cały obieg również jest nieodwracalny.
Czynnikiem podlegającym przemianom może być gaz doskonały lub
substancje rzeczywiste. W praktyce bardzo ważne są obiegi, w których
czynnikiem jest woda i para wodna.
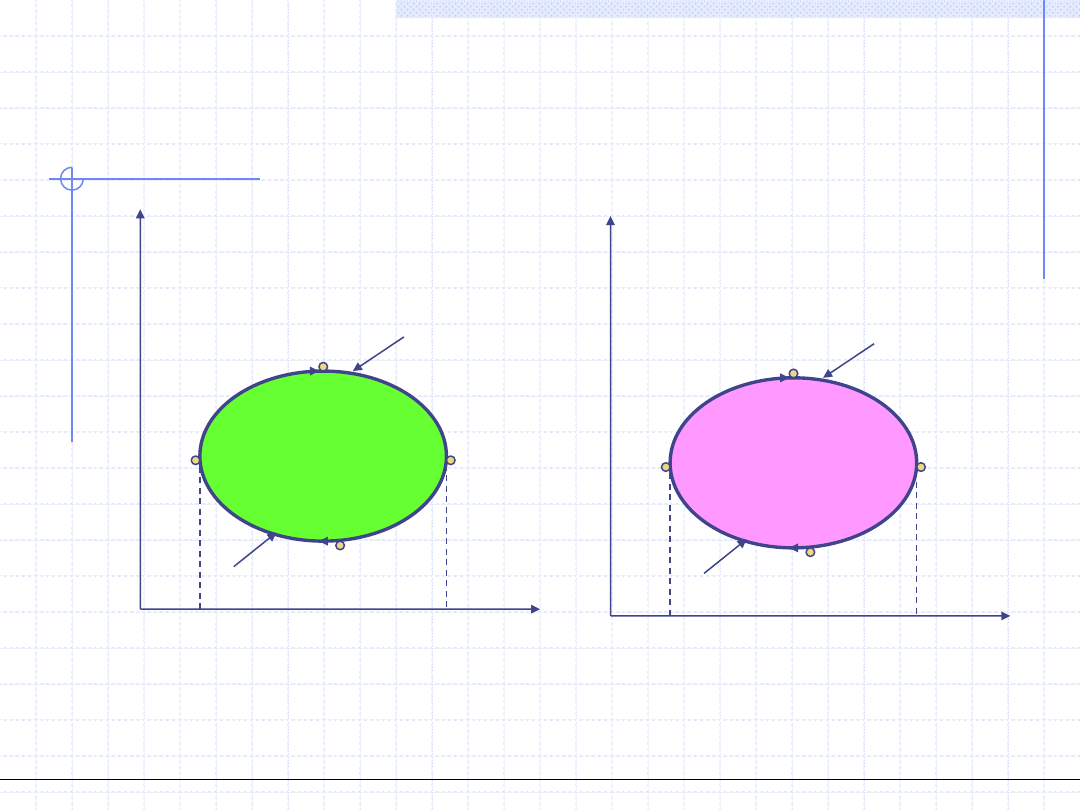
Graficznie obiegi przedstawia się najczęściej w układach p – v i T – s.
Bardzo ważną cechą obiegów jest kierunek przemian zachodzących
w układzie. W zależności od tego kierunku odróżnia się obiegi prawobieżne,
w których kierunek przemian na wykresach p – v i T – s jest zgodny z ruchem
wskazówek zegara i obiegi lewobieżne, w których kierunek przemian
jest przeciwny do ruchu wskazówek zegara.
Ogólnotechniczne podstawy biotechnologii z grafiką inżynierską, Wydział Chemiczny Politechniki Wrocławskiej, 2009/2010, prof. Antoni Kozioł
36
36
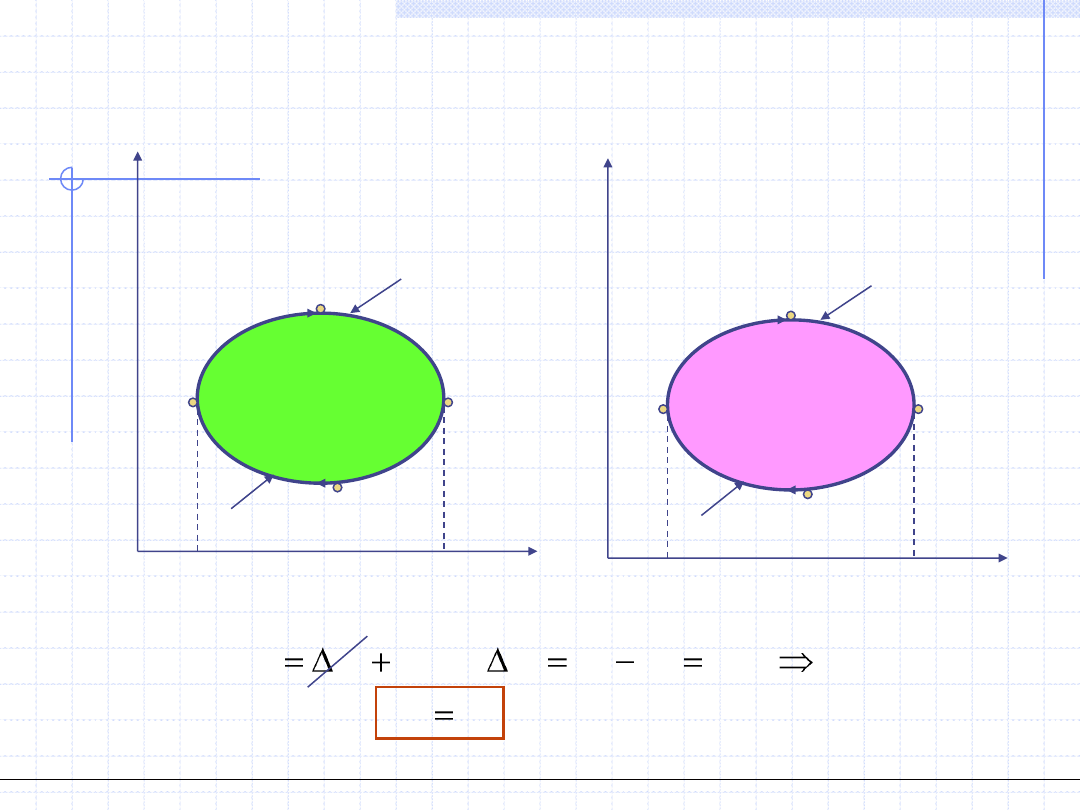
Obiegi prawobieżne - silnikowe
w
o
p
v
A
B
C
D
E
F
p
g
p
d
q
o
T
s
A’
B’
C’
D’
E’
F’
T
g
T
d
w
o
=w
g
+w
d
=Pole(ABCEFA)-Pole(CDAFEC)=Pole(ABCDA)
q
o
=q
g
+q
d
=Pole(A’B’C’E’F’A’)-Pole(C’D’A’F’E’C’)=Pole(A’B’C’D’A’)
Ogólnotechniczne podstawy biotechnologii z grafiką inżynierską, Wydział Chemiczny Politechniki Wrocławskiej, 2009/2010, prof. Antoni Kozioł
37
37
Obiegi prawobieżne – silnikowe cd.
w
o
p
v
A
B
C
D
E
F
p
g
p
d
q
o
T
s
A’
B’
C’
D’
E’
F’
T
g
T
d
Na mocy I zasady termodynamiki możemy napisać dla dowolnego obiegu:
o
o
A
A
o
o
o
o
q
w
u
u
u
w
u
q
0
Ogólnotechniczne podstawy biotechnologii z grafiką inżynierską, Wydział Chemiczny Politechniki Wrocławskiej, 2009/2010, prof. Antoni Kozioł
38
38
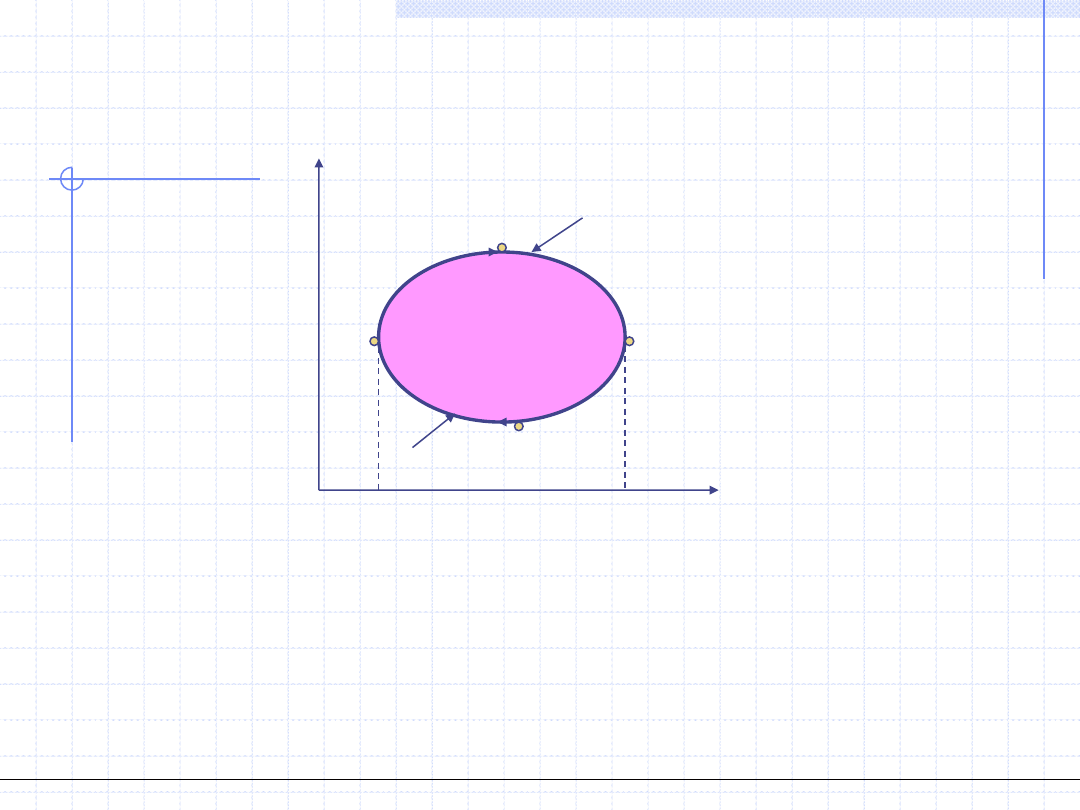
Obiegi prawobieżne – silnikowe
Sprawność obiegu silnikowego
w
o
=q
o
T
s
A’
B’
C’
D’
E’
F’
T
g
T
d
Celem obiegu silnikowego jest ciągłe przetwarzanie energii cieplnej (ciepła)
w energię mechaniczną (pracę). Aby ten cel zrealizować konieczne jest
dostarczenie do układu pewnej ilości ciepła – q
g
w temperaturze T
g
i odebranie
od układu części tego ciepła – q
d
w temperaturze T
d
.
Różnica tych wartości zostanie zamieniona na pracę w
o
. Ciepło q
g
jest równe
polu pod krzywą T
g
czyli polu figury A’B’C’E’F’A’. Ciepło q
d
ma znak ujemny
(jest odbierane z układu) a jego wartość jest polem pod krzywą T
d
czyli polem figury C’D’A’F’E’C’.
Ogólnotechniczne podstawy biotechnologii z grafiką inżynierską, Wydział Chemiczny Politechniki Wrocławskiej, 2009/2010, prof. Antoni Kozioł
39
39
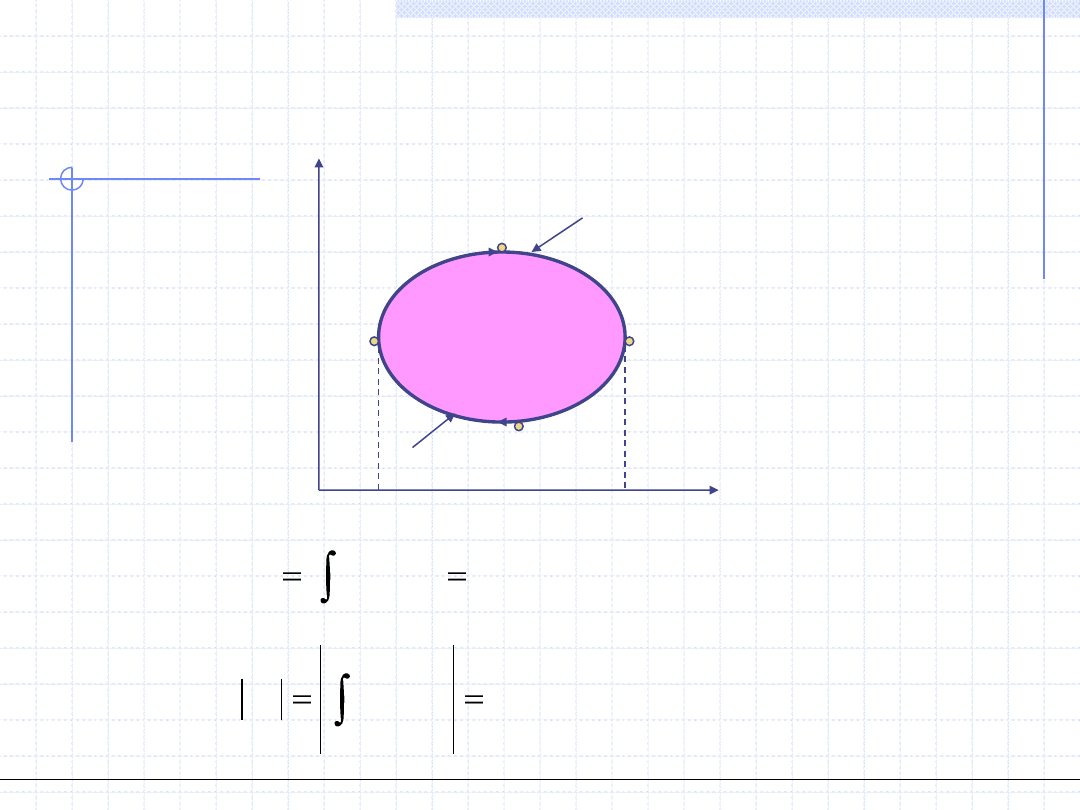
Obiegi prawobieżne – silnikowe
Sprawność obiegu silnikowego cd.
w
o
=q
o
T
s
A’
B’
C’
D’
E’
F’
T
g
T
d
)
'
'
'
'
'
'
(
)
(
)
'
'
'
'
'
'
(
)
(
'
'
'
'
A
F
E
C
D
A
Pole
ds
s
T
q
A
F
E
C
B
A
Pole
ds
s
T
q
C
A
C
A
s
s
d
d
s
s
g
g
Ogólnotechniczne podstawy biotechnologii z grafiką inżynierską, Wydział Chemiczny Politechniki Wrocławskiej, 2009/2010, prof. Antoni Kozioł
40
40
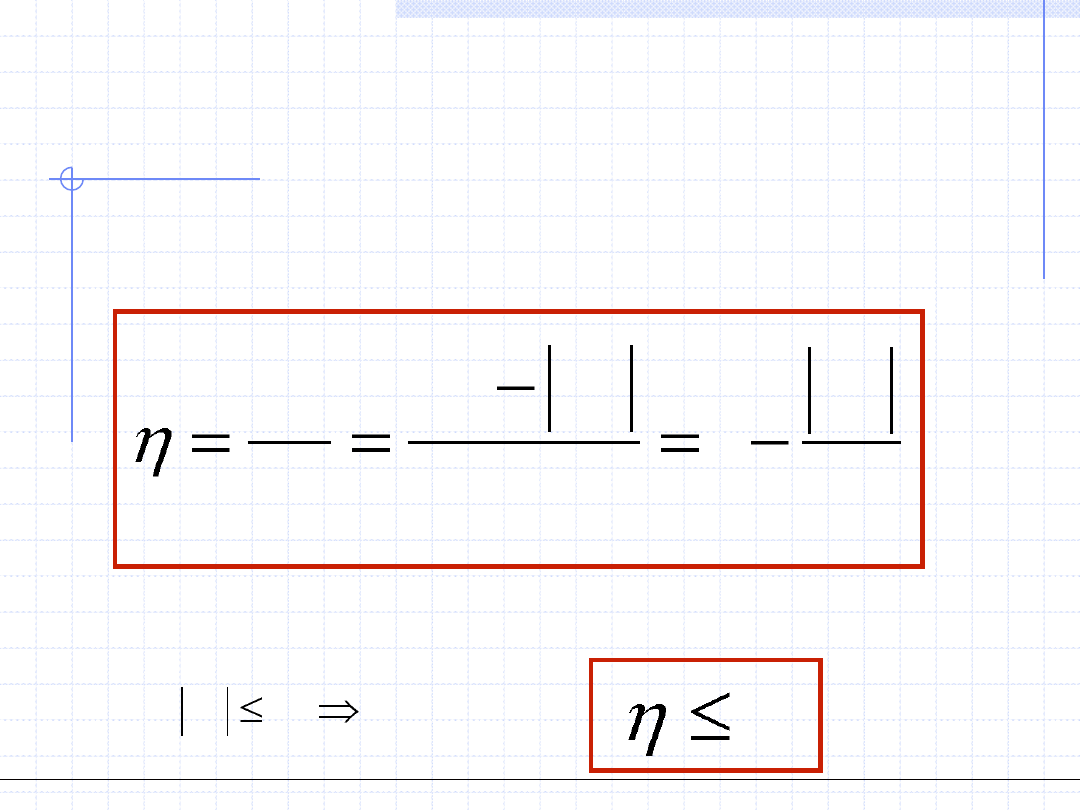
Obiegi prawobieżne – silnikowe
Sprawność obiegu silnikowego cd.
g
d
g
d
g
g
o
q
q
q
q
q
q
w
1
g
d
q
q
Stosunek otrzymanej w obiegu pracy do ciepła dostarczonego nazywamy
sprawnością obiegu silnikowego.
Z I zasady termodynamiki czyli z prawa zachowania energii wynika że:
1
Ogólnotechniczne podstawy biotechnologii z grafiką inżynierską, Wydział Chemiczny Politechniki Wrocławskiej, 2009/2010, prof. Antoni Kozioł
41
41
Obieg silnikowy a II zasada
termodynamiki
Działanie obiegu silnikowego jest ściśle związane z II zasadą termodynamiki.
Jedno z wielu sformułowań tej zasady jest następujące:
Ciągłe przetwarzanie ciepła na pracę jest możliwe tylko za pomocą
obiegu silnikowego, w którym układ pobiera ciepło w temperaturze
wyższej i oddaje ciepło w temperaturze niższej.
W związku z tym w każdym obiegu silnikowym można wyróżnić część otoczenia
z którego będzie pobierane ciepło w temperaturze T
g
. Część tą będziemy
nazywać źródłem górnym lub grzejnikiem. W innej części otoczenia
o temperaturze T
d
będzie się odbywało oddawanie przez układ części ciepła
otoczęniu. Ta część otoczenia jest nazywana źródłem dolnym lub chłodnicą.
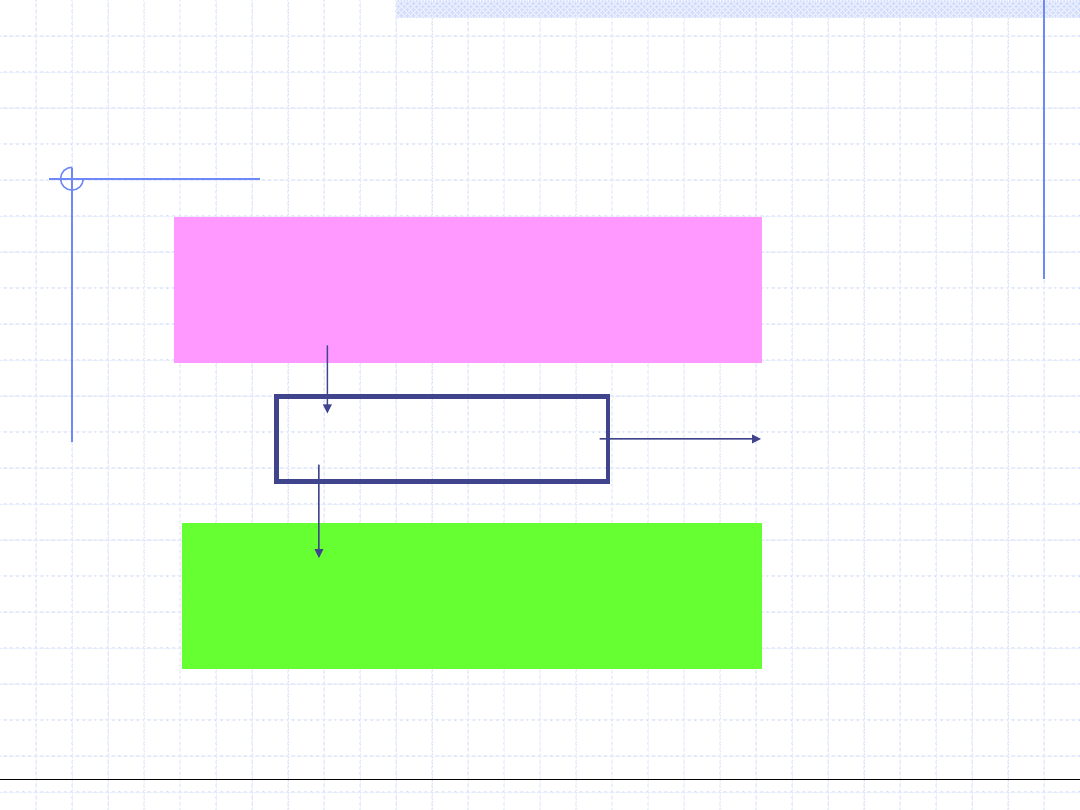
Ogólnotechniczne podstawy biotechnologii z grafiką inżynierską, Wydział Chemiczny Politechniki Wrocławskiej, 2009/2010, prof. Antoni Kozioł
42
42
Schemat obiegu silnikowego
Źródło górne (grzejnik)
T
g
T
d
Źródło dolne (chłodnica)
q
g
|q
d
|
w
o
=q
g
-|q
d
|
Silnik
Ogólnotechniczne podstawy biotechnologii z grafiką inżynierską, Wydział Chemiczny Politechniki Wrocławskiej, 2009/2010, prof. Antoni Kozioł
43
43
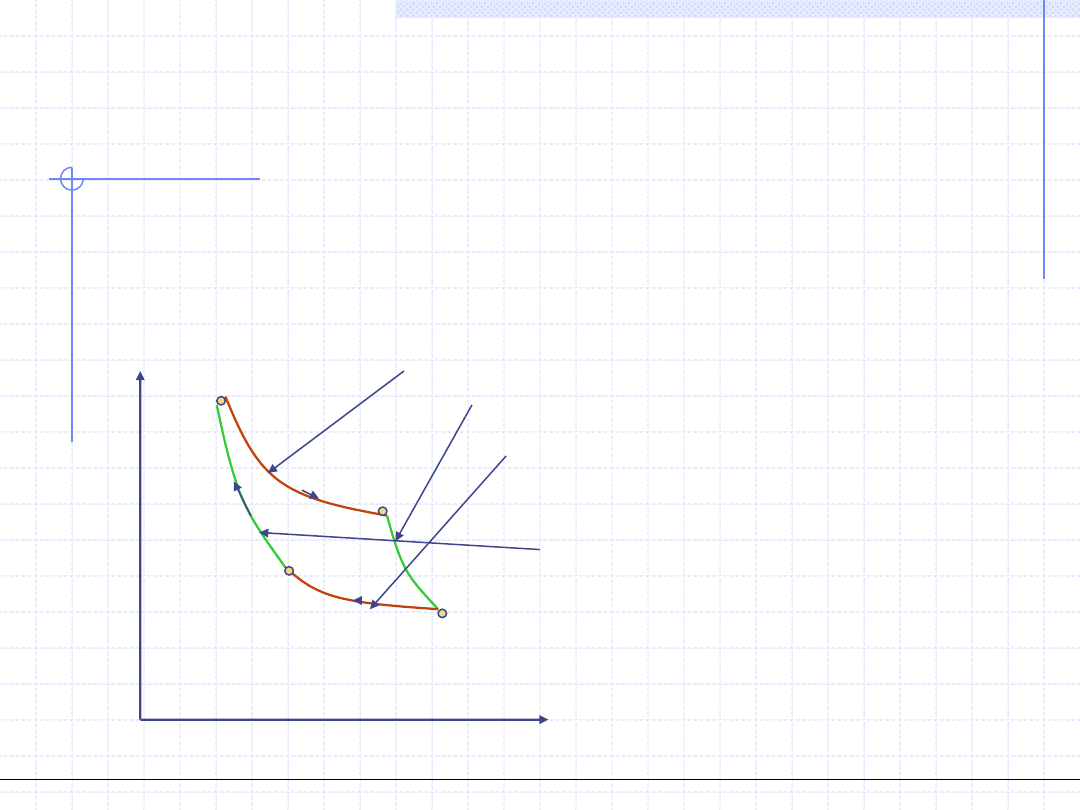
Obieg Carnota
Wzorcowym obiegiem silnikowym jest obieg rozważany przez francuskiego
uczonego Carnota na początku XIX wieku. Czynnikiem w obiegu Carnota jest
gaz doskonały. Na obieg składają się dwie przemiany izotermiczne i dwie
przemiany adiabatyczne. Na wykresie p – v obieg wykres obiegu Carnota
jest dosyć prosty:
p
v
1
2
3
T
g
=const., pv=const., q
g
>0
q=0, s=const., pv
γ
=
const.
T
d
=const., pv=const., q
d
<0
q=0, s=const., pv
γ
=const.
4
Ogólnotechniczne podstawy biotechnologii z grafiką inżynierską, Wydział Chemiczny Politechniki Wrocławskiej, 2009/2010, prof. Antoni Kozioł
44
|q
d
|
44
Obieg Carnota cd.
s
T
s
s
T
q
g
g
g
)
(
1
2
Wykres obiegu Carnota jest szczególnie prosty w układzie T - s:
T
s
w
o
=q
o
=q
g
-|q
d
|
1
2
3
4
T
g
=T
1
=T
2
T
d
=T
3
=T
4
s
1
=s
4
s
2
=s
3
g
d
T
T
1
s
T
s
s
T
q
d
d
d
)
(
3
4
g
d
g
d
g
d
T
T
s
T
s
T
q
q
1
1
1
Ogólnotechniczne podstawy biotechnologii z grafiką inżynierską, Wydział Chemiczny Politechniki Wrocławskiej, 2009/2010, prof. Antoni Kozioł
45
Rzeczywiste obiegi silnikowe
Obieg Carnota jest obiegiem idealnym w rzeczywistości trudno realizowalnym.
W szczególności trudne do przeprowadzenia są przemiany izotermiczne.
Rzeczywiste realizacje silników są modelowane za pomocą szeregu różnych
obiegów, z których najważniejsze są obieg Otto i obieg Diesla.
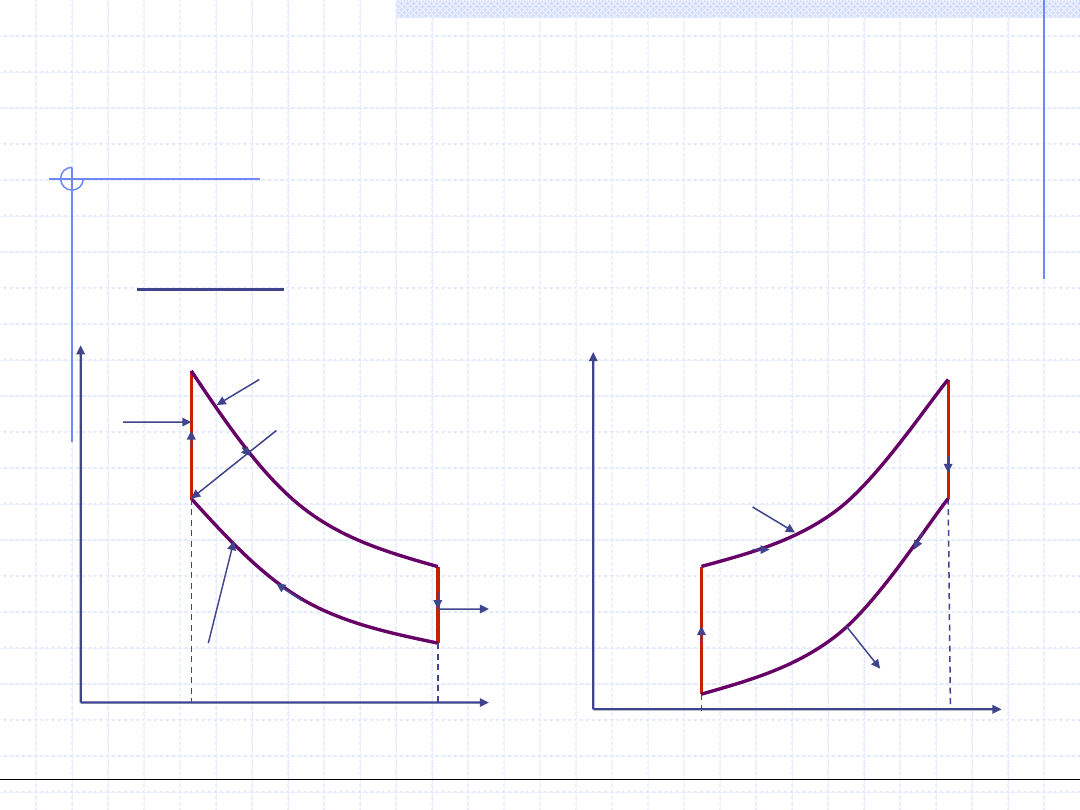
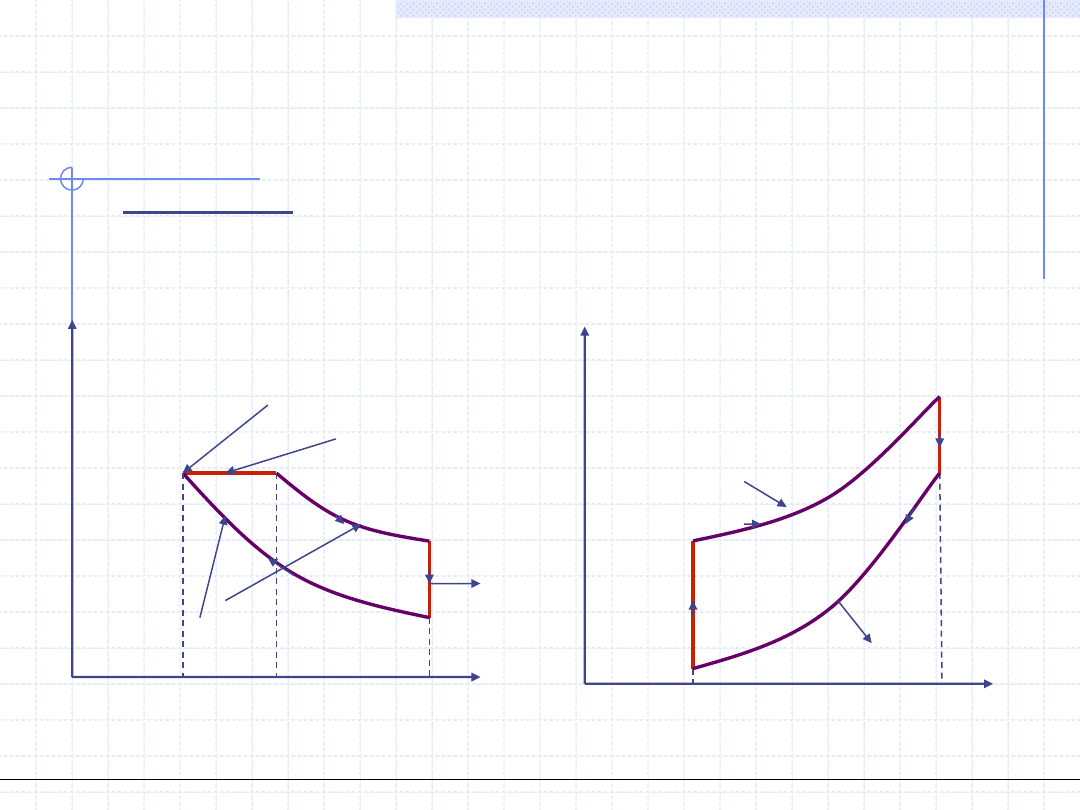
Obieg Otto jest to wzorcowy obieg silnika spalinowego z zapłonem iskrowym
(niskoprężnego) składający się z dwu izochor i dwu adiabat:
p
v
1
2
3
4
v
2
=v
3
v
1
=v
4
w
o
=q
o
q=0, pv
γ
=const.
q
g
q
d
q=0, pv
γ
=const.
zapłon paliwa
s
1
2
3
4
s
1
=s
2
s
3
=s
4
T
q
d
,v=const.
q
g
,v=const.
q
o
=w
o
Ogólnotechniczne podstawy biotechnologii z grafiką inżynierską, Wydział Chemiczny Politechniki Wrocławskiej, 2009/2010, prof. Antoni Kozioł
46
46
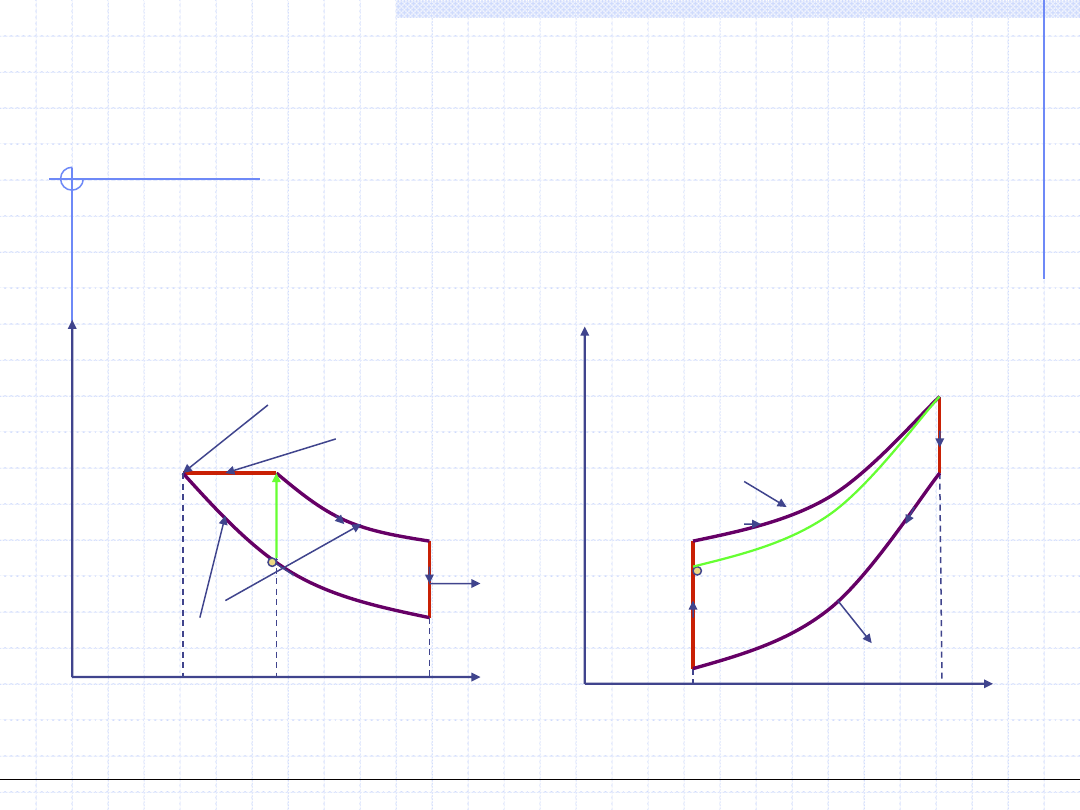
Obieg Diesla
Obieg Diesla jest to wzorcowy obieg silnika spalinowego z zapłonem
samoczynnym (wysokoprężnego) składający się z dwu adiabat, jednej izobary
oraz jednej izochory:
p
v
1
2
3
4
v
2
v
3
v
1
=v
4
w
o
=q
o
q
g
q
d
q=0, pv
γ
=const.
zapłon paliwa
s
1
2
3
4
s
1
=s
2
s
3
=s
4
T
q
d
,v=const.
q
g
,p=const.
q
o
=w
o
Ogólnotechniczne podstawy biotechnologii z grafiką inżynierską, Wydział Chemiczny Politechniki Wrocławskiej, 2009/2010, prof. Antoni Kozioł
47
47
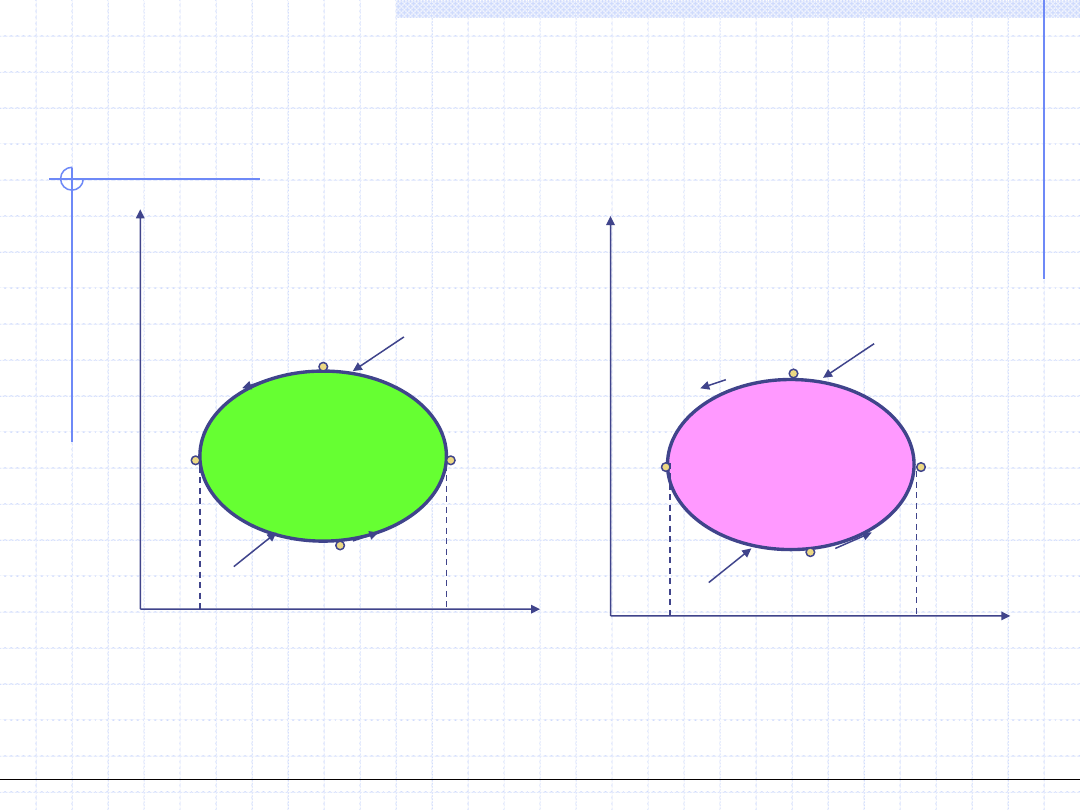
Obieg Diesla
Porównajmy obieg Diesla z obiegiem Otto:
p
v
1
2
3
4
v
2
v
3
v
1
=v
4
w
o
=q
o
q
g
q
d
q=0, pv
γ
=const.
zapłon paliwa
s
1
2
3
4
s
1
=s
2
s
3
=s
4
T
q
d
,v=const.
q
g
,p=const.
q
o
=w
o
2’
2’
Ogólnotechniczne podstawy biotechnologii z grafiką inżynierską, Wydział Chemiczny Politechniki Wrocławskiej, 2009/2010, prof. Antoni Kozioł
48
48
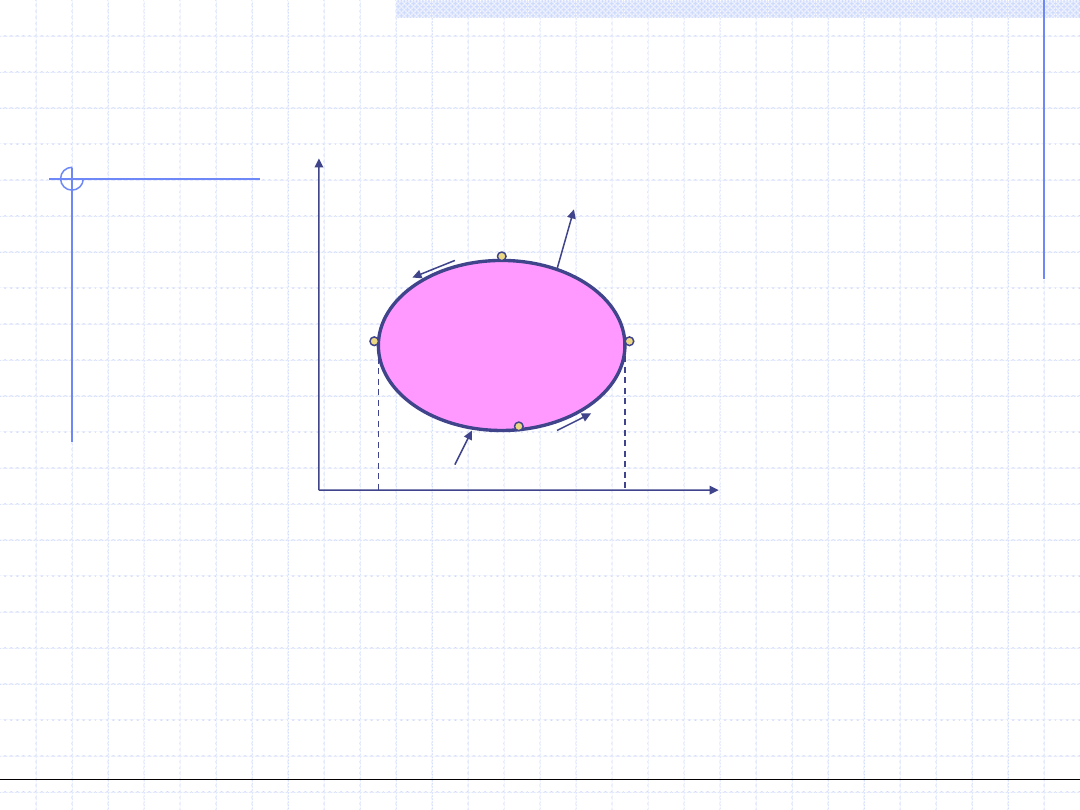
Obiegi lewobieżne - chłodnicze
-w
o
p
v
A
B
C
D
E
F
p
g
p
d
-q
o
T
s
A’
B’
C’
D’
E’
F’
T
g
T
d
-w
o
=-w
g
-w
d
=Pole(ABCEFA)-Pole(CDAFEC)=Pole(ABCDA)
-q
o
=-q
g
-q
d
=Pole(A’B’C’E’F’A’)-Pole(C’D’A’F’E’C’)=Pole(A’B’C’D’A’)
Obiegi, w których kierunek przemian jest przeciwny do ruchu wskazówek
zegara nazywamy lewobieżnymi lub chłodniczymi.
Wykresy takich obiegów są analogiczne jak silnikowych, z tym że kierunki
wszystkich przemian są odwrotne a znaki ciepła i pracy przeciwne.
Ogólnotechniczne podstawy biotechnologii z grafiką inżynierską, Wydział Chemiczny Politechniki Wrocławskiej, 2009/2010, prof. Antoni Kozioł
49
49
Obiegi lewobieżne – chłodnicze cd.
-w
o
=-q
o
T
s
T
g
T
d
q
g
<0
q
d
>0
W wyniku działania obiegu chłodniczego następuje transport ciepła ze
źródła dolnego do źródła górnego. Aby ten transport był możliwy na układzie
należy wykonać pracę –w
o
, której wartość bezwzględna jest określona polem
figury opisującej obieg. Schematycznie obieg chłodniczy można zilustrować
podobnie jak obieg silnikowy:
Ogólnotechniczne podstawy biotechnologii z grafiką inżynierską, Wydział Chemiczny Politechniki Wrocławskiej, 2009/2010, prof. Antoni Kozioł
50
50
Schemat obiegu chłodniczego
Źródło górne (chłodnica)
T
g
T
d
Źródło dolne (zamrażalnik)
-q
g
q
d
-w
o
=-q
g
-q
d
Lodówka
Ogólnotechniczne podstawy biotechnologii z grafiką inżynierską, Wydział Chemiczny Politechniki Wrocławskiej, 2009/2010, prof. Antoni Kozioł
51
51
Obiegi chłodnicze - realizacje
o
d
w
q
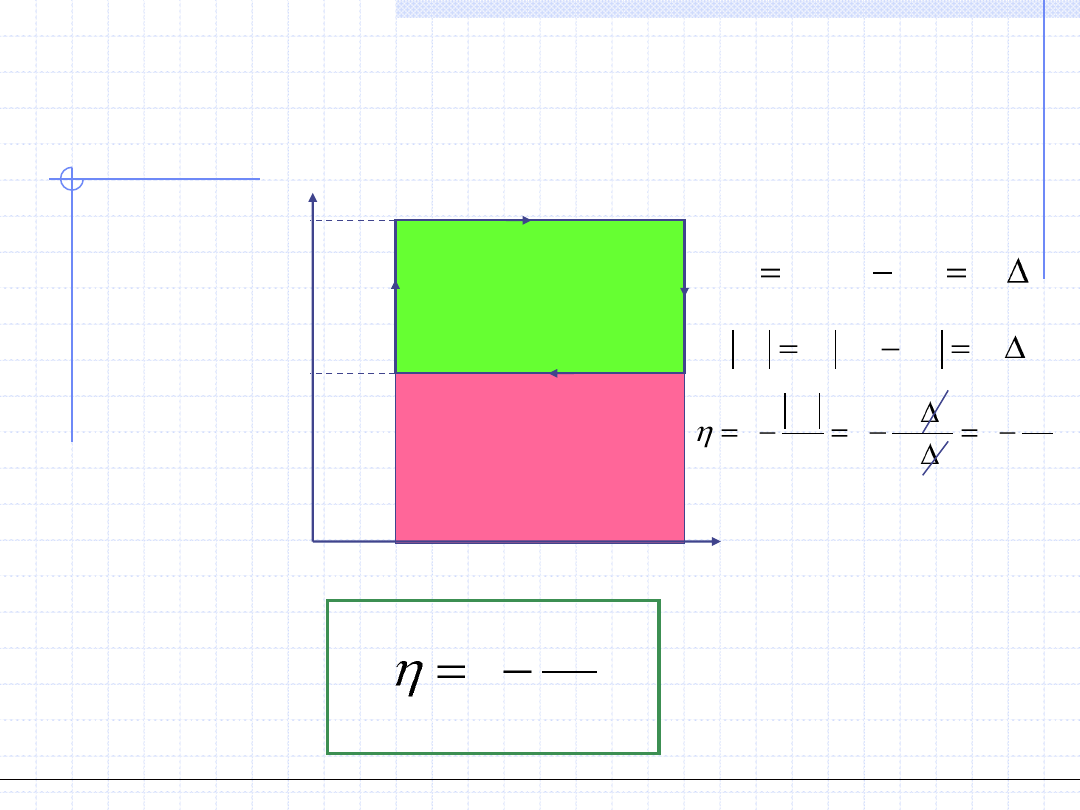
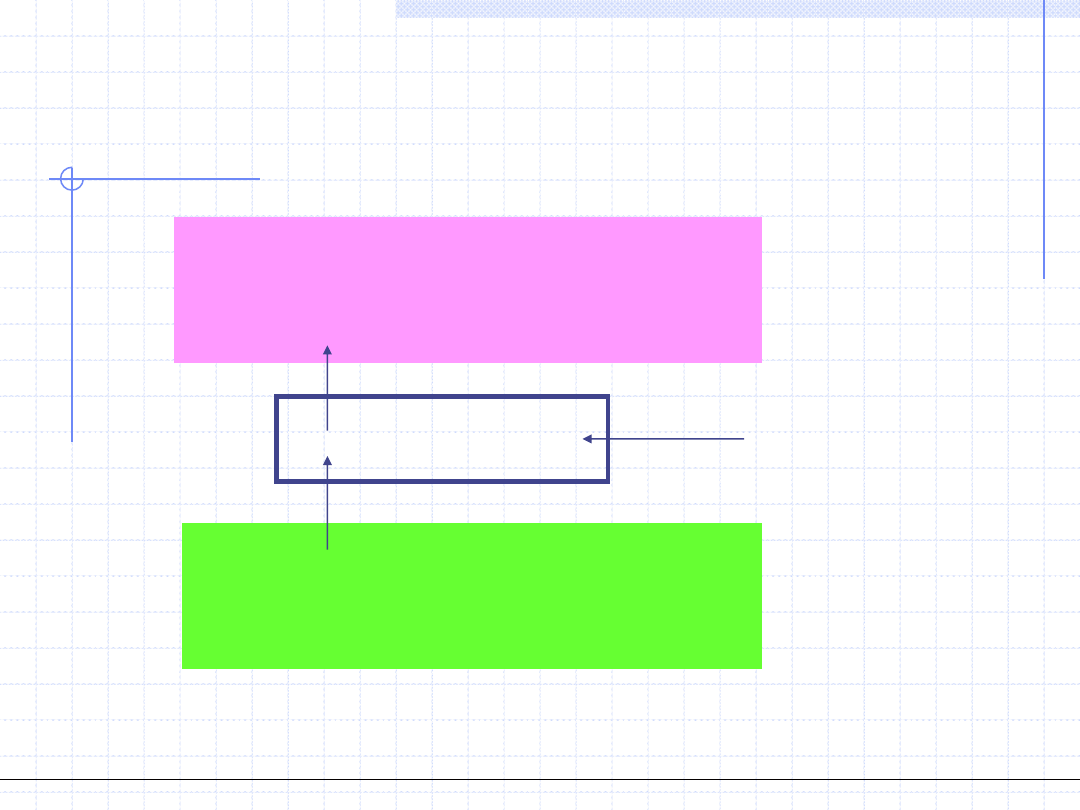
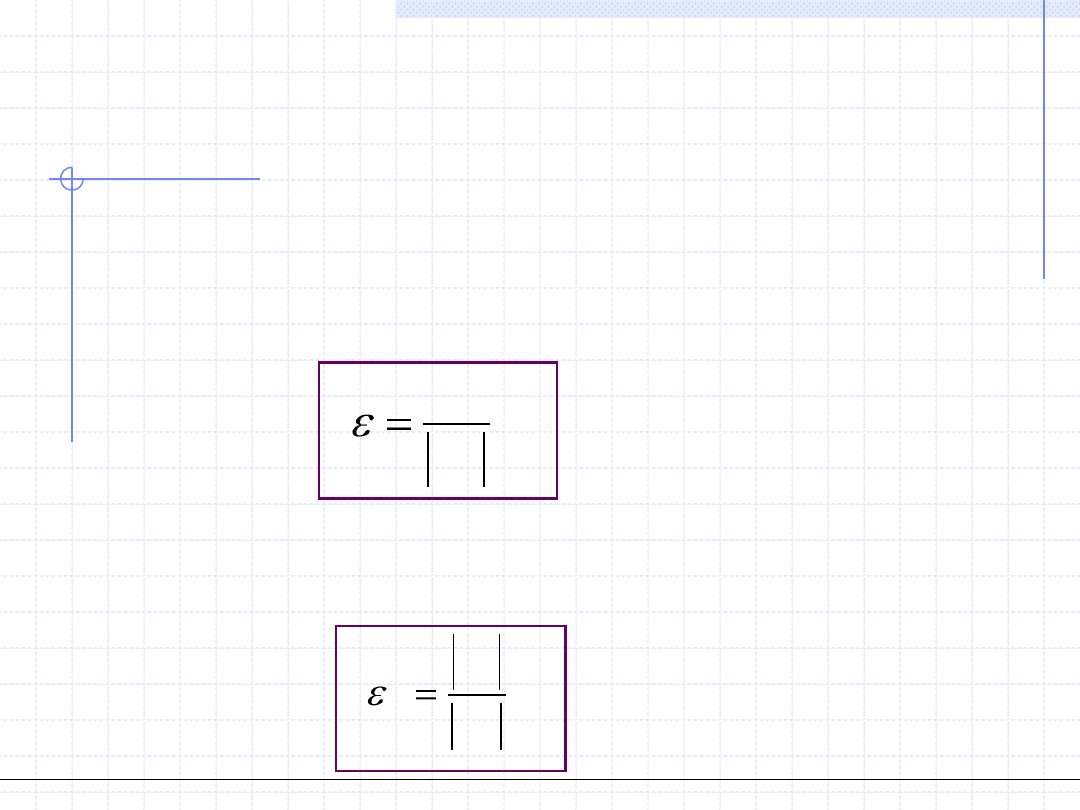
Obiegi lewobieżne mogą mieć dwa cele praktyczne:
1. Cel pierwszy to odebranie pewnej ilości ciepła ze źródła dolnego.
Urządzenie realizujące taki cel nazywamy chłodziarką lub lodówką.
Sprawność takiego urządzenia jest określona wzorem:
Sprawność chłodziarki może mniejsza
lub większa od jedności.
2. Cel drugi obiegu lewobieżnego to dostarczenie ciepła do źródła górnego
czyli jego ogrzanie. Urządzenie o taki celu nazywamy pompą cieplną.
Sprawność pompy cieplnej określamy wzorem:
o
g
p
w
q
Można zauważyć, że sprawność pompy
cieplnej jest zawsze liczbą większą od 1.
Ogólnotechniczne podstawy biotechnologii z grafiką inżynierską, Wydział Chemiczny Politechniki Wrocławskiej, 2009/2010, prof. Antoni Kozioł
52
Na tym kończymy wykłady
z „Ogólnotechnicznych podstaw biotechnologii
z grafiką inżynierską”
Dziękuję bardzo Państwu za uwagę
i życzę powodzenia w zaliczeniu,
które odbędzie się:
15.01.2010 – termin podstawowy
- godz. 11.15 nieparzyste numery albumu
- godz. 12.15 parzyste numery albumu
22.01.2010 – termin poprawkowy
Wyszukiwarka
Podobne podstrony:
Ogolnotech(dla Bio Ir) WYKLAD X
Ogolnotech(dla Bio Ir) WYKLAD XI
Ogolnotech dla Bio IV WYKLAD VII
Ogolnotech(dla Bio I) WYKLAD IX
Ogolnotech dla Bio I WYKLAD IV
Ogolnotech dla Bio WYKLAD VI
Ogolnotech(dla Bio I) WYKLAD I
Ogolnotech(dla Bio I) WYKLAD V
Ogolnotech dla Bio I WYKLAD III
Ogolnotech dla Bio I WYKLAD IV
Ogolnotech(dla Bio I) W VI
Ogolnotech(dla Bio I) W X
Ogolnotech(dla Bio I) W VI
więcej podobnych podstron