1
OGÓLNOTECHNICZNE
PODSTAWY BIOINŻYNIERII
Wykład VI
Podstawy techniki cieplnej i
termodynamiki procesowej

2
Uwagi wstępne
W drugiej części wykładu będziemy zajmować się podstawami
techniki cieplnej oraz termodynamiki procesowej.
Technika cieplna jest to nauka stosowana blisko związana
z termodynamiką i zajmująca się praktycznymi zagadnieniami
związanymi z przemianami energii cieplnej czyli ciepła i energii
mechanicznej czyli pracy.
Termodynamika procesowa jest to też nauka stosowana
będąca częścią termodynamiki ogólnej ale zajmująca się
metodami służącymi do wyznaczania właściwości termodynamicznych
substancji czystych i roztworów.
Ponieważ w obydwie dziedziny są bardzo blisko związane z termodynamiką,
na wstępie przedstawię Państwu podstawowe definicje i pojęcia
termodynamiczne.

3
Literatura
1.
S. Michałowski, K. Wańkowicz: Termodynamika
procesowa. WNT Warszawa 1999.
2.
J. Szarawara: Termodynamika chemiczna
stosowana. WNT, Warszawa 1997.
3.
J.M. Smith, H.C. Van Ness, M.M. Abbott:
Introduction to Chemical Engineering
Thermodynamics. Mc Graw Hill. Boston 2001.
44
Podstawowe pojęcia i definicje
termodynamiki procesowej
Układ
Otoczenie
Masa
Praca (energia mechaniczna)
Ciepło (energia cieplna)
Podstawowymi pojęciami termodynamicznymi są pojęcia układu
i otoczenia.
Układ i otoczenie mogą wymieniać
ze sobą energię i masę.
Energia może być wymieniana na dwa
sposoby:
- jako ciepło, gdy wiąże się to
z przekazywaniem termicznym, lub
- jako praca gdy energia jest
przekazywana mechanicznie w sposób
uporządkowany
55

66
RELACJE UKŁADU Z
OTOCZENIEM
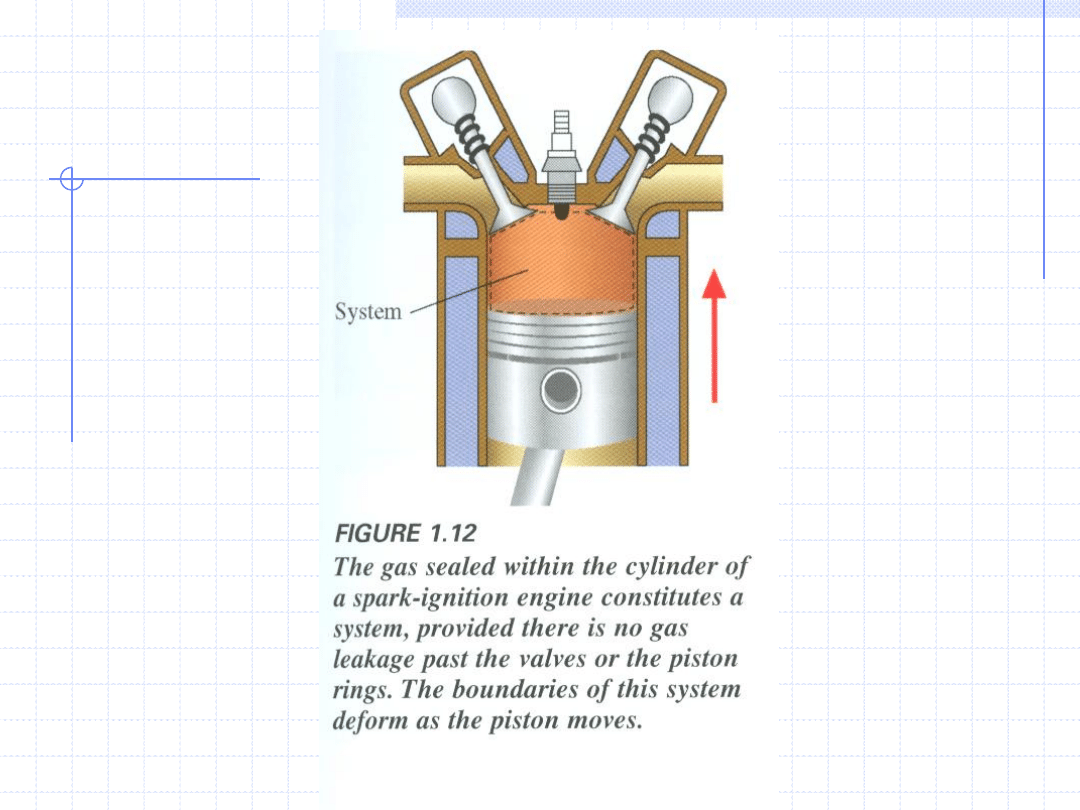
W zależności od istnienia lub braku wymiany z otoczeniem układ określa się jako:
•adiabatyczny – gdy nie ma wymiany ciepła
•w kontakcie termicznym – gdy wymiana ciepła jest obecna
•izolowany mechanicznie – gdy praca nie jest wykonywana
•w kontakcie mechanicznym – gdy praca jest wykonywana
•zamknięty – gdy nie ma wymiany masy
•otwarty – gdy wymiana masy się odbywa
Mówimy, że układ znajduje się w stanie równowagi termodynamicznej,
gdy jest on pozostawiony sobie przez odpowiednio długi czas.
77
STAN UKŁADU I PRZEMIANA
TERMODYNAMICZNA
Stan układu termodynamicznego opisuje szereg wielkości fizycznych
nazywanych parametrami lub funkcjami stanu.
Jeżeli układ zmienia swój stan, to mówimy że odbywa się przemiana
termodynamiczna
Stan 1
Stan 2
Przemiana
Przemianę termodynamiczną charakteryzują:
a) przyrosty parametrów stanu
b) wielkości opisujące wymianę między układem a otoczeniem
(parametry przemiany)
88
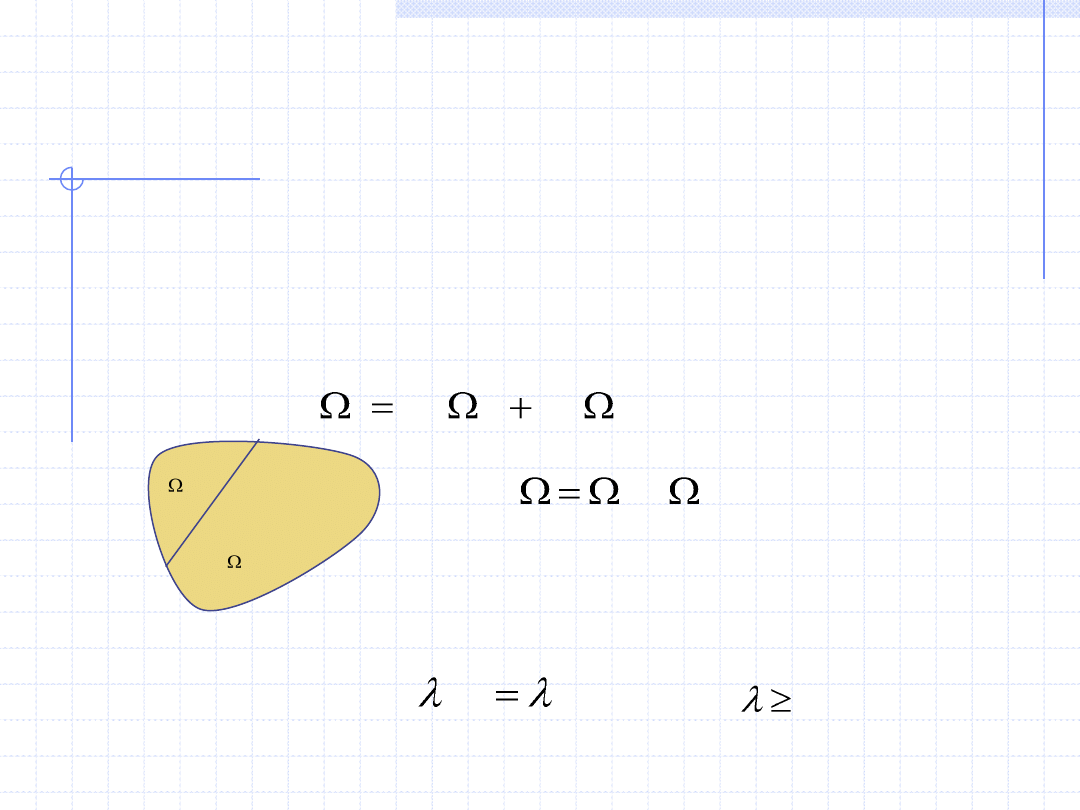
WIELKOŚCI EKSTENSYWNE I
INTENSYWNE
)
(
)
(
)
(
2
1
X
X
X
Wielkości termodynamiczne (zarówno parametry stanu jak i wielkości
opisujące przemiany) dzielą się na dwie ważne grupy:
• Wielkości ekstensywne – wielkości X spełniające następujące własności:
1 - są określone na zbiorach przestrzennych
2 - są addytywne (bilansowalne) tzn. spełniają relację
2
1
1
2
3 - są jednorodne ze względu na masę substancji zawartej w układzie
)
(
)
(
m
X
m
X
0
99
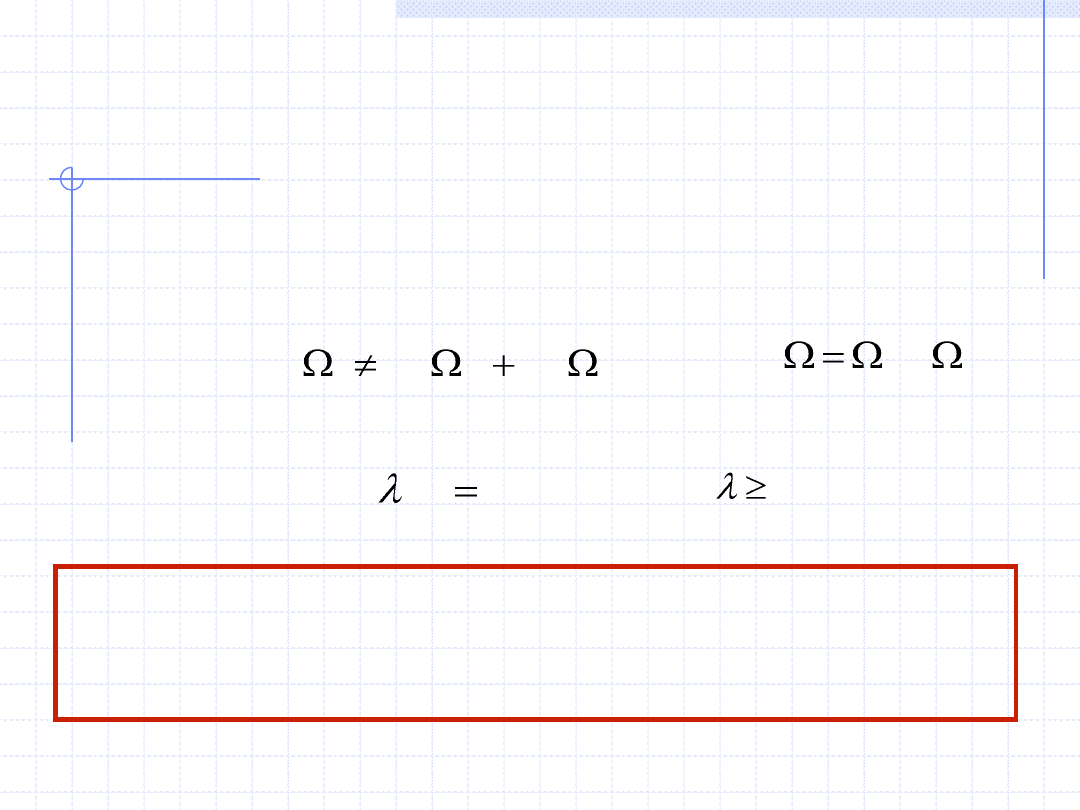
WIELKOŚCI EKSTENSYWNE I
INTENSYWNE
)
(
)
(
)
(
2
1
X
X
X
Wielkości intensywne – wielkości x spełniające następujące własności:
1 - są określone dla punktów przestrzennych (w przypadku zbiorów
przestrzennych oznaczają wartości średnie)
2 - nie są addytywne (bilansowalne) tzn.:
2
1
3 - nie zależą od masy substancji zawartej w układzie
)
(
)
(
m
X
m
X
0
Iloraz dwu wielkości ekstensywnych zawsze jest
wielkością intensywną !

10
10
WIELKOŚCI MIERZALNE I
KONCEPTUALNE
Inny podział wielkości termodynamiczny wiąże się z możliwością
ich eksperymentalnego pomiaru. Zgodnie z tym podziałem mamy
wielkości mierzalne i konceptualne.
Wielkości mierzalne to takie, które możemy bezpośrednio z odpo-
wiednią dokładnością zmierzyć za pomącą odpowiednich przyrządów
pomiarowych. Mierzalne są np. temperatura, ciśnienie i objętość.
Wielkości konceptualne to takie dla których określenia konieczna
jest pewna procedura zawierająca różne założenia i konwencje.
Konceptualne są takie wielkości jak energia wewnętrzna, entropia
czy fugatywność.

11
11
PARAMETRY STANU
1. Temperatura – T, [K] – parametr intensywny
Temperatura jest to podstawowy parametr stanu określający zdolność układu
do przekazywania ciepła czyli energii chaotycznego ruchu cząsteczek.
2. Ciśnienie – p, [Pa] – parametr intensywny
Ciśnienie jest to drugi podstawowy parametr stanu określający zdolność układu
do wykonywania pracy tzn. do przekazywania energii na sposób mechaniczny.
3. Objętość – V, [m
3
] – parametr ekstensywny
Objętość układu jest określona przez objętość przestrzeni zajmowanej przez układ.
4. Energia wewnętrzna – U, [J] – parametr ekstensywny
Energia wewnętrzna jest to całkowita energia zawarta w układzie pomniejszona
o jego energię kinetyczną związaną z ruchem i potencjalną związaną z położeniem.
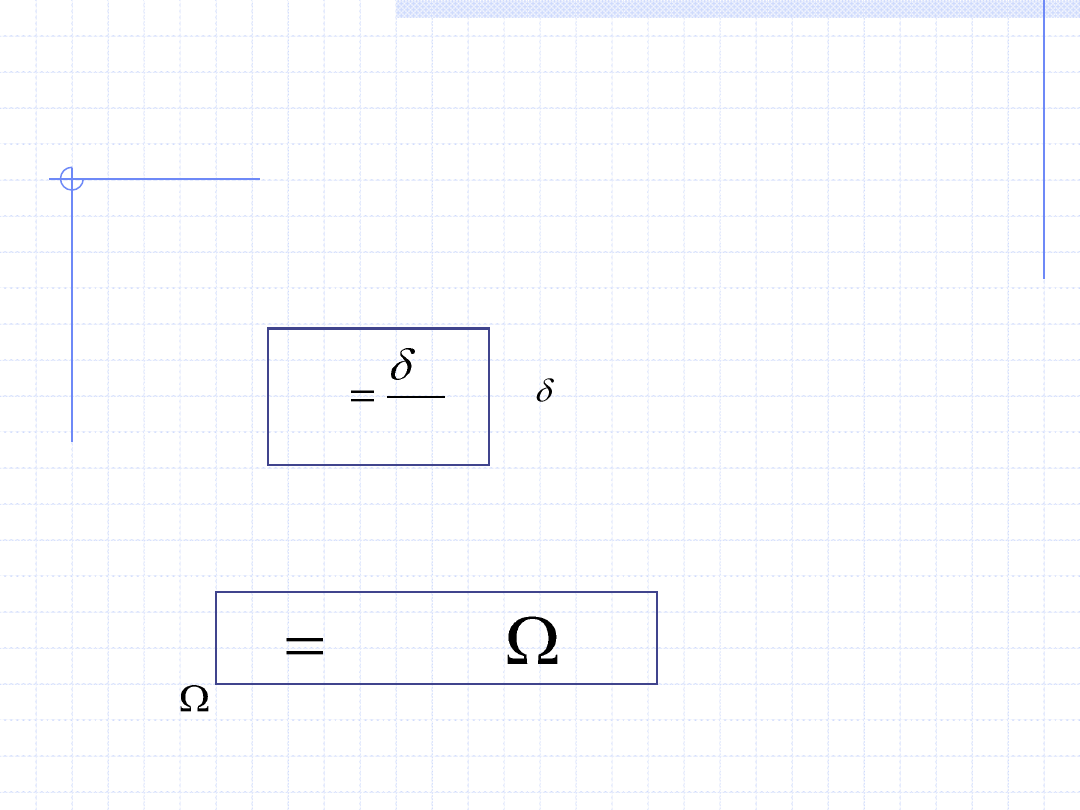
5. Entalpia – H, [J] – parametr ekstensywny
Entalpia jest pomocniczą wielkością energetyczną układu zaproponowaną przez
Gibbsa, której definicja jest następująca:
pV
U
H
12
12
PARAMETRY STANU cd.
T
Q
dS
6. Entropia – S, [J/K] – parametr ekstensywny
Entropia jest to fundamentalny parametr termodynamiczny wprowadzony przez
Clausiusa. Entropia ma dwie interpretacje. Klasyczna definicja Clausiusa
określa zmianę entropii w różniczkowej przemianie odwracalnej:
Druga definicja entropii zaproponowana przez Boltzmana wiąże się ze
statystycznym rozkładem poziomów energetycznych cząstek zawartych
w układzie. Popularnie, aczkolwiek nie całkiem ściśle, entropia jest określana
jako miara nieuporządkowania (chaosu) w układzie.
Q
- elementarne ciepło wymienione podczas
przemiany różniczkowej
)
ln(
E
nR
S
- liczba dostępnych mikrostanów na które może się rozkładać
energia wewnętrzna układu
E
13
13
PARAMETRY STANU cd.
TS
U
A
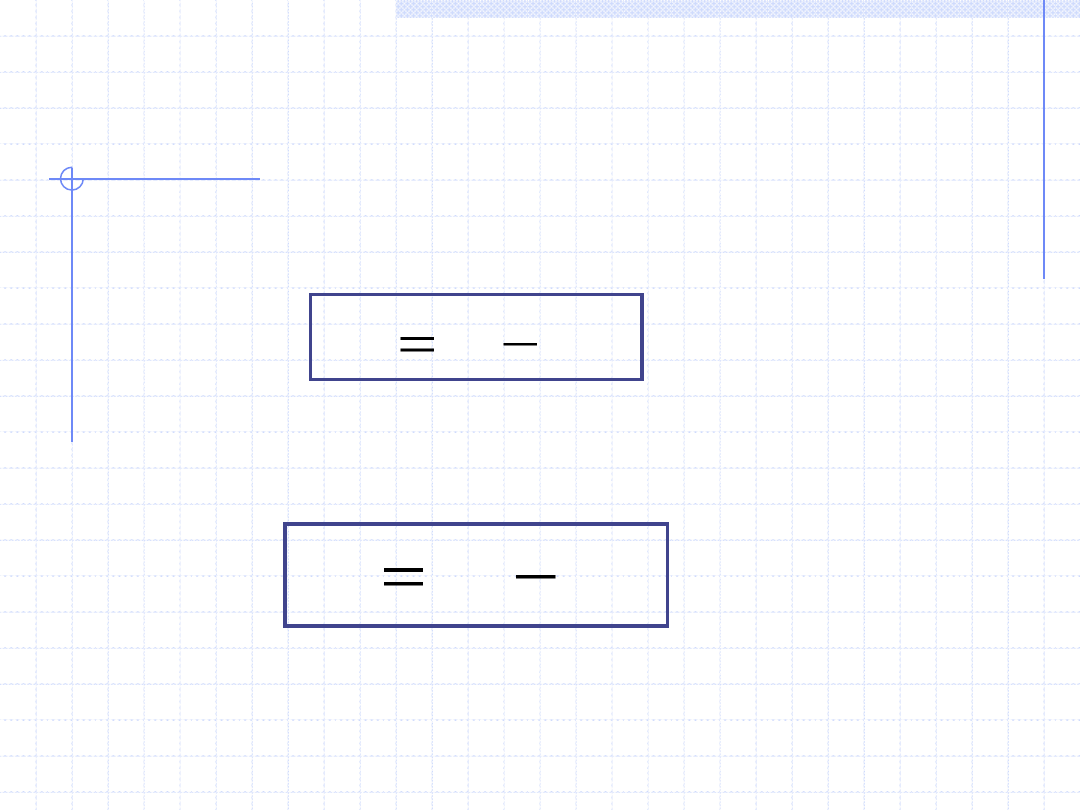
7. Energia swobodna – A, [J] – parametr ekstensywny
Energia swobodna, nazywana też energią Helmholza jest to pochodna wielkość
energetyczna określona wzorem:
8. Entalpia swobodna – G, [J] – parametr ekstensywny
Entalpia swobodna, nazywana też energią Gibbsa jest to pochodna wielkość
energetyczna określona wzorem:
TS
H
G

14
14
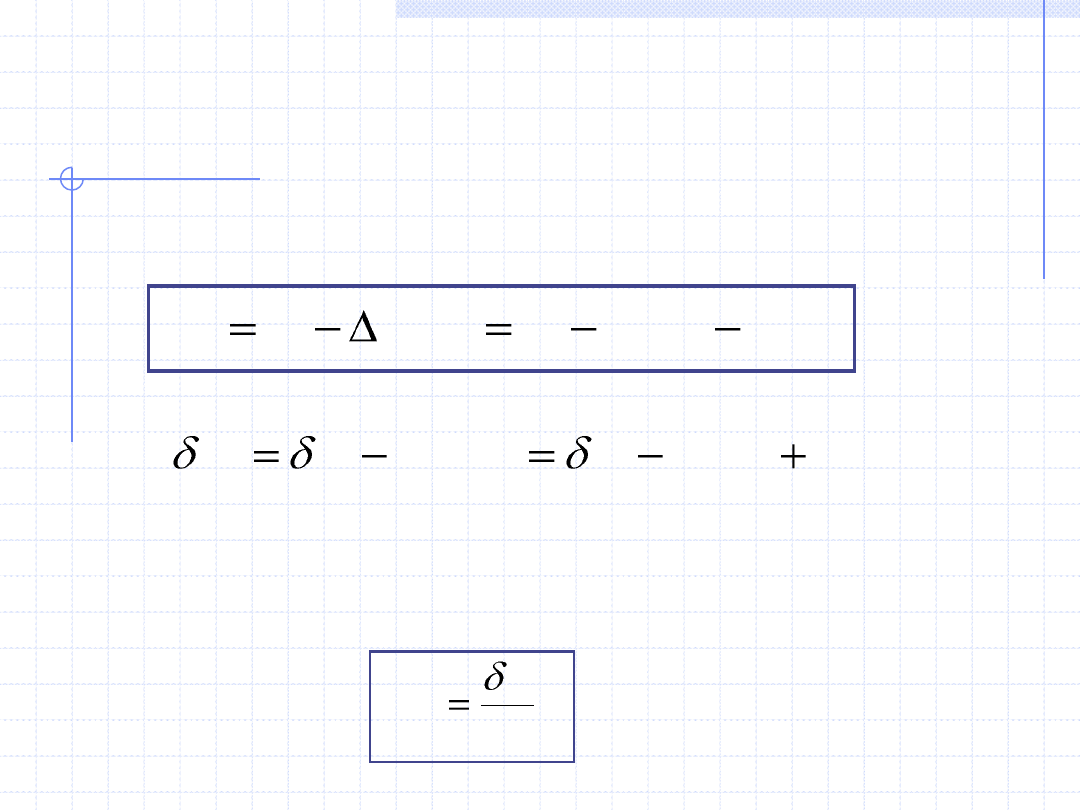
PARAMETRY PRZEMIANY
Przemianę termodynamiczną opisują:
1. Ciepło przemiany – Q, [J] – wielkość ekstensywna.
Ciepło przemiany jest to wymieniona między układem a otoczeniem ilość
energii chaotycznego (termicznego) ruchu cząstek. Dla przemiany różniczkowej
ilość tę oznaczamy przez δQ. Powszechnie przyjęta konwencja określa ciepło
dostarczone do układu jako dodatnie.
2. Praca przemiany – W, [J] – wielkość ekstensywna.
Praca przemiany jest to wymieniona między układem a otoczeniem ilość energii
mechanicznej związanej z uporządkowanym ruchem pewnej części układu. Dla
przemiany różniczkowej ilość tę oznaczamy przez δW. Istnieją dwie konwencje
określające znak pracy. W termodynamice technicznej za dodatnią uważa się
pracę wykonaną przez układ na otoczeniu. Przy pracy dodatniej w takiej umowie
energię traci układ a zyskuje otoczenie. W termodynamice chemicznej oraz
w chemii fizycznej konwencja jest odwrotna. Za dodatnią uważa się tam pracę
wykonaną przez otoczenie
na
układzie. Ja w dalszym układzie będę stosował
konwencję pierwszą.
15
15
PARAMETRY PRZEMIANY cd.
)
(
)
(
1
1
2
2
V
p
V
p
W
pV
W
W
t
)
(
)
(
Vdp
pdV
W
pV
d
W
W
t
3. Praca techniczna – W
t
, [J] – wielkość ekstensywna.
Praca techniczna jest pomocniczą wielkością opisującą przemianę termodynamiczną
określoną za pomocą wzoru
Dla przemiany różniczkowej powyższy wzór ma postać:
4. Pojemność cieplna układu podczas przemiany – C, [J/K]
Pojemność cieplna układu podczas przemiany jest ściśle zdefiniowana tylko dla
przemian różniczkowych. Zakładając, że w danej przemianie wymienione ciepło
wynosi δQ a przyrost temperatury dT, pojemność cieplną określa się jako:
dT
Q
C
16
16
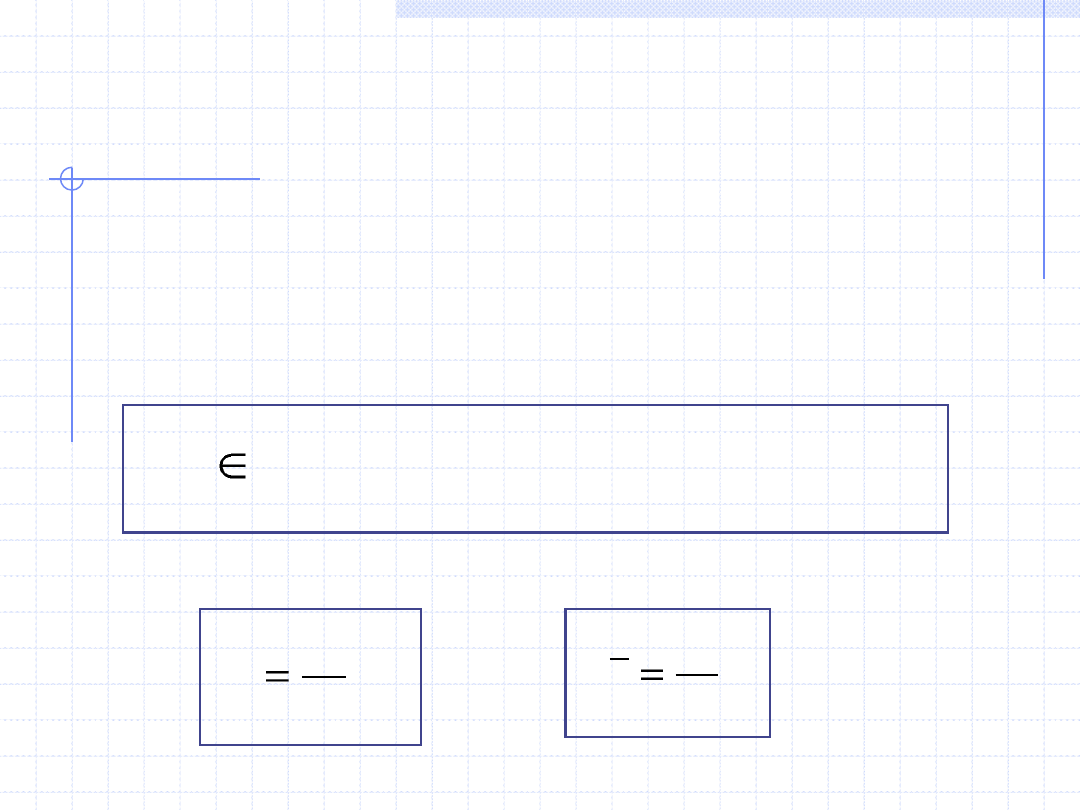
WŁAŚCIWE PARAMETRY STANU
}
,
,
,
,
,
,
,
,
,
{
C
W
W
Q
G
A
S
H
U
V
X
t
n
X
x
Dla układów zamkniętych często zamiast ekstensywnych parametrów
stanu i parametrów przemiany stosuje się intensywne tzw. wielkości
właściwe.
Istnieją dwa rodzaje wielkości właściwych – masowe i molowe.
Niech duża litera X oznacza jeden z ekstensywnych parametrów stanu
lub parametrów przemiany:
Odpowiednie intensywne wielkości właściwe są określone wzorami:
m
X
x
17
17
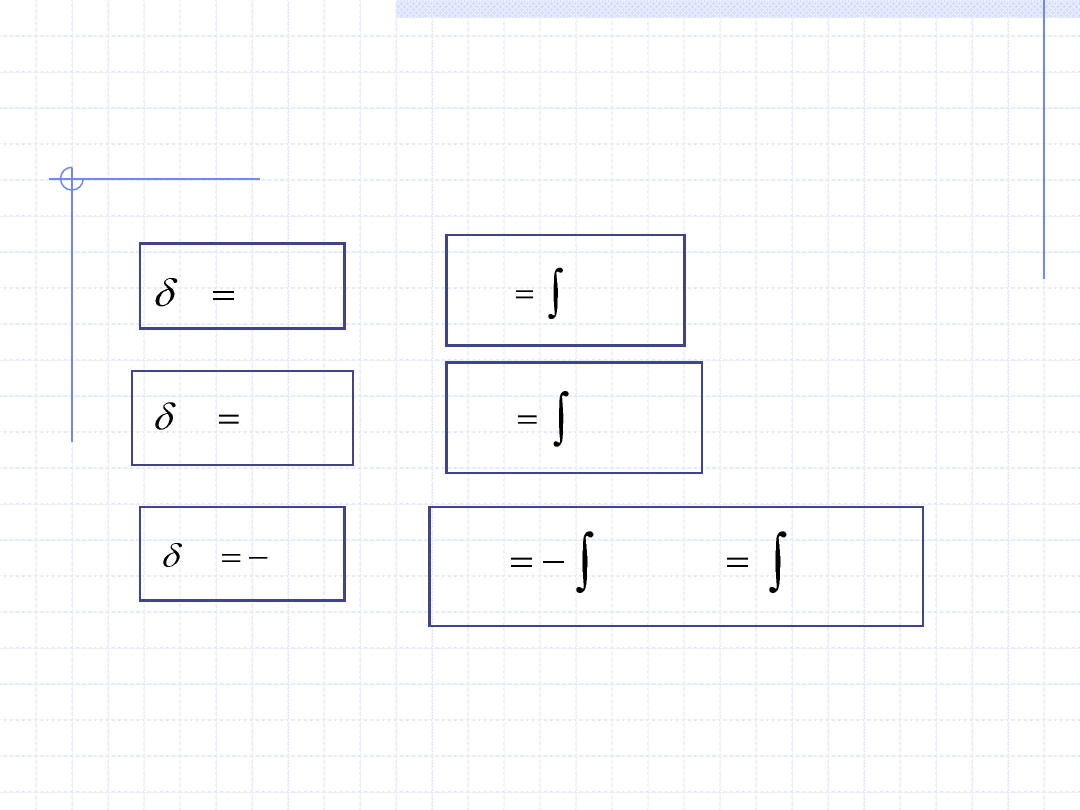
PODSTAWOWE WZORY OKREŚLAJĄCE CIEPŁO,
PRACĘ I PRACĘ TECHNICZNĄ W PRZEMIANACH
RÓŻNICZKOWYCH I CAŁKOWYCH
CdT
Q
2
1
)
(
T
T
dT
T
C
Q
pdV
W
Powyższe definicje oraz proste rozważania prowadzą do następujących wzorów:
2
1
)
(
V
V
dV
V
p
W
Vdp
W
t
1
2
2
1
)
(
)
(
p
p
p
p
t
dp
p
V
dp
p
V
W
Analogiczne wzory obowiązują dla odpowiednich parametrów właściwych:
18
18
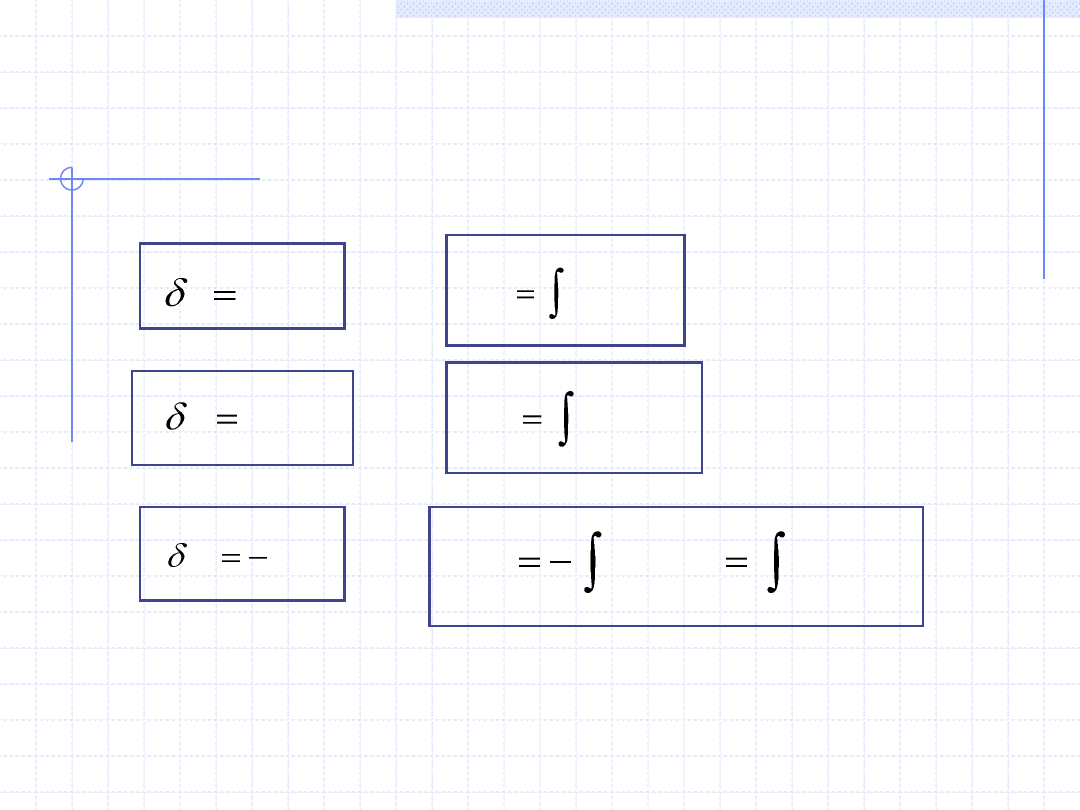
PODSTAWOWE WZORY OKREŚLAJĄCE CIEPŁO,
PRACĘ I PRACĘ TECHNICZNĄ W PRZEMIANACH
RÓŻNICZKOWYCH I CAŁKOWYCH
cdT
q
2
1
)
(
T
T
dT
T
c
q
pdv
w
2
1
)
(
v
v
dv
v
p
w
vdp
w
t
1
2
2
1
)
(
)
(
p
p
p
p
t
dp
p
v
dp
p
v
w
W celu zastosowania wzorów całkowych konieczna jest znajomość odpowiednich funkcji.
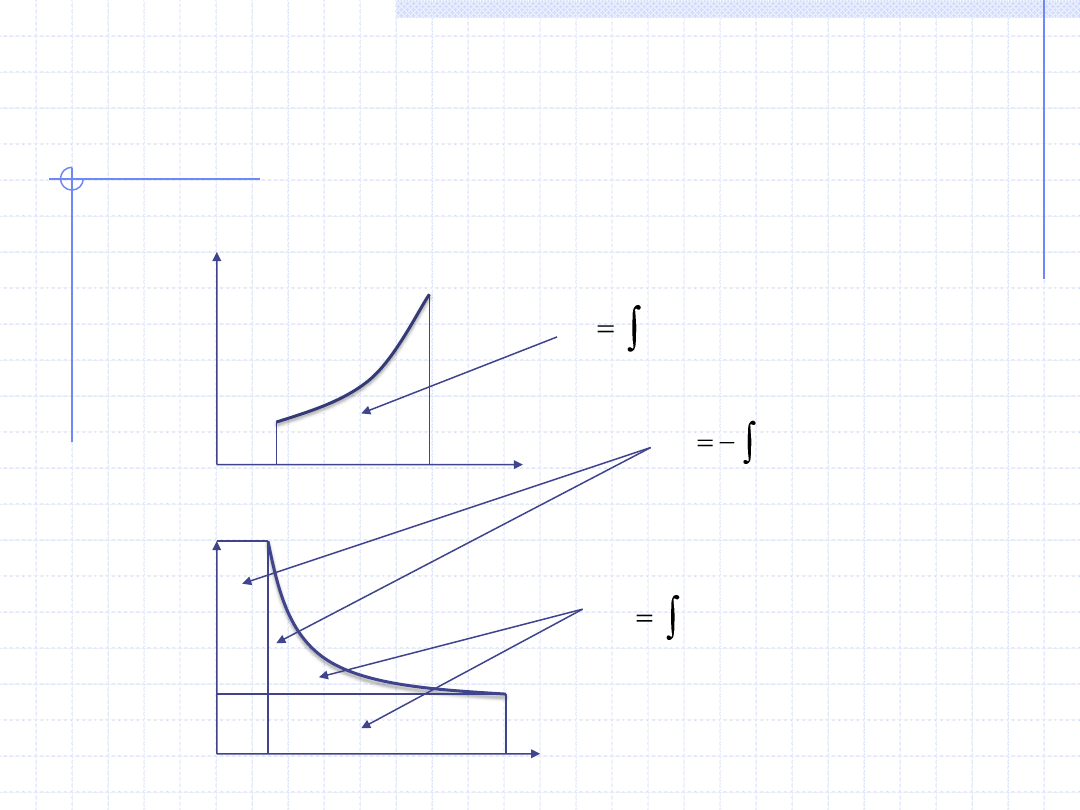
19
19
WYKREŚLNA ILUSTRACJA CIEPŁA, PRACY
I PRACY TECHNICZNEJ
2
1
T
T
CdT
Q
2
1
V
V
pdV
W
Wzory całkowe mają prostą interpretację graficzną:
T
T
1
T
2
p
V
p
1
p
2
v
1
v
2
2
1
p
p
t
Vdp
W
C
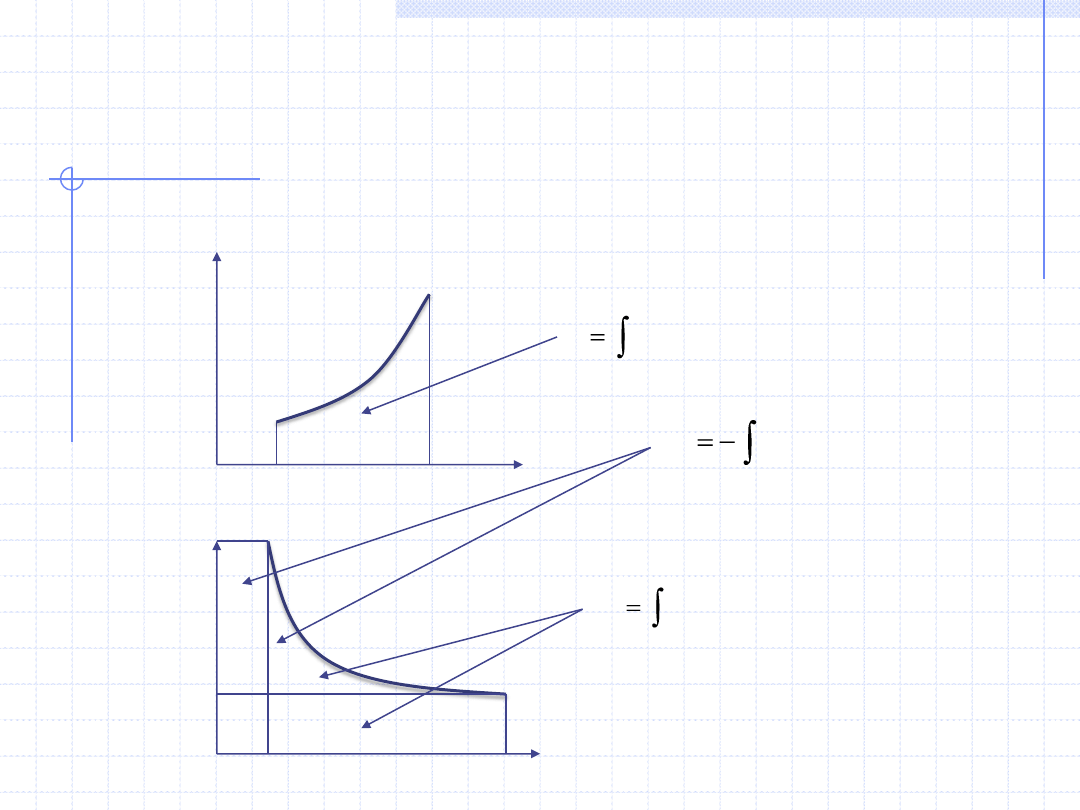
20
20
WYKREŚLNA ILUSTRACJA CIEPŁA, PRACY
I PRACY TECHNICZNEJ
2
1
T
T
cdT
q
2
1
v
v
pdv
w
Analogiczna interpretacja dla odpowiednich wielkości właściwych:
c
T
T
1
T
2
p
v
p
1
p
2
v
1
v
2
2
1
p
p
t
vdp
w

21
21
ODWRACALNOŚĆ I QUASI-STATYCZNOŚĆ
PRZEMIAN TERMODYNAMICZNYCH
Bardzo ważnym pojęciem jest tzw. odwracalność przemian
termodynamicznych. Jest to pojęcie idealne tzn. że rzeczywiste
przemiany nigdy nie są odwracalne.
Daną przemianę będziemy nazywać odwracalną gdy możliwy jest
powrót zarówno układu jak i otoczenia do punktu wyjściowego.
Przemianę będziemy nazywać quasi-statyczną jeżeli jest ona ciągiem
następujących po sobie stanów równowagi układu.
Każda przemiana odwracalna jest przemianą quasi-statyczną.
Przemianę, która nie jest odwracalna nazywamy przemianą
nieodwracalną.

22
To na dzisiaj tyle.
Dziękuję bardzo Państwu za uwagę.
Wyszukiwarka
Podobne podstrony:
Ogolnotech dla Bio I WYKLAD IV
Ogolnotech(dla Bio I) WYKLAD I
Ogolnotech(dla Bio I) WYKLAD V
Ogolnotech dla Bio I WYKLAD III
Ogolnotech(dla Bio I) WYKLAD IX
Ogolnotech dla Bio I WYKLAD IV
Ogolnotech(dla Bio I) W VI
Ogolnotech dla Bio Ir WYKLAD IX
Ogolnotech(dla Bio Ir) WYKLAD X
Ogolnotech(dla Bio Ir) WYKLAD XI
Ogolnotech dla Bio IV WYKLAD VII
Ogolnotech(dla Bio I) W VI
Ogolnotech(dla Bio I) W X
więcej podobnych podstron