1
OGÓLNOTECHNICZNE
PODSTAWY BIOINŻYNIERII
Wykład VII
Podstawy techniki cieplnej i
termodynamiki procesowej
22
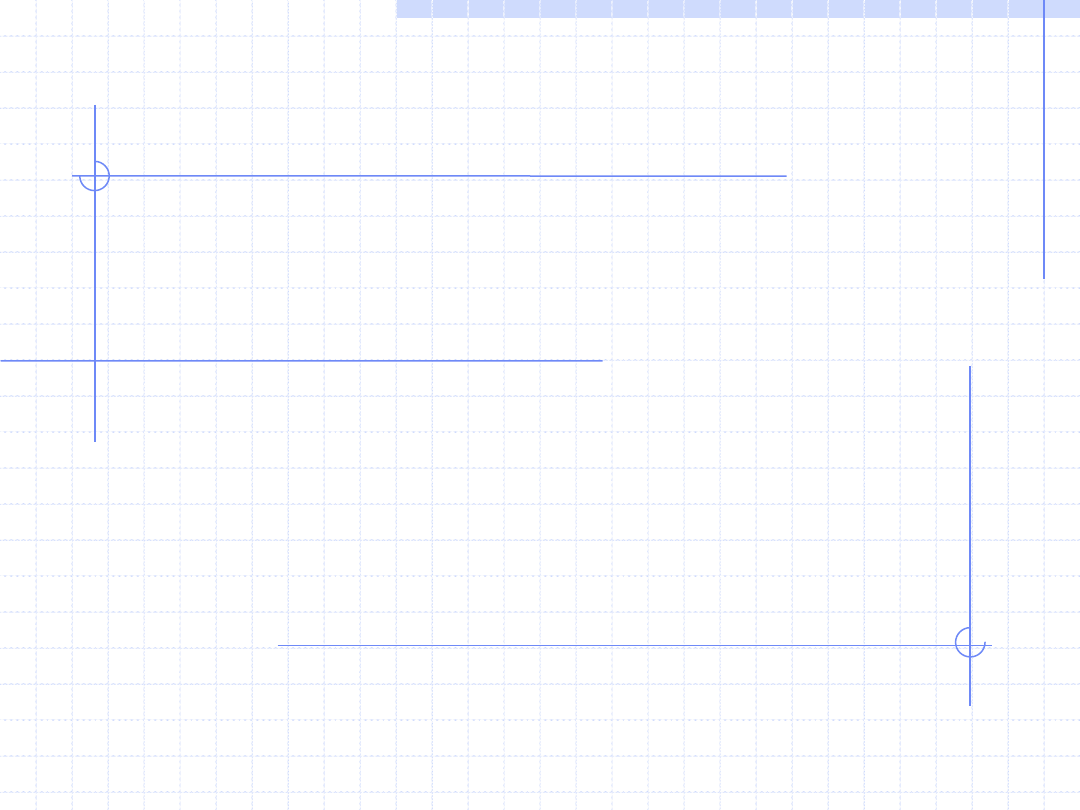
POJĘCIE GAZU DOSKONAŁEGO
nRT
pV
K
mol
J
K
kmol
J
R
31447
.
8
47
.
8314
Inną ważną idealizacją w termodynamice jest pojęcie tzw. gazu
doskonałego.
Gazem doskonałym nazywamy ciągły ośrodek termodynamiczny,
którego cząsteczki spełniają warunki:
1 - nie posiadają objętości własnej tzn. są traktowane jak punkty
materialne.
2 - nie oddziaływują ze sobą tzn. ani się nie przyciągają ani nie
odpychają.
Na podstawie kinetyki statystycznej można wykazać że gaz doskonały
musi spełniać tzw. równanie stanu gazu doskonałego:
- uniwersalna stała gazowa
RT
pv
n – liczność substancji zawartej
w układzie [kmol]
33
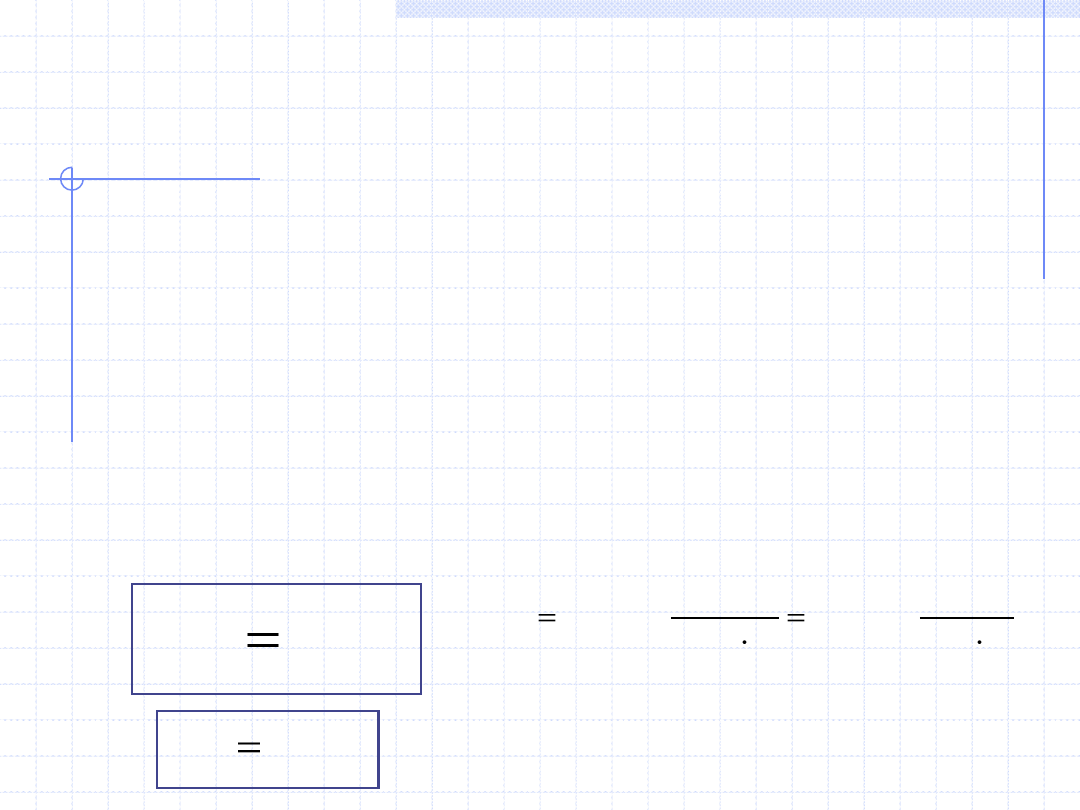
WŁASNOŚCI GAZU
DOSKONAŁEGO
0
p
T
Gazy rzeczywiste na ogół nie spełniają warunków gazu doskonałego,
niemniej jednak w wielu przypadkach odchylenia od tych warunków
nie są duże, tak że w przybliżeniu można je traktować jak gazy
doskonałe. Te warunki to przede wszystkim niskie ciśnienie i wysoka
temperatura.
Gaz rzeczywisty
Gaz doskonały
Założenie, że dany ośrodek zawarty w układzie jest gazem doskonałym
znakomicie upraszcza wiele zależności. Przykładowo gęstość gazu
doskonałego można obliczyć ze wzoru:
RT
pM
v
M
V
m
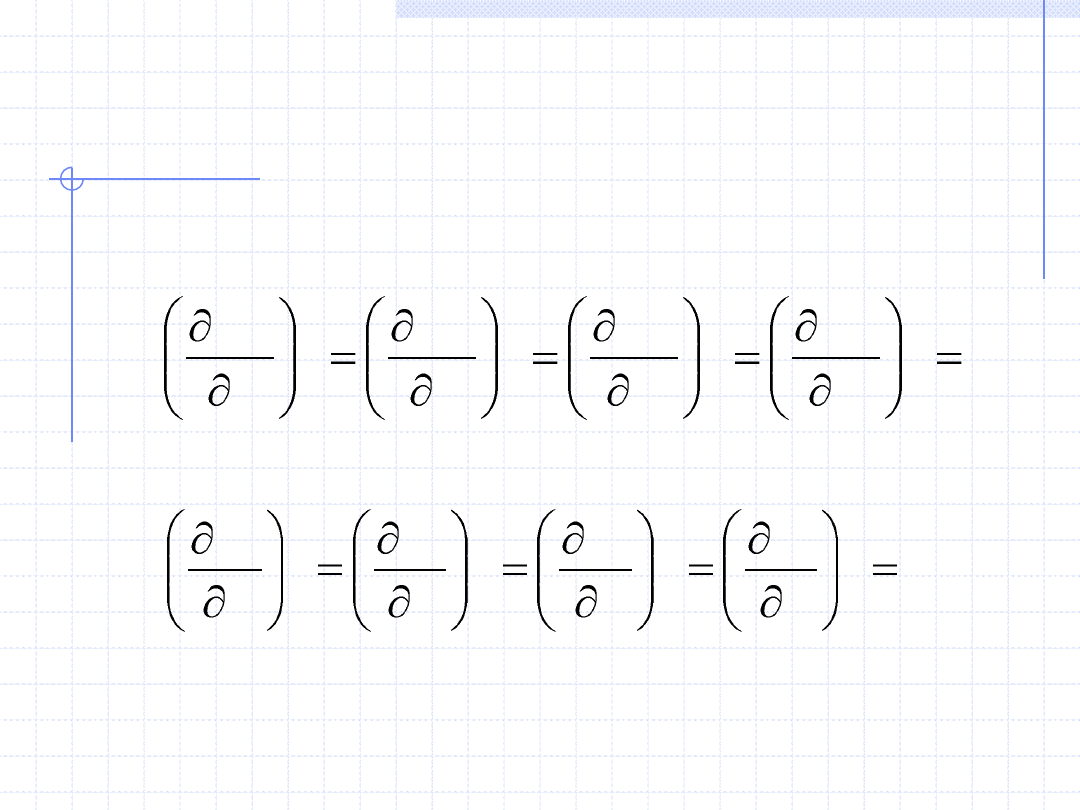
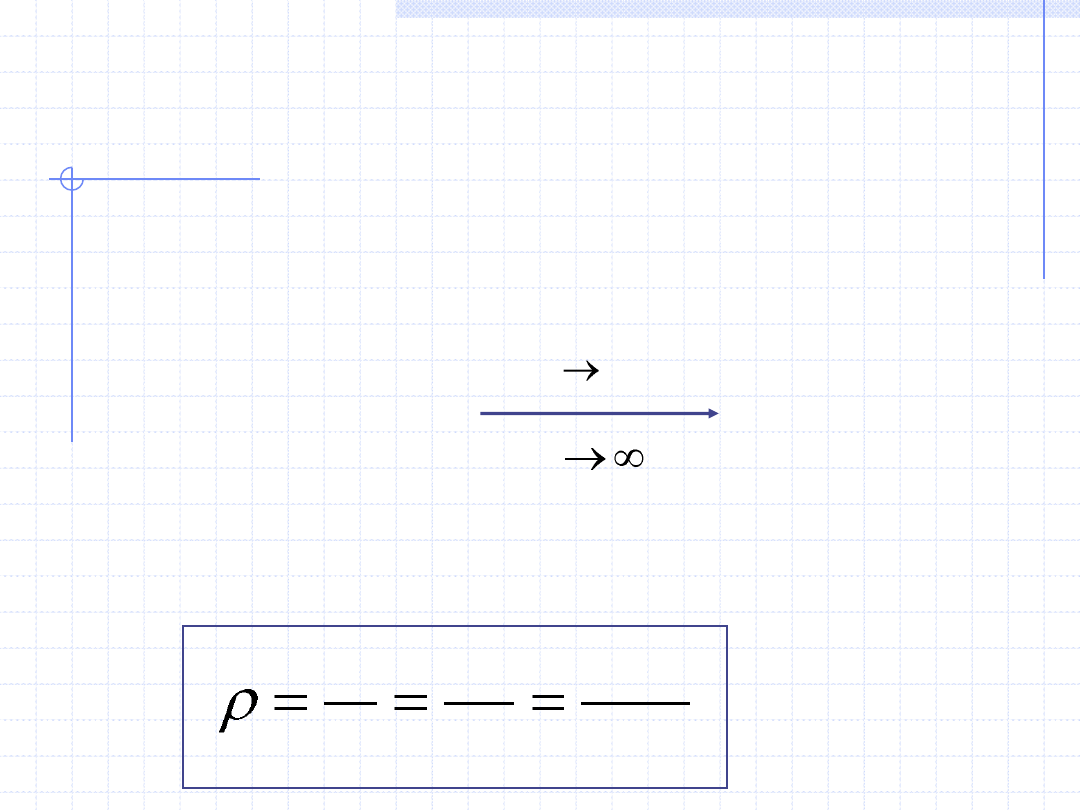
44
WŁASNOŚCI GAZU
DOSKONAŁEGO cd.
0
T
d
T
d
T
d
T
d
V
H
V
U
p
H
p
U
Gazy doskonałe posiadają szereg ważnych własności. Oto niektóre z nich:
• Ich energia wewnętrzna i entalpia zależą tylko od temperatury, a nie zależą
od ciśnienia i objętości co można zapisać różniczkowo:
0
T
d
T
d
T
d
T
d
v
h
v
u
p
h
p
u
lub dla wielkości właściwych:
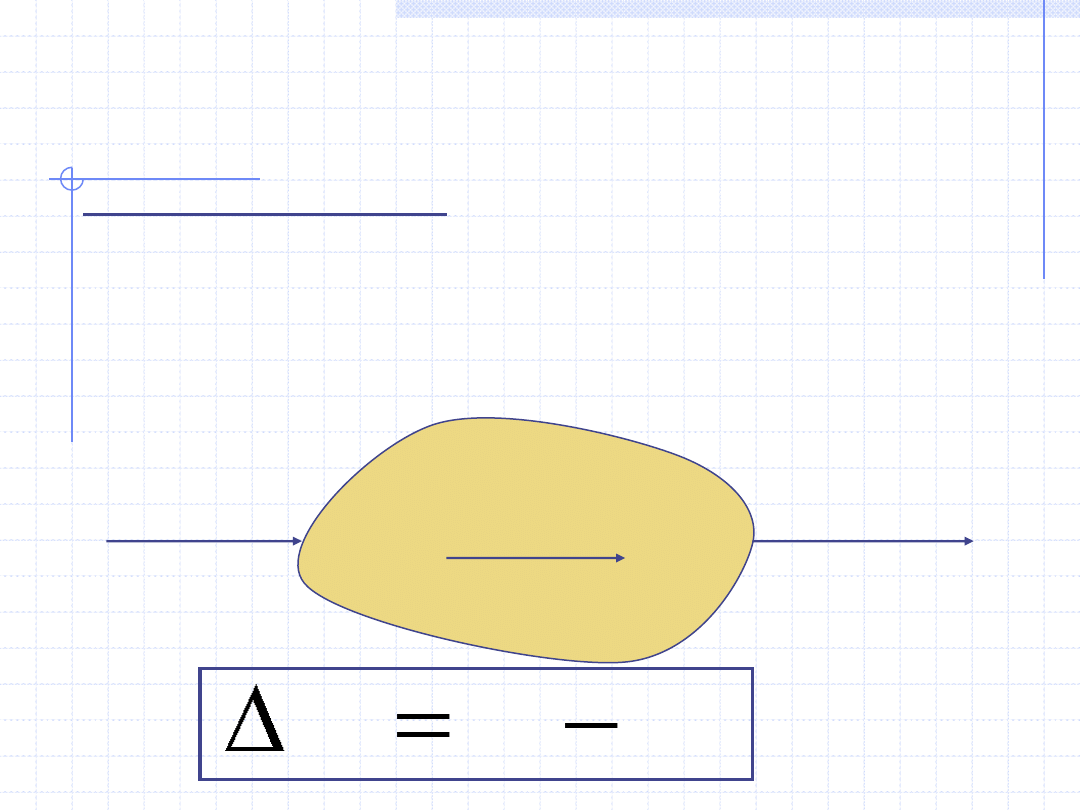
I ZASADA TERMODYNAMIKI
I zasada termodynamiki jest to w swojej istocie prawo zachowania
energii sformułowane dla dowolnej przemiany układu termodynamicznego.
I zasadę można formułować dla układów zamkniętych i otwartych.
Istnieje bardzo wiele matematycznych zapisów tej zasady. Przykładowo
napiszmy tą zasadę dla całkowej (nieróżniczkowej) przemiany układu
zamkniętego bazując na energii wewnętrznej.
Stan 1
Stan 2
ΔU=U
2
-U
1
Q
W
W
Q
U
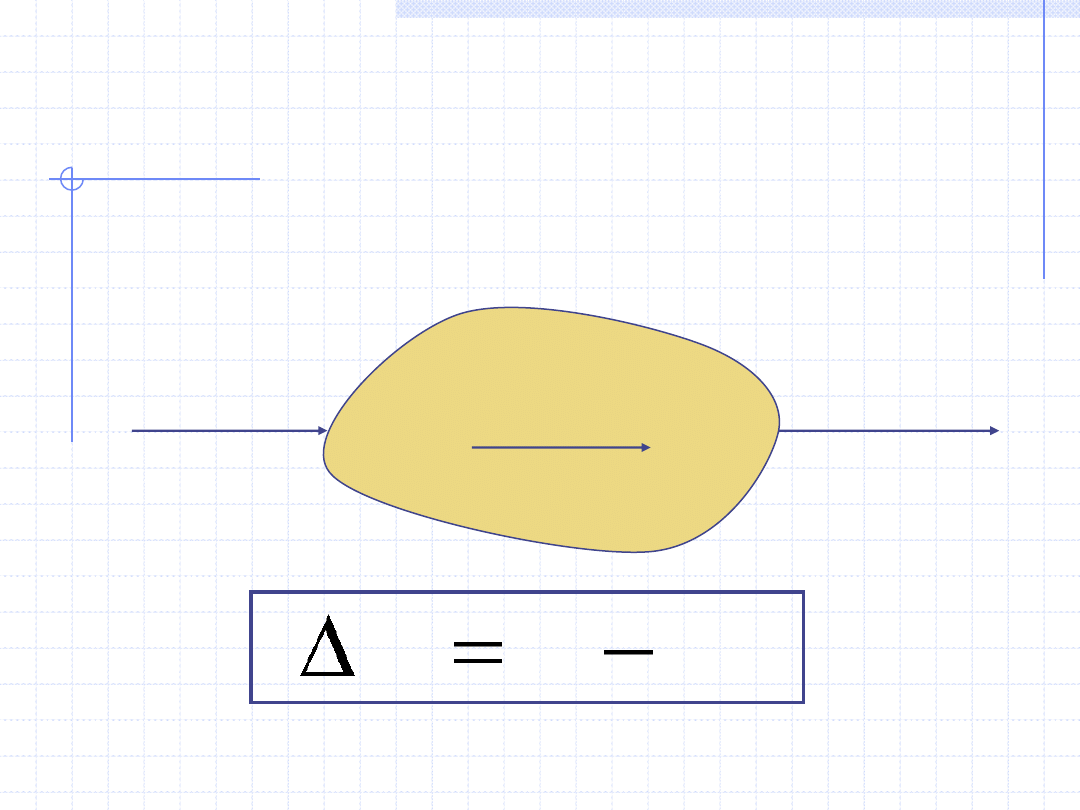
I ZASADA TERMODYNAMIKI
Stosunkowo często I zasada jest formułowana na bazie entalpii.
W takim przypadku w bilansie energetycznym zamiast pracy
objętościowej używa się pracy technicznej
Stan 1
Stan 2
ΔH=H
2
-H
1
Q
W
t
t
W
Q
H
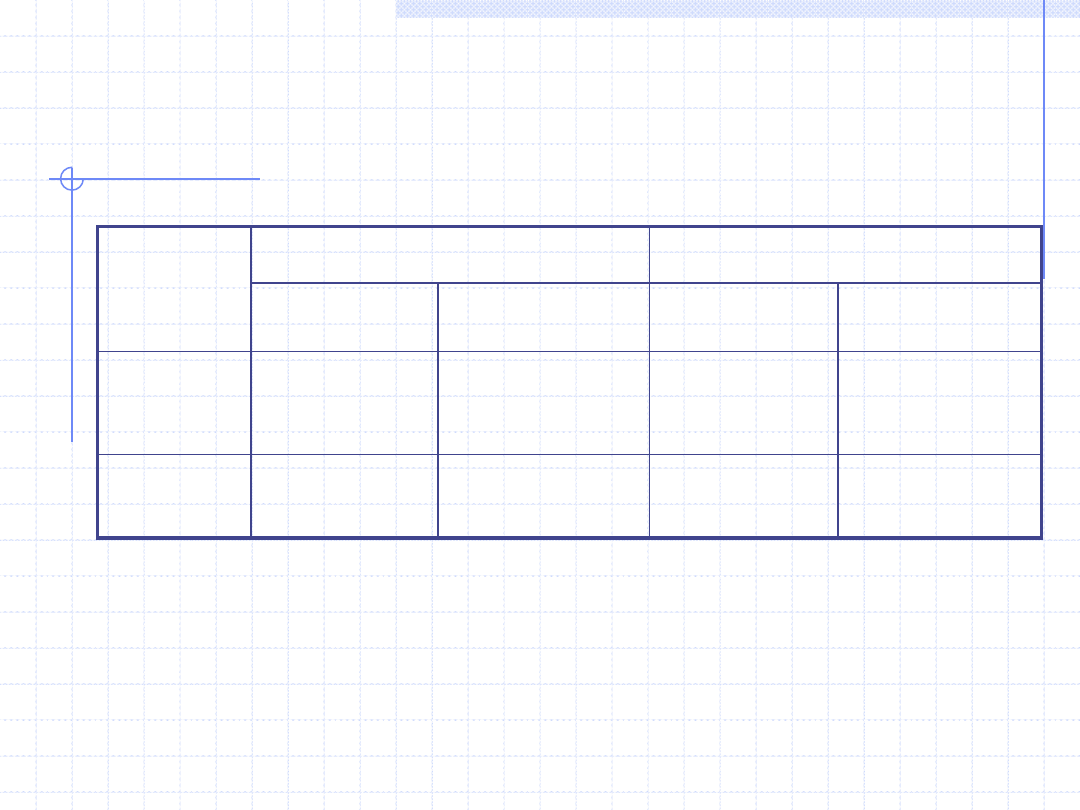
INNE SFORMUŁOWANIA PIERWSZEJ
ZASADY TERMODYNAMIKI
dh=δq-δw
t
Δh=q-w
t
dH=δQ-δW
t
ΔH=Q-W
t
Baza:
Entalpia
du=δq-δw
Δu=q-w
dU=δQ-δW
ΔU=Q-W
Baza:
Energia
wewnętrzna
Przem. różnicz.
Przem. całk.
Przem. różniczk.
Przem.
całkowa
Wielkości właściwe
Wielkości ekstensywne
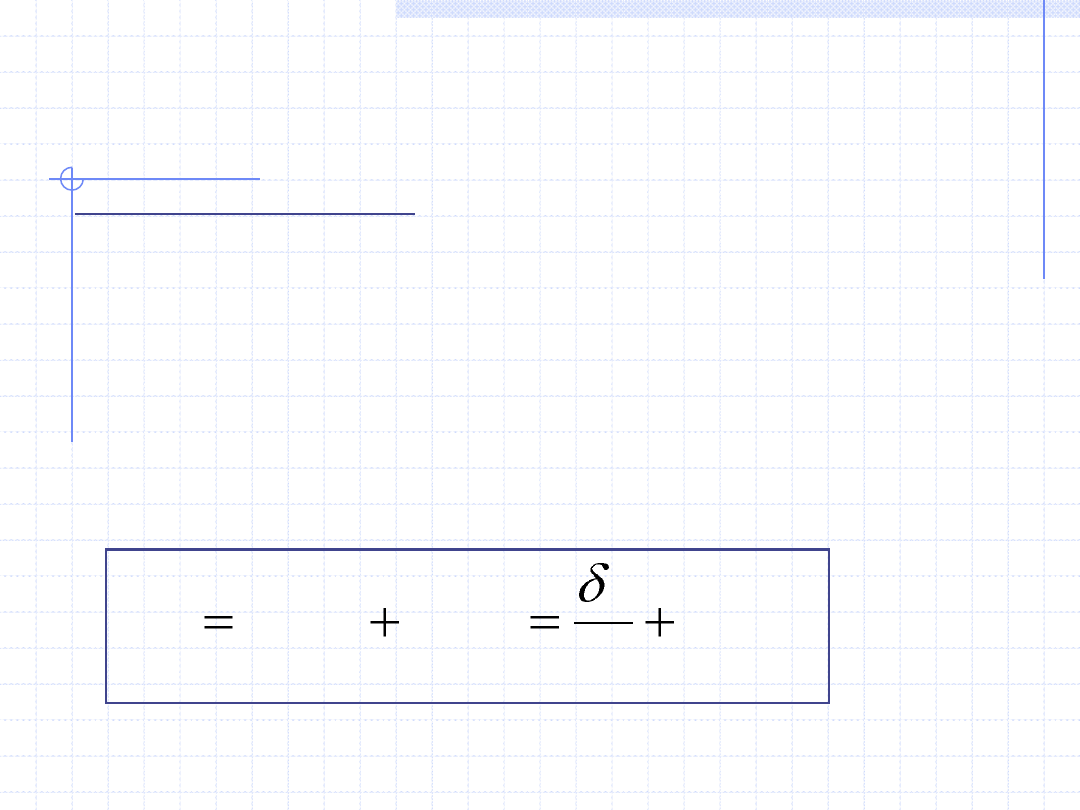
II ZASADA TERMODYNAMIKI
II zasada termodynamiki posiada ogromną liczbę bardzo różnych sformułowań.
Dla celów termodynamiki procesowej podam sformułowanie oparte na tzw.
nierówności Clausiusa. Sformułowanie to opisuje zjawisko nieodwracalności
przemian termodynamicznych oraz uwzględnia klasyczną definicję entropii.
Załóżmy, że układ ulega dowolnej (odwracalnej lub nieodwracalnej) różniczkowej
przemianie termodynamicznej. W tej przemianie układ wymienia z otoczeniem
ciepło δq. W czasie przemiany zmieniać się mogą wszystkie parametry stanu.
Zmiana entropii wyniesie ds. Istnieją dwie przyczyny zmiany entropii:
1 - zmiana stanu energetycznego układu związana z wymianą ciepła,
2 - zmiana liczby dostępnych stanów energetycznych związana z
nieodwracalnymi efektami przemiany. Fakt ten można zapisać równaniem:
i
i
r
ds
T
q
ds
ds
ds
)
(
)
(
)
(
r – oznacza zmiany związane z odwracalnością przemiany (reversible)
i – oznacza zmiany związane z nieodwracalnością przemiany (irreversible)
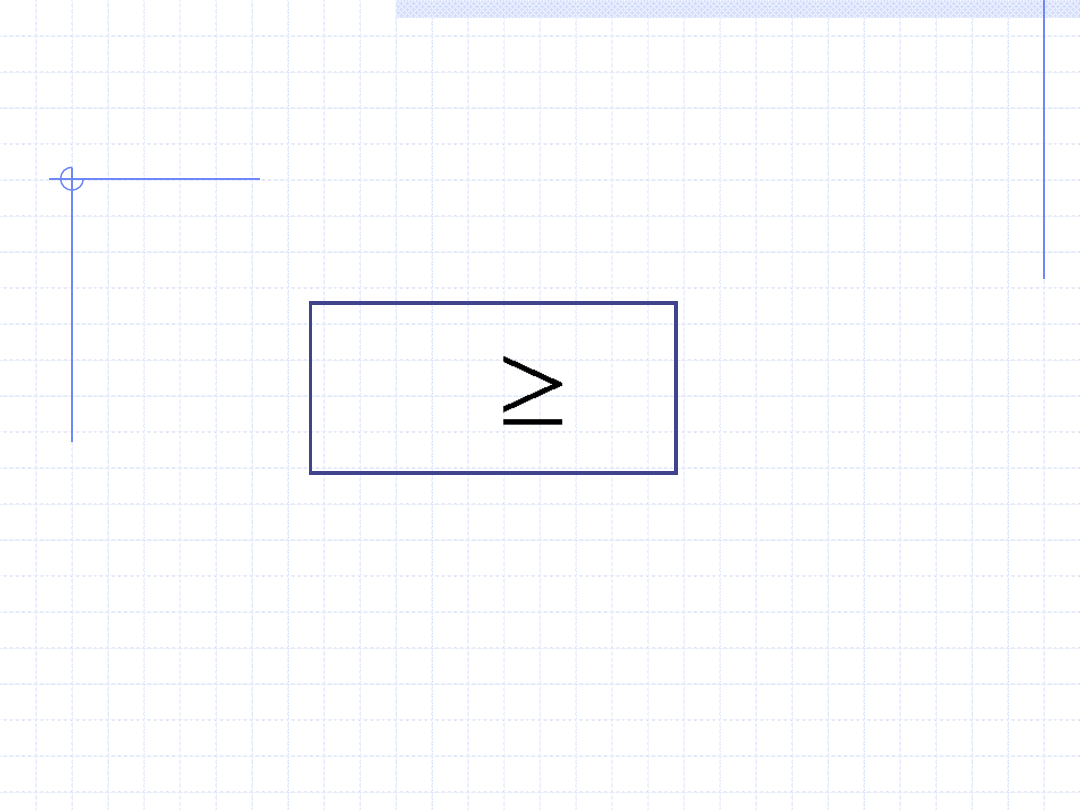
II ZASADA TERMODYNAMIKI cd.
Nierówność Clausiusa dotyczy tej części zmiany entropii, która jest związana
z nieodwracalnością przemian i stanowi jedno z wielu sformułowań II zasady
termodynamiki.
0
i
ds
Słownie oznacza to, że każda nieodwracalność powoduje wzrost entropii.
Ponieważ wszystkie przemiany samorzutne (odbywające się bez ingerencji
z zewnątrz) są nieodwracalne, z nierówności Clausiusa wynika, że w takich
przemianach entropia rośnie osiągając wartość maksymalną w stanie
równowagi, w którym mogą zachodzić tylko przemiany odwracalne.
Równość zachodzi tylko
w przypadku przemian
odwracalnych
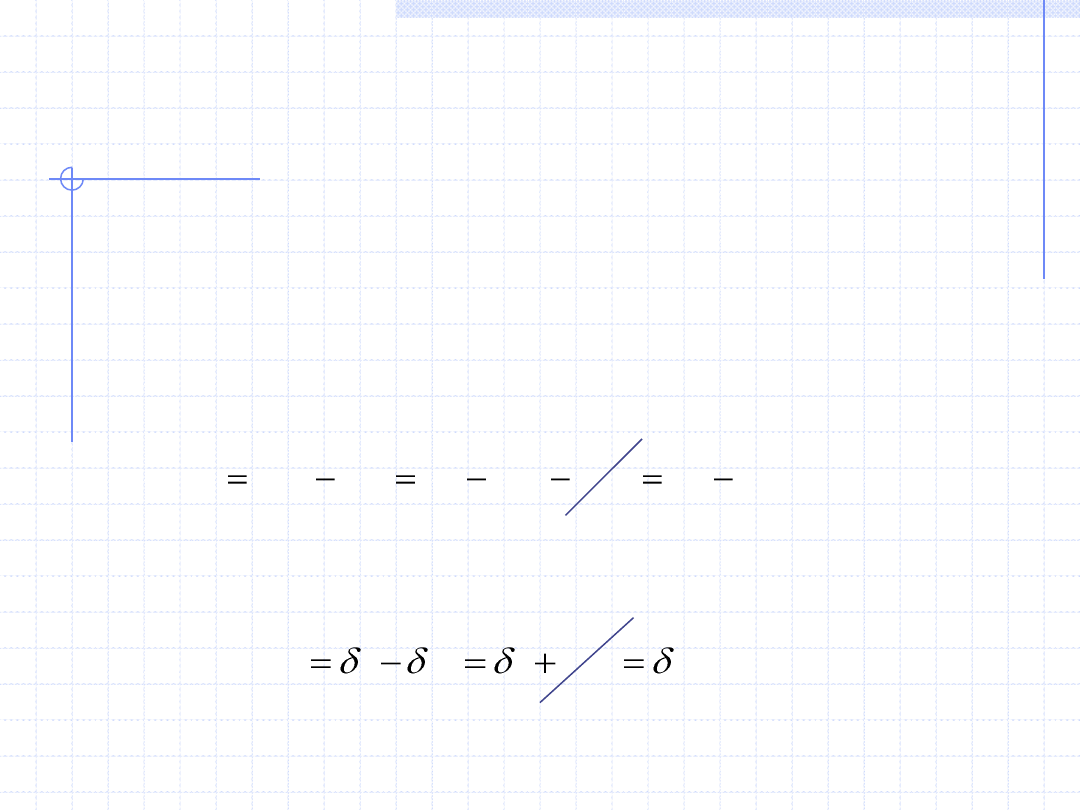
WNIOSKI Z II ZASADY TERMODYNAMIKI
Tds
dh
sdT
Tds
dh
Ts
h
d
dg
)
(
q
vdp
q
w
q
dh
t
W związku z rozważaniem stanów równowagi termodynamicznej, bardzo
ważny jest wniosek wynikający z II zasady zastosowanej do przemian,
w których układ dąży do stanu równowagi po ustaleniu się temperatury
i ciśnienia. Rozważamy zatem izotermiczno-izobaryczną przemianę
nieodwracalną (T=const., dT=0 p=const., dp=0). Rozpatrzmy jak będzie
się zachowywać w takiej przemianie entalpia swobodna (energia Gibbsa) g.
Na podstawie definicji entalpii swobodnej możemy napisać wzór
określający jej różniczkę dg:
Uwzględniając I zasadę termodynamiki oraz wzór określający różniczkową
pracę techniczną dostajemy:
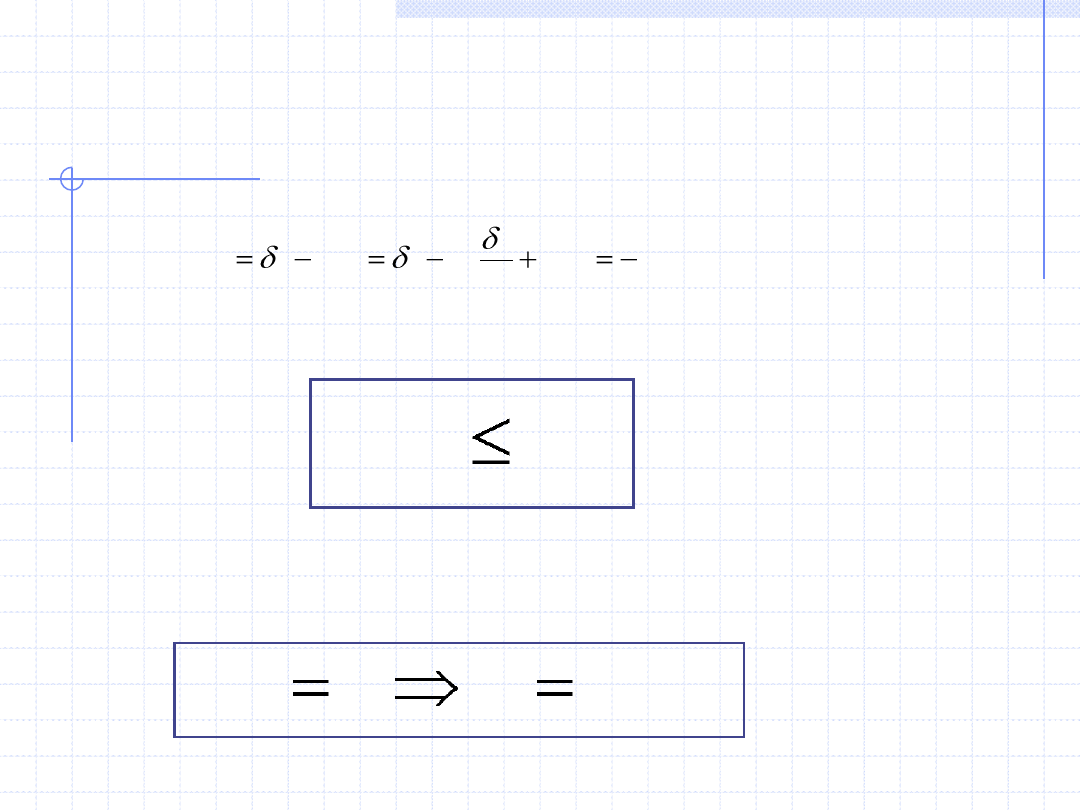
WNIOSKI Z II ZASADY TERMODYNAMIKI cd.
i
i
Tds
ds
T
q
T
q
Tds
q
dg
)
(
0
dg
Podstawiając uzyskany wynik do wyrażenia na dg otrzymujemy:
Uwzględniając nierówność Clausiusa dostajemy warunek, który spełnia
entalpia swobodna w przemianach samorzutnych:
Słownie oznacza to, że w przemianach samorzutnych dążących do stanu
równowagi, entalpia swobodna (G lub g) maleje i w stanie równowagi osiąga
wartość minimalną. Warunkiem równowagi termodynamicznej w stałej
temperaturze i pod stałym ciśnieniem jest zatem równość różniczkowa:
.
min
0
g
dg
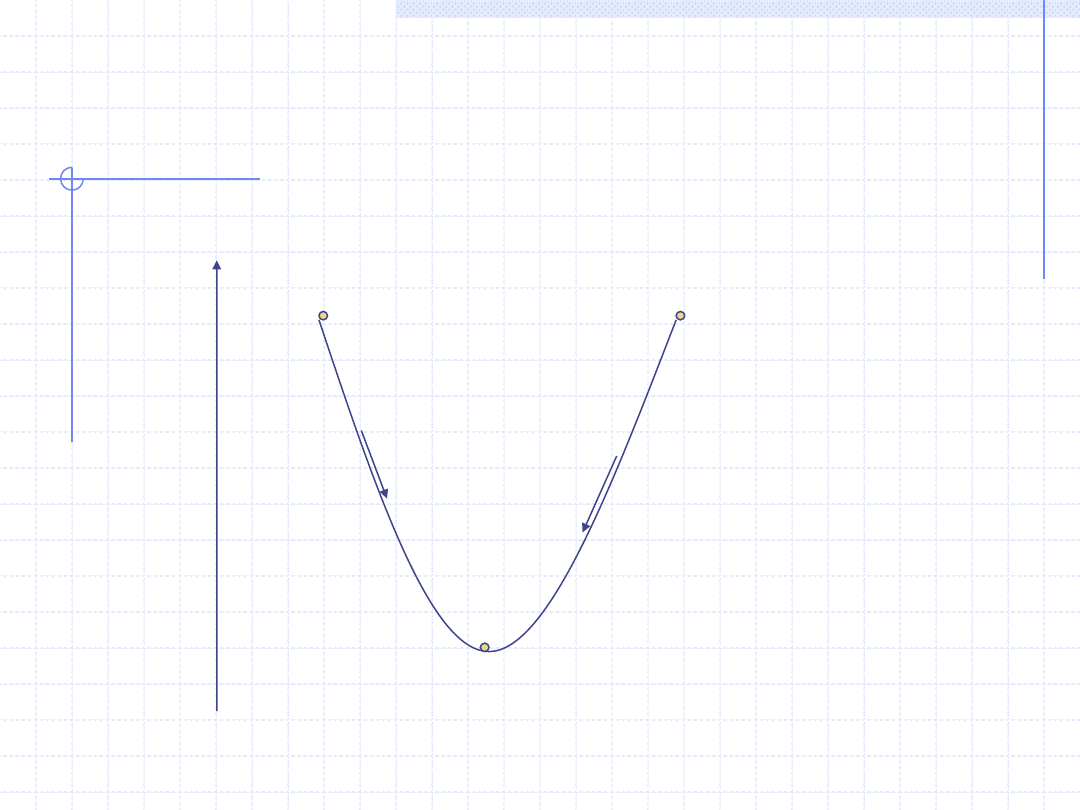
WNIOSKI Z II ZASADY TERMODYNAMIKI cd.
Graficznie wniosek ten można opisać następująco:
T=const, p=const
g
Brak równowagi
Brak równowagi
Stan równowagi termodynamicznej g=min.

Proste przemiany
termodynamiczne
Spośród bardzo wielu możliwych przemian termodynamicznych szczególną
rolę odgrywają przemiany spełniające pewien prosty warunek. Warunek
ten najczęściej określa stałość określonego parametru lub funkcji stanu.
W nazwie stałość ta jest opisana za pomocą przedrostka „izo”.
Mamy zatem następujące przemiany proste:
1. Przemiana izochoryczna – V=const.
2. Przemiana izobaryczna – p=const.
3. Przemiana izotermiczna – T=const.
4. Przemiana izentropowa – S=const. (przemiana adiabatyczna)
5. Przemiana politropowa – C=const.
Teraz omówimy po kolei omówimy poszczególne przemiany.
Przemiany te będziemy ilustrować wykresami w układzie p – v
tzn. ciśnienie – objętość właściwa (będziemy zakładać przemiany
w układach zamkniętych czyli n=const.)
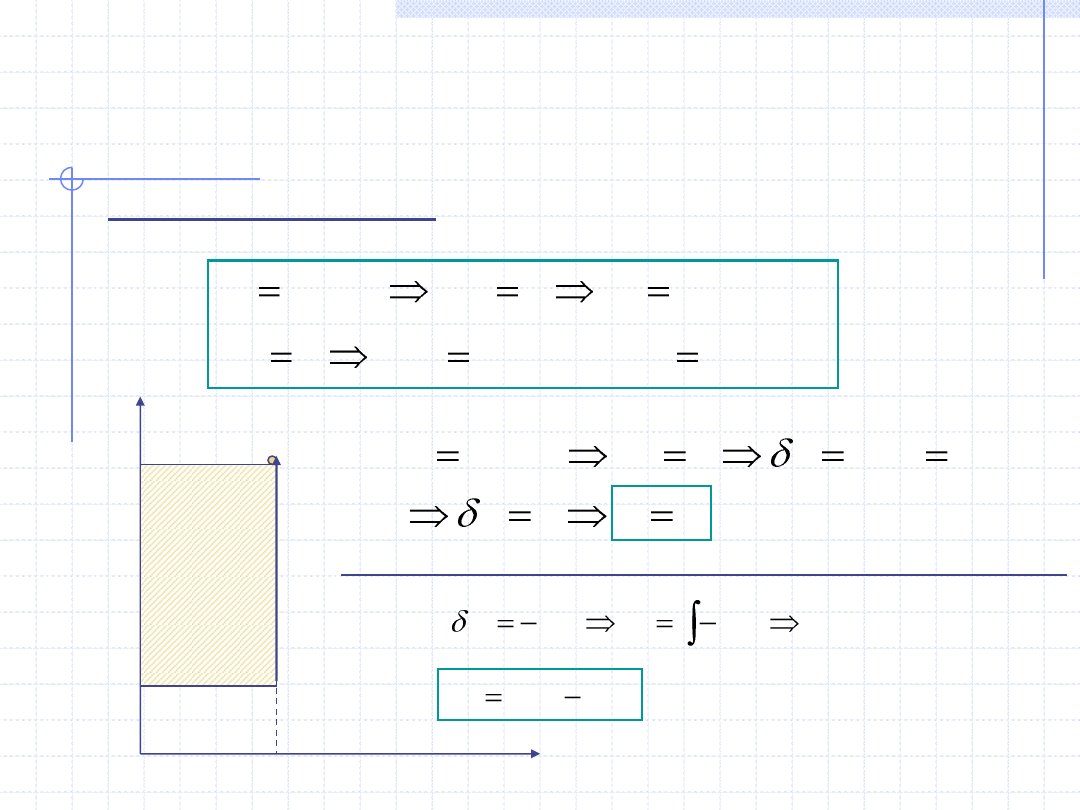
Przemiana izochoryczna
.)
(
0
0
.
1
2
1
2
const
n
dla
v
v
dv
V
V
dV
const
V
0
0
0
0
.
w
w
pdv
w
dv
const
v
Przemiana izochoryczna odbywa się przy stałej objętości:
p
v
w
t
v=const.
p
1
,T
1
p
2
,T
2
Praca objętościowa w przemianie izochorycznej jest równa 0.
)
(
2
1
2
1
p
p
v
w
vdp
w
vdp
w
t
p
p
t
t
Wartość pracy technicznej przemiany
izochorycznej jest równa polu
zakreskowanego prostokąta.
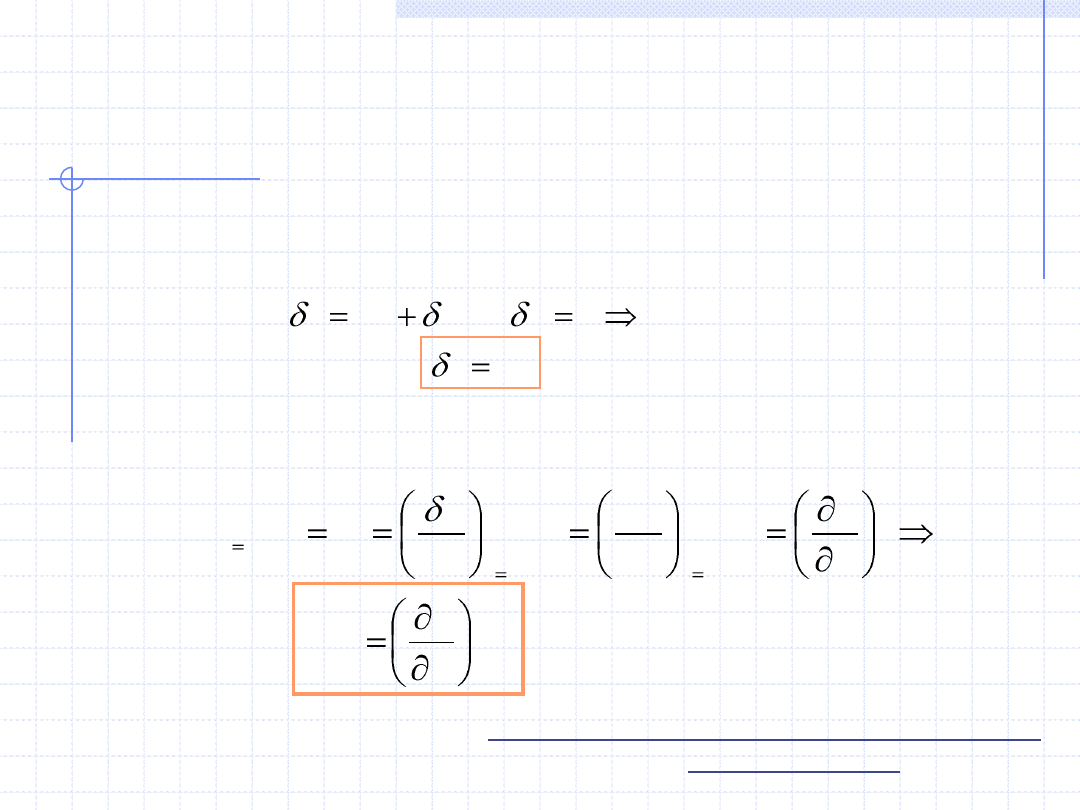
Przemiana izochoryczna cd.
du
q
w
w
du
q
0
Rozpatrzmy teraz pojemność cieplną układu podczas przemiany
izochorycznej. Na mocy I zasady termodynamiki dla różniczkowej
przemiany można napisać:
Przypomnijmy teraz definicję właściwej pojemności cieplnej dla
rozważanej przemiany:
v
v
v
const
v
const
v
v
const
v
T
u
c
T
u
dT
du
dT
q
c
c
.
.
.
)
(
Wzór powyższy dowodzi, że pojemność cieplna w przemianie izochorycznej
jest pochodną funkcji stanu a zatem również jest funkcją stanu.
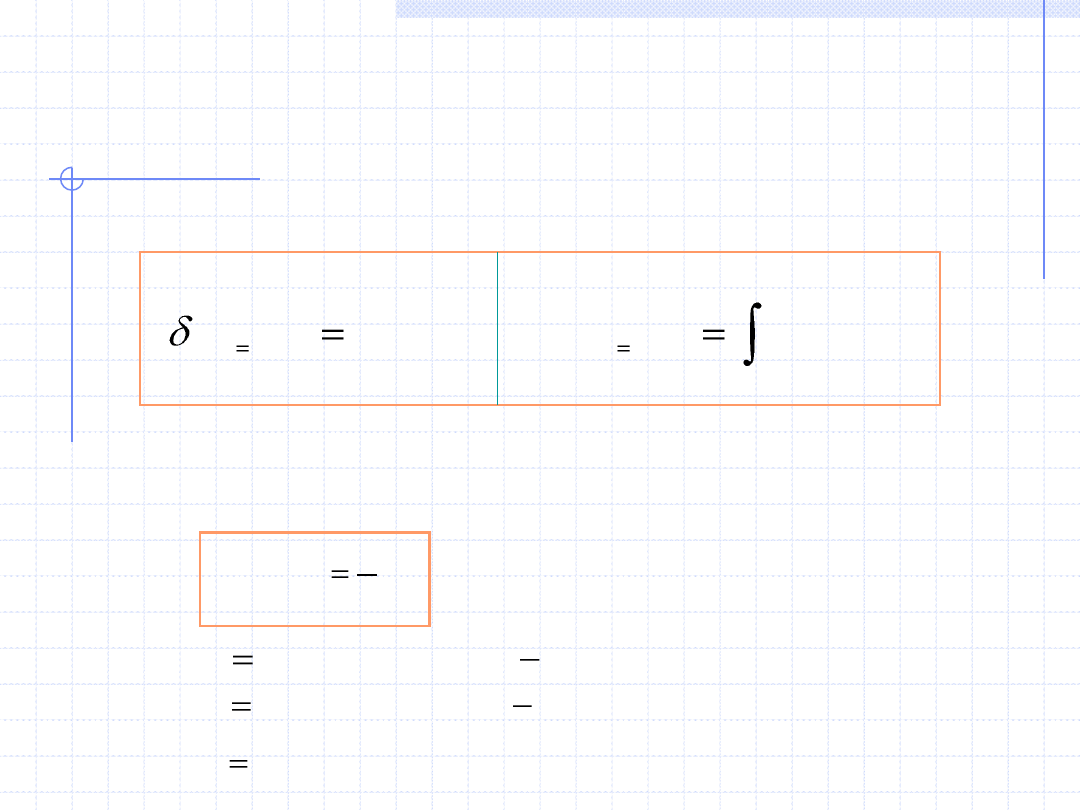
Przemiana izochoryczna cd.
2
1
)
(
)
(
)
(
.
.
T
T
v
const
v
v
const
v
dT
T
c
q
dT
c
q
:
2
)
(
)
(
gdzie
R
k
c
GD
v
atomowych
gazów
dla
k
1
3
Wielkość c
v
zależy od temperatury, ciśnienia i rodzaju ośrodka. Zależność
od temperatury pozwala na wyznaczenie ciepła przemiany izochorycznej:
Dla gazów doskonałych, z teorii kinetycznej wynika że wielkość c
v
powinna
być stała i równa:
atomowych
gazów
dla
k
2
5
wych
wieloatomo
gazów
dla
k
6
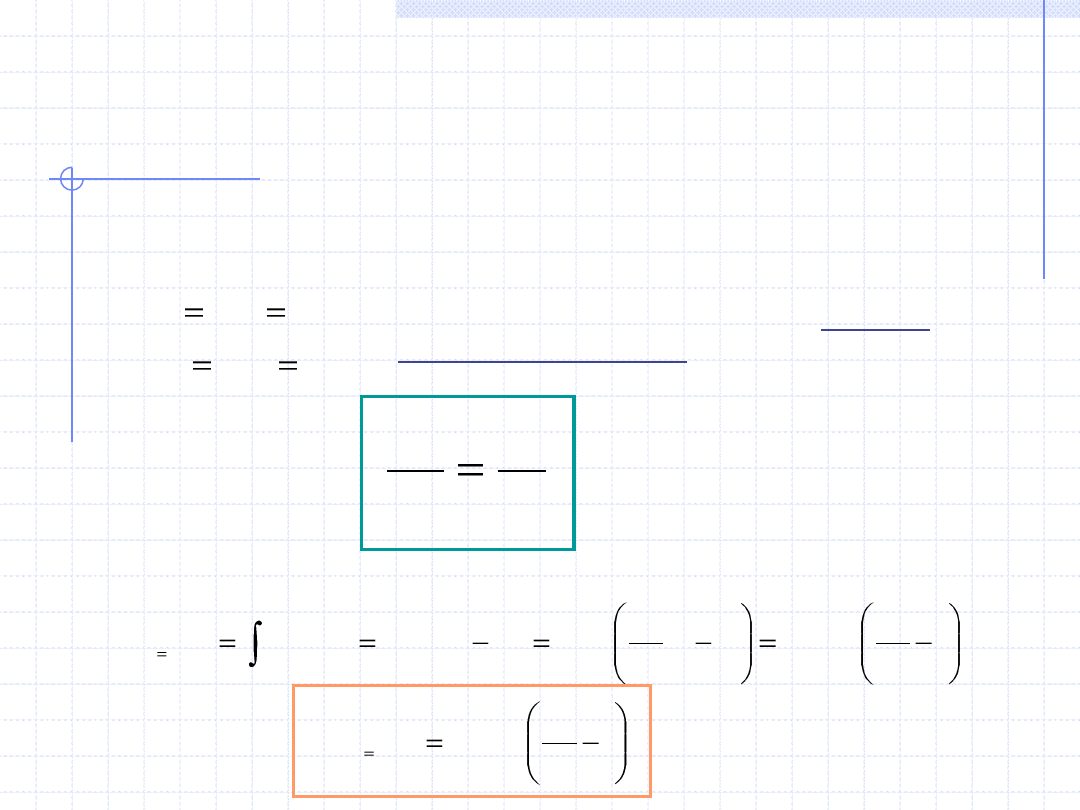
Przemiana izochoryczna cd.
2
2
2
2
1
1
1
1
RT
v
p
v
p
RT
v
p
v
p
1
)
(
1
)
(
)
(
1
2
1
)
(
)
(
.
1
2
1
)
(
1
1
1
2
)
(
1
2
)
(
)
(
)
(
.
2
1
p
p
T
c
q
p
p
T
c
T
T
p
p
c
T
T
c
dT
c
q
GD
v
GD
const
v
GD
v
GD
v
GD
v
T
T
GD
v
GD
const
v
Rozpatrzmy jeszcze dokładniej przemianę izochoryczną gazów doskonałych.
W każdy punkcie takiej przemiany musi być spełnione równanie stanu gazu
doskonałego. Dla punku początkowego i końcowego mamy:
Dzieląc stronami otrzymujemy tzw. równanie
przemiany izochorycznej uzależniające ciśnienie
i temperaturę w skrajnych punktach przemiany:
Dla gazów doskonałych również wzór określający ciepło ma prostą postać:
1
2
1
2
T
T
p
p
Przemiana izochoryczna cd.
1
)
(
)
(
)
(
)
(
)
(
)
(
1
2
1
)
(
)
(
.
)
(
.
.
.
.
.
p
p
T
c
q
u
q
u
du
dq
GD
v
GD
const
v
GD
const
v
const
v
const
v
const
v
const
v
1
)
(
)
(
1
)
(
1
)
(
)
(
)
(
)
(
)
(
)
(
1
2
1
)
(
2
1
1
1
1
2
1
)
(
2
1
1
2
1
)
(
)
(
.
)
(
.
)
(
.
.
.
.
p
p
T
R
c
p
p
p
RT
p
p
T
c
p
p
v
p
p
T
c
w
q
h
vdp
dT
c
w
q
dh
w
q
h
w
q
dh
w
dh
q
GD
v
GD
v
GD
v
GD
const
v
t
GD
const
v
GD
const
v
v
const
v
t
const
v
const
v
t
t
t
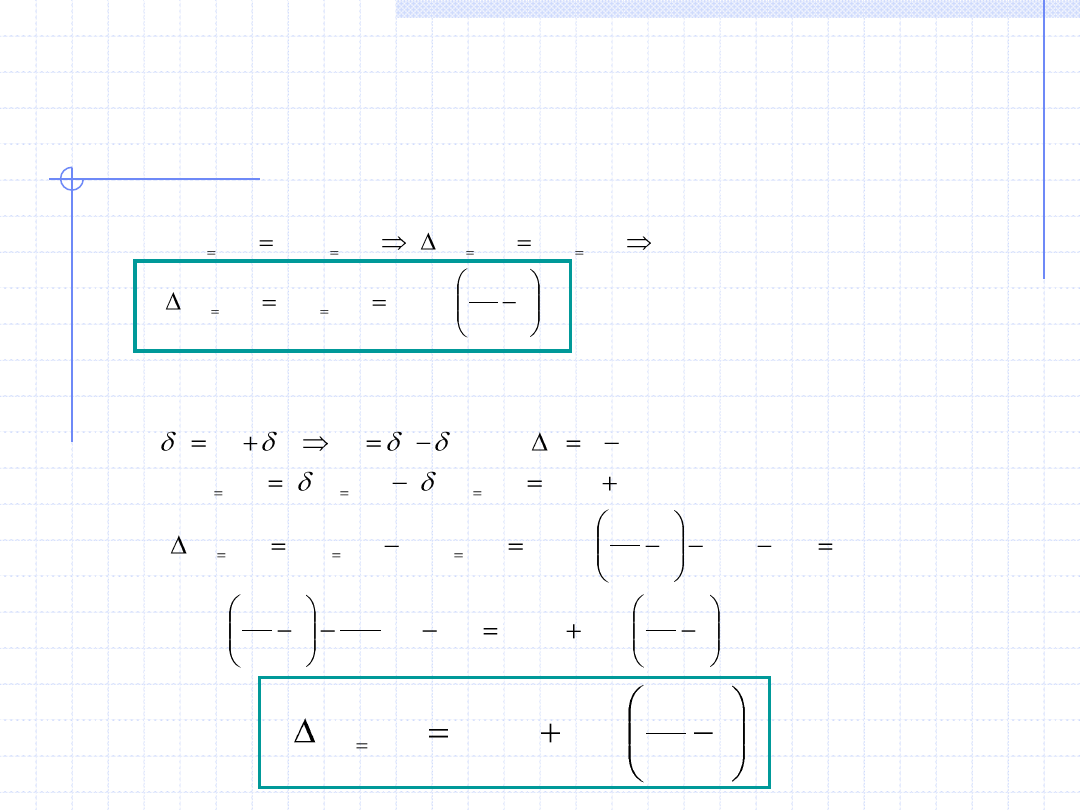
Na koniec określimy wzory określające przyrosty (zmiany) najważniejszych
funkcji stanu w przemianie izochorycznej gazów doskonałych.
a) Energia wewnętrzna – u.
Na podstawie I zasady termodynamiki mamy:
b) Entalpia – h.
Na podstawie I zasady termodynamiki mamy:
1
)
(
)
(
1
2
1
)
(
)
(
.
p
p
T
R
c
h
GD
v
GD
const
v
Przemiana izochoryczna cd.
1
2
)
(
)
(
)
(
.
.
.
.
ln
)
(
)
(
)
(
)
(
)
(
2
1
2
1
T
T
c
dT
T
c
s
dT
T
T
c
s
T
dT
c
T
q
ds
GD
v
T
T
GD
v
GD
const
v
T
T
v
const
v
v
const
v
const
v
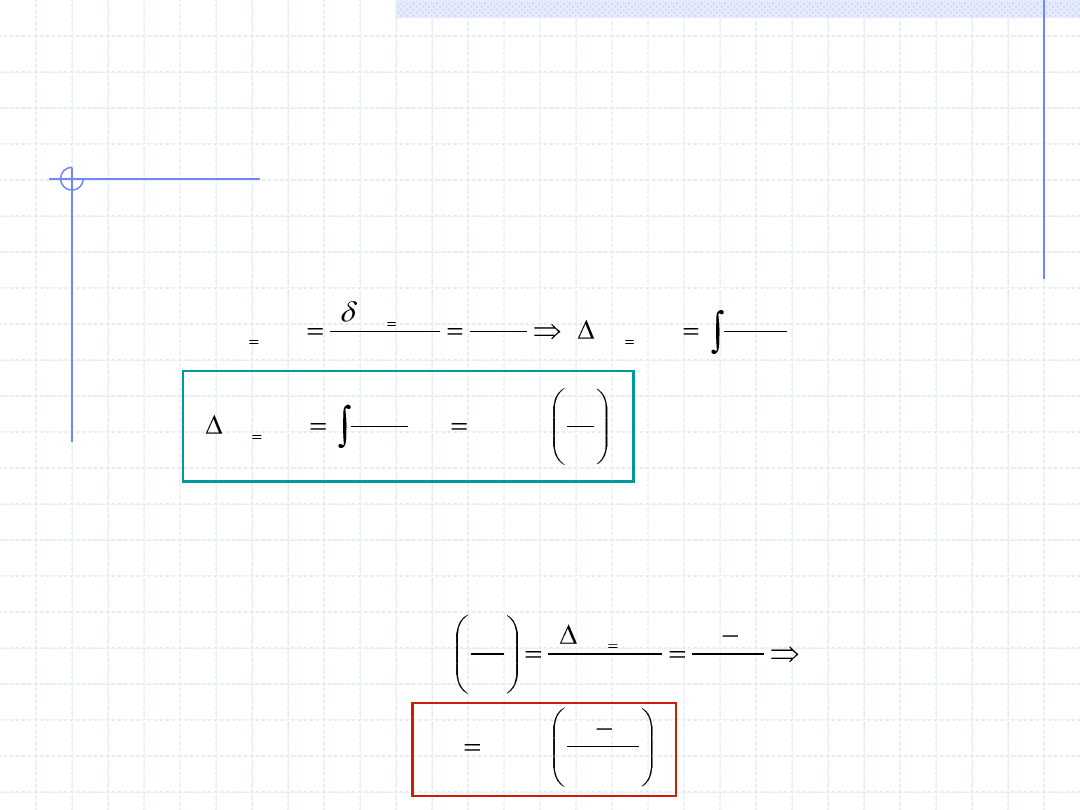
c) Entropia – s.
Przy założeniu, że nasza przemiana izochoryczna jest odwracalna
można napisać:
Wzór powyższy określający przyrost entropii w przemianie izochorycznej
gazu doskonałego można przekształcić otrzymując zależność temperatury
od entropii. Zależność taką można wykorzystać przy konstrukcji wykresu
przemiany w układzie T – s.
)
(
1
2
1
2
)
(
1
2
)
(
)
(
.
1
2
exp
)
(
ln
GD
v
GD
v
GD
v
GD
const
v
c
s
s
T
T
c
s
s
c
s
T
T
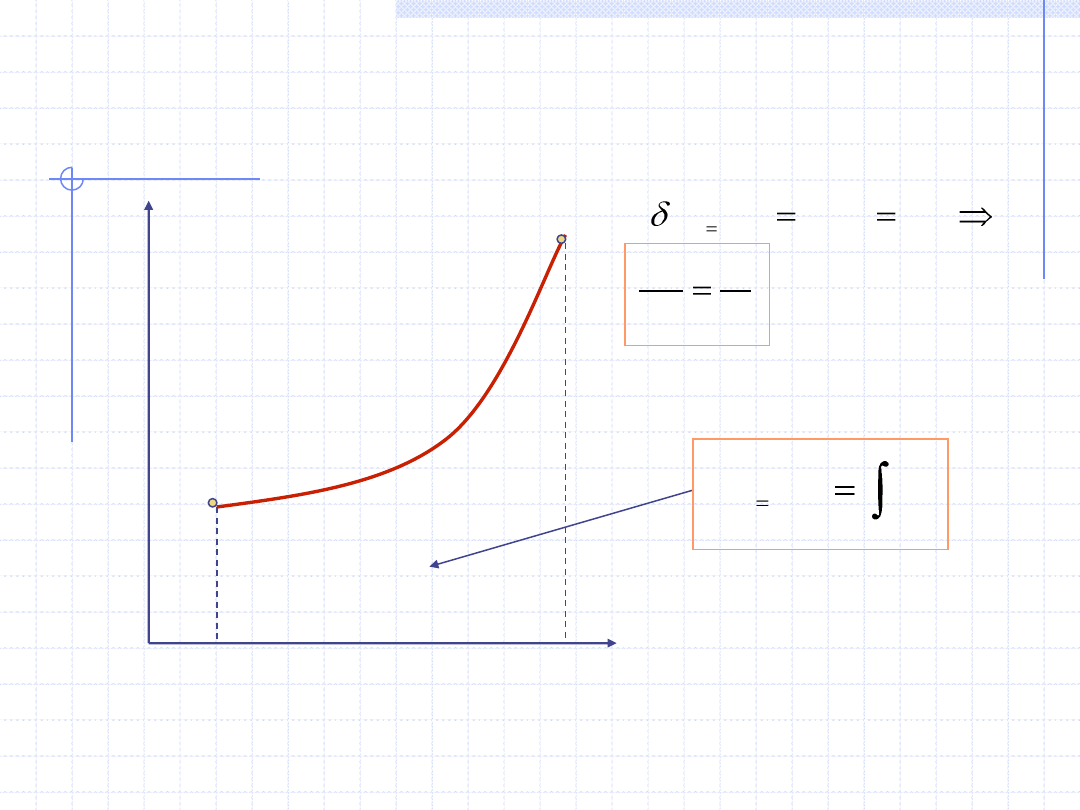
Przemiana izochoryczna cd.
2
1
.
)
(
s
s
const
v
Tds
q
T
s
1
2
s
1
s
2
v
v
const
v
c
T
ds
dT
Tds
dT
c
q
.
)
(
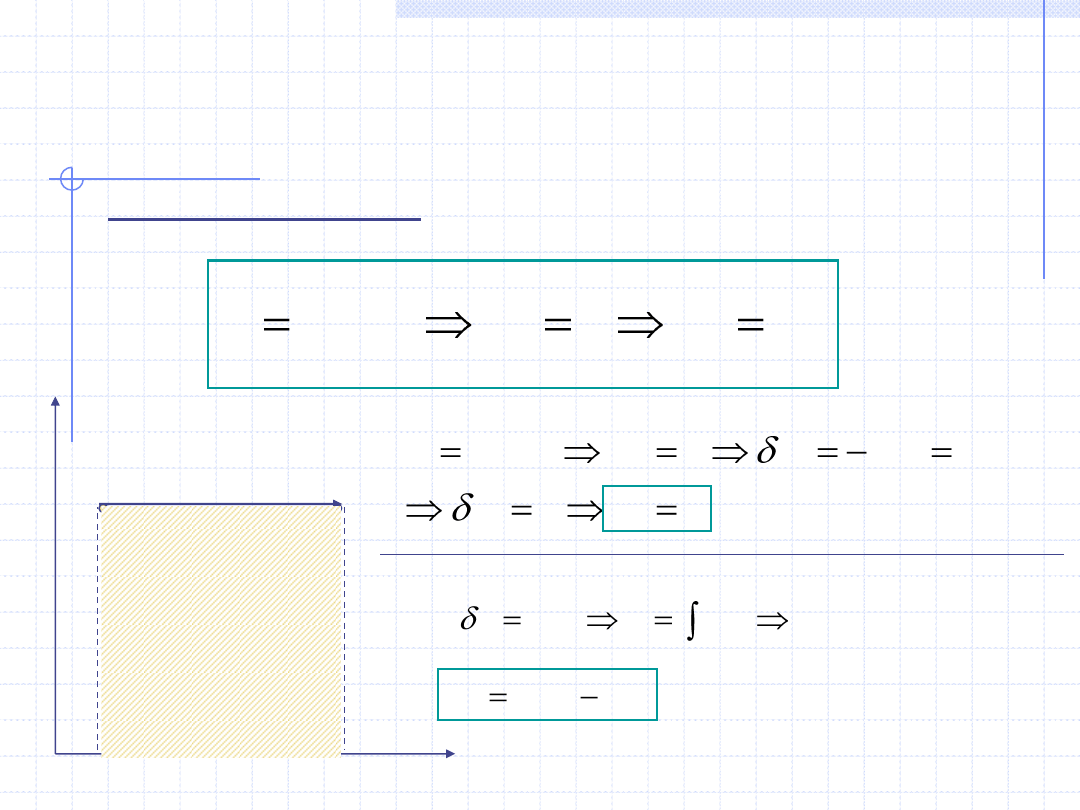
Przemiana izobaryczna
1
2
0
.
p
p
dp
const
p
0
0
0
0
.
t
t
t
w
w
vdp
w
dp
const
p
Przemiana izobaryczna odbywa się przy stałym ciśnieniu:
p
v
p=const.
v
1
,T
1
v
2
,T
2
Praca techniczna w przemianie izobarycznej jest równa 0.
)
(
1
2
2
1
v
v
p
w
pdv
w
pdv
w
v
v
Praca objętościowa przemiany
izobarycznej jest równa polu
zakreskowanego prostokąta.
w
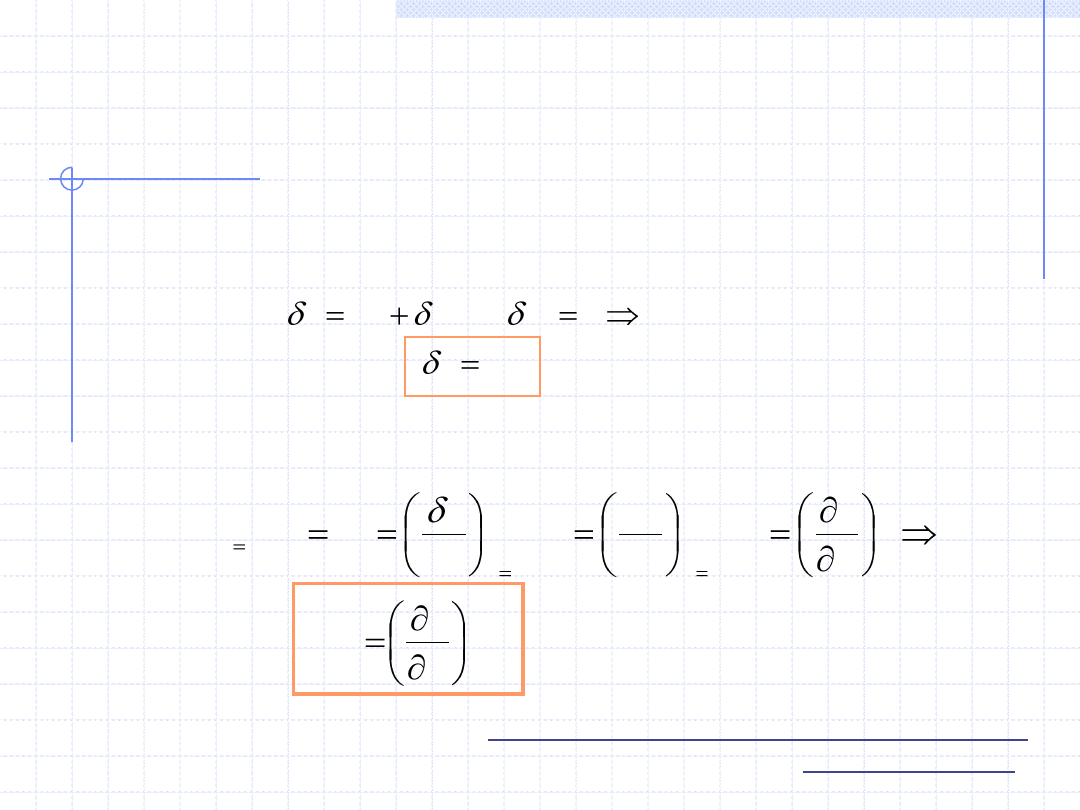
Przemiana izobaryczna cd.
dh
q
w
w
dh
q
t
t
0
Rozpatrzmy teraz pojemność cieplną układu podczas przemiany
izobarycznej. Na mocy I zasady termodynamiki dla różniczkowej
przemiany można napisać:
Przypomnijmy teraz definicję właściwej pojemności cieplnej dla
rozważanej przemiany:
v
p
p
const
p
const
p
p
const
p
T
h
c
T
h
dT
dh
dT
q
c
c
.
.
.
)
(
Wzór powyższy dowodzi, że pojemność cieplna w przemianie izobarycznej
jest pochodną funkcji stanu (entalpii) a zatem również jest funkcją stanu.
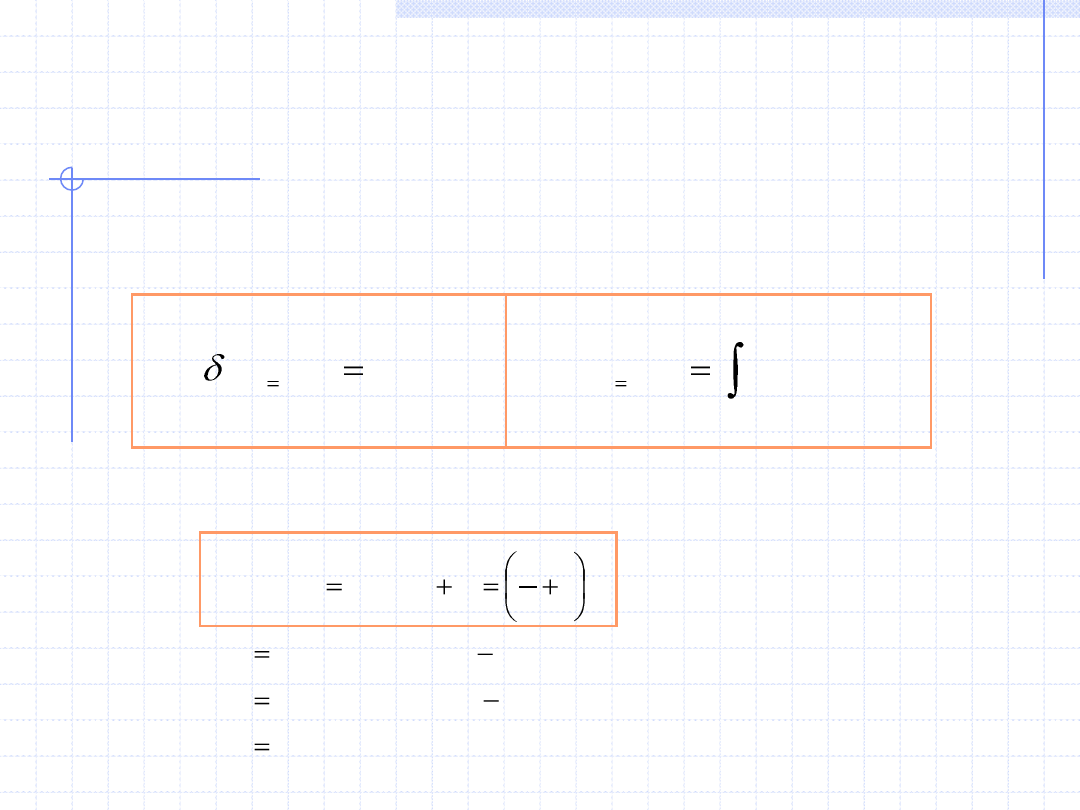
Przemiana izobaryczna cd.
2
1
)
(
)
(
)
(
.
.
T
T
p
const
p
p
const
p
dT
T
c
q
dT
c
q
Wielkość c
p
zależy od temperatury, ciśnienia i rodzaju ośrodka. Zależność
od temperatury pozwala na wyznaczenie ciepła przemiany izobarycznej:
Dla gazów doskonałych, z teorii kinetycznej wynika że wielkość c
p
powinna
być stała i równa:
wych
wieloatomo
gazów
dla
k
atomowych
gazów
dla
k
atomowych
gazów
dla
k
gdzie
R
k
R
c
c
GD
v
GD
p
6
2
5
1
3
:
1
2
)
(
)
(
)
(
)
(
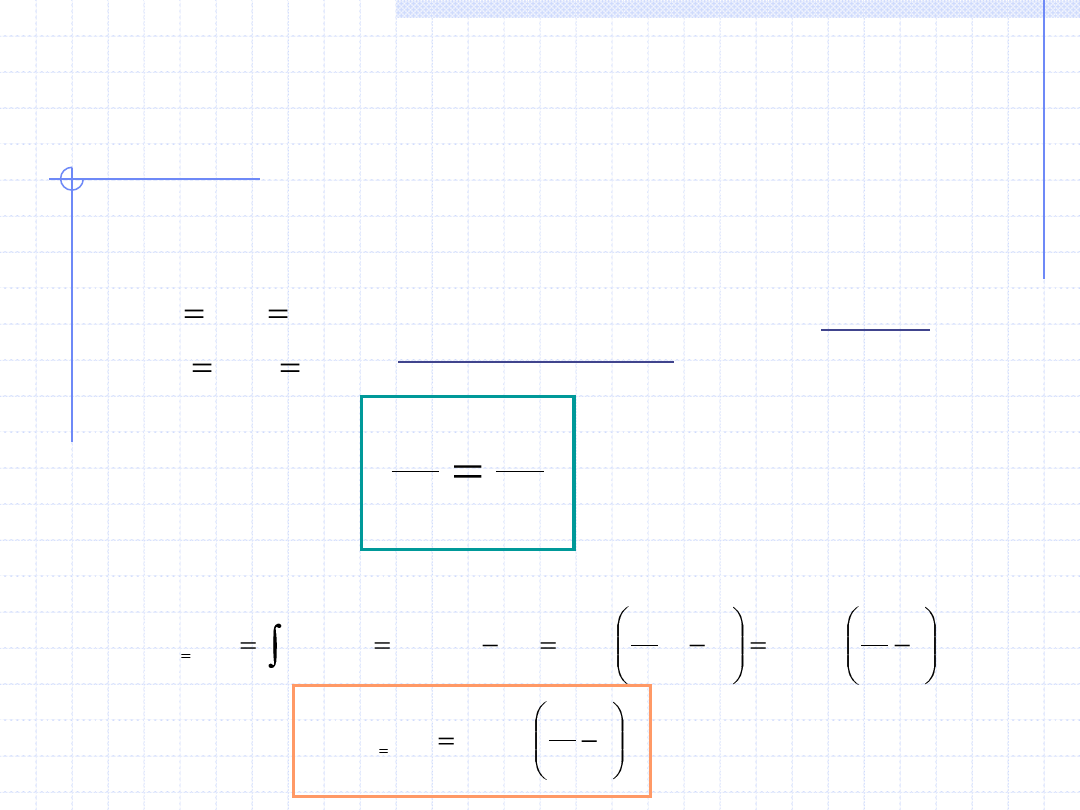
Przemiana izobaryczna cd.
2
2
2
2
1
1
1
1
RT
pv
v
p
RT
pv
v
p
1
)
(
1
)
(
)
(
1
2
1
)
(
)
(
.
1
2
1
)
(
1
1
1
2
)
(
1
2
)
(
)
(
)
(
.
2
1
v
v
T
c
q
v
v
T
c
T
T
v
v
c
T
T
c
dT
c
q
GD
p
GD
const
p
GD
p
GD
p
GD
p
T
T
GD
p
GD
const
p
Rozpatrzmy jeszcze dokładniej przemianę izobaryczną gazów doskonałych.
W każdy punkcie takiej przemiany musi być spełnione równanie stanu gazu
doskonałego. Dla punku początkowego i końcowego mamy:
Dzieląc stronami otrzymujemy tzw. równanie
przemiany izobarycznej uzależniające objętość
i temperaturę w skrajnych punktach przemiany:
Dla gazów doskonałych również wzór określający ciepło ma prostą postać:
1
2
1
2
T
T
v
v
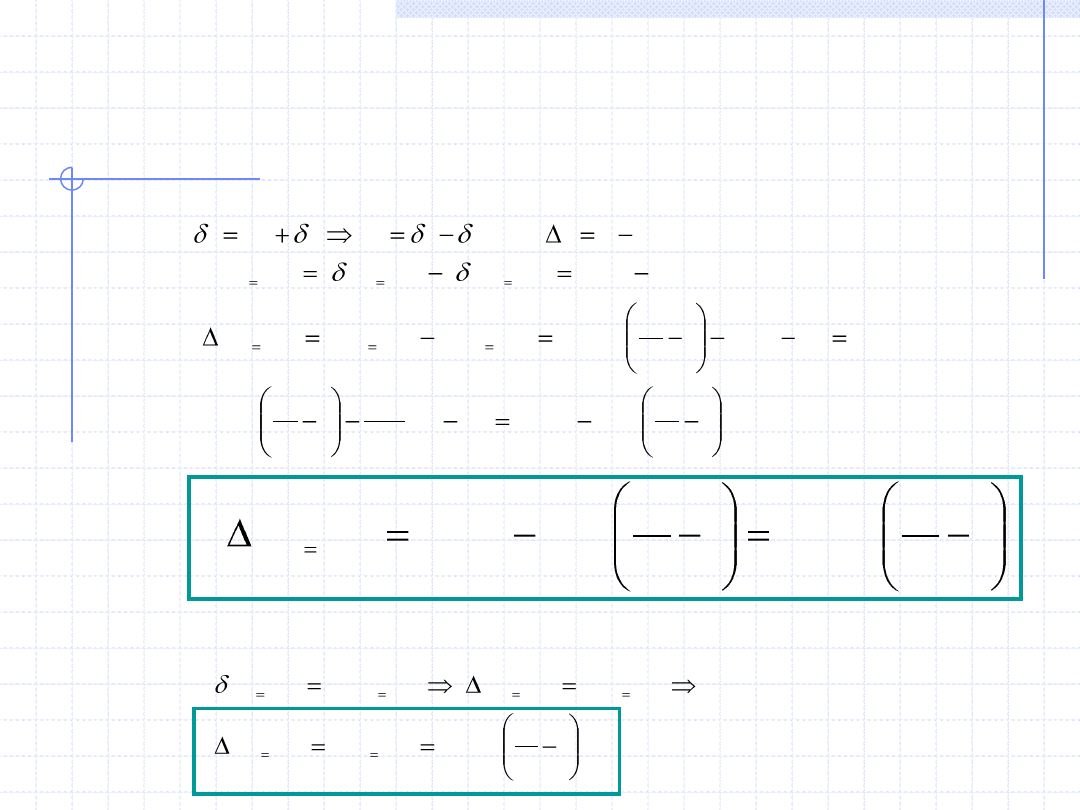
Przemiana izobaryczna cd.
1
)
(
)
(
)
(
)
(
)
(
)
(
1
2
1
)
(
)
(
.
)
(
.
.
.
.
.
v
v
T
c
q
h
q
h
dh
q
GD
p
GD
const
p
GD
const
p
const
p
const
p
const
p
const
p
1
)
(
)
(
1
)
(
1
)
(
)
(
)
(
)
(
)
(
)
(
1
2
1
)
(
1
2
1
1
1
2
1
)
(
1
2
1
2
1
)
(
)
(
.
)
(
.
)
(
.
.
.
.
v
v
T
R
c
v
v
v
RT
v
v
T
c
v
v
p
v
v
T
c
w
q
u
pdv
dT
c
w
q
du
w
q
u
w
q
du
w
du
q
GD
p
GD
p
GD
p
GD
const
p
GD
const
p
GD
const
p
p
const
p
const
p
const
p
Na koniec określimy wzory określające przyrosty (zmiany) najważniejszych
funkcji stanu w przemianie izobarycznej gazów doskonałych.
a) Energia wewnętrzna – u.
Na podstawie I zasady termodynamiki mamy:
b) Entalpia – h.
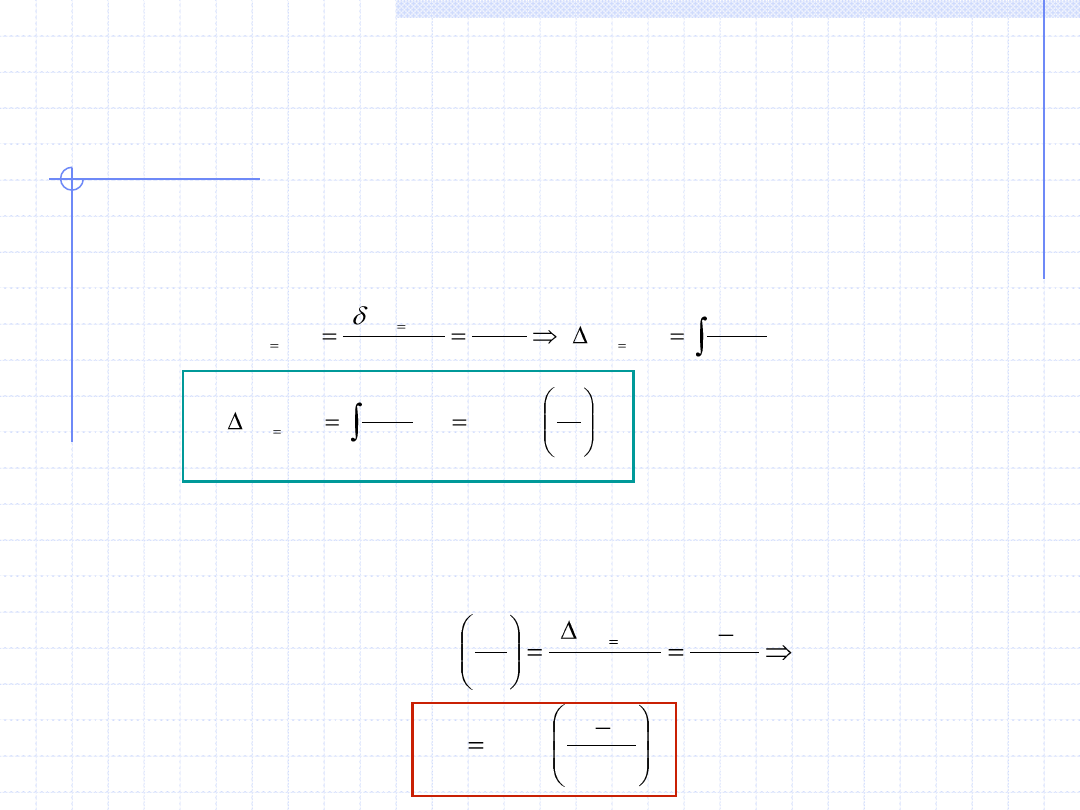
Na podstawie I zasady termodynamiki mamy:
1
1
)
(
)
(
1
2
1
)
(
1
2
1
)
(
)
(
.
v
v
T
c
v
v
T
R
c
u
GD
v
GD
p
GD
const
p
Przemiana izobaryczna cd.
1
2
)
(
)
(
)
(
.
.
.
.
ln
)
(
)
(
)
(
)
(
)
(
2
1
2
1
T
T
c
dT
T
c
s
dT
T
T
c
s
T
dT
c
T
q
ds
GD
p
T
T
GD
p
GD
const
p
T
T
p
const
p
p
const
p
const
p
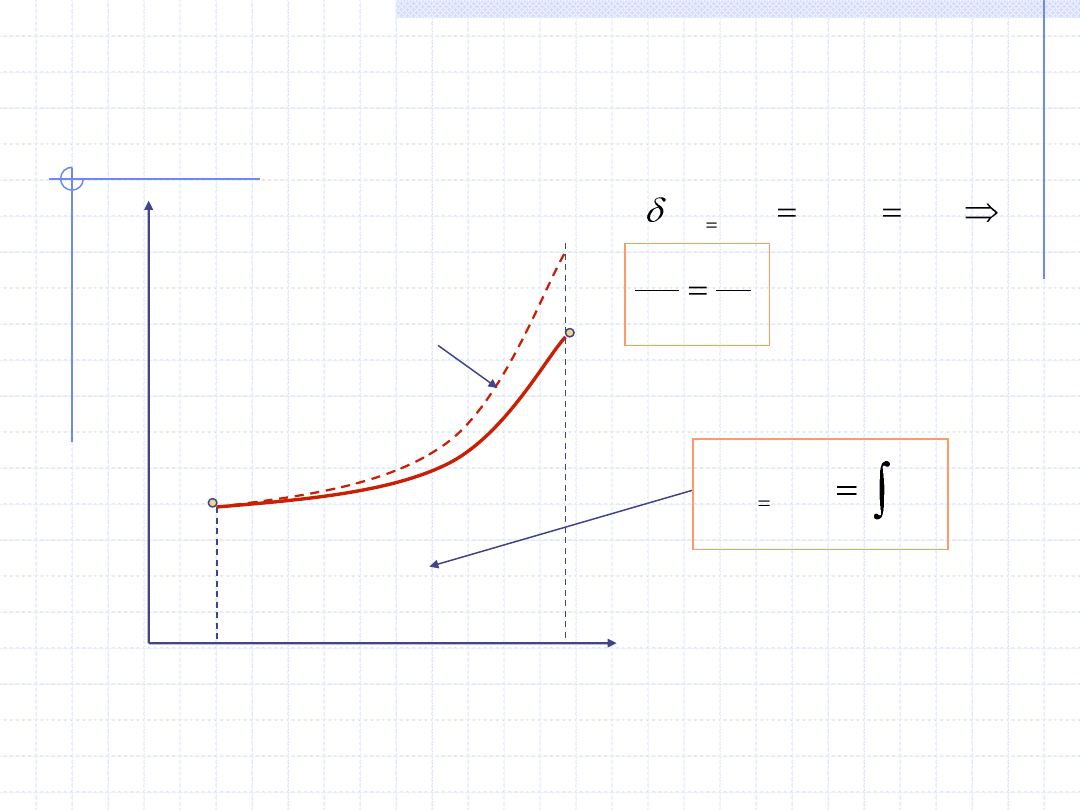
c) Entropia – s.
Przy założeniu, że nasza przemiana izobaryczna jest odwracalna
można napisać:
Wzór powyższy określający przyrost entropii w przemianie izobarycznej
gazu doskonałego można przekształcić otrzymując zależność temperatury
od entropii. Zależność taką można wykorzystać przy konstrukcji wykresu
przemiany w układzie T – s.
)
(
1
2
1
2
)
(
1
2
)
(
)
(
.
1
2
exp
)
(
ln
GD
p
GD
p
GD
p
GD
const
p
c
s
s
T
T
c
s
s
c
s
T
T
2
1
.
)
(
s
s
const
p
Tds
q
T
s
1
2
s
1
s
2
p
p
const
p
c
T
ds
dT
Tds
dT
c
q
.
)
(
v=const.
Przemiana izobaryczna cd.
Ale c
p
>c
v

28
To na dzisiaj tyle.
Dziękuję bardzo Państwu za uwagę.
Wyszukiwarka
Podobne podstrony:
Ogolnotech dla Bio Ir WYKLAD IX
Ogolnotech(dla Bio Ir) WYKLAD X
Ogolnotech(dla Bio Ir) WYKLAD XI
Ogolnotech dla Bio I WYKLAD IV
Ogolnotech dla Bio I WYKLAD IV
Ogolnotech dla Bio WYKLAD VI
Ogolnotech(dla Bio I) WYKLAD I
Ogolnotech(dla Bio I) WYKLAD V
Ogolnotech dla Bio I WYKLAD III
Ogolnotech(dla Bio I) WYKLAD IX
Ogolnotech(dla Bio I) W VI
Ogolnotech(dla Bio I) W X
Ogolnotech(dla Bio I) W VI
więcej podobnych podstron