1
OGÓLNOTECHNICZNE
PODSTAWY BIOTECHNOLOGII
Z GRAFIKĄ INŻYNIERSKĄ
Wykład III
Podstawowe prawa fizyki stosowane w technice
Definicje podstawowych pojęć inżynieryjno -
technicznych

2
Podstawowe prawa fizyczne mające
zastosowanie w technice
Nauki techniczne opierają się przede wszystkim na fizyce.
Państwo powinni znać fizykę na poziomie szkoły średniej. Teraz
chciałbym przypomnieć pewne podstawowe prawa fizyki, które
odgrywają szczególną rolę w naukach technicznych. Będą to:
- prawo (zasada) zachowania masy,
- prawo (zasada) zachowania energii,
- prawa (zasady) dynamiki Newtona,
- prawa gazu doskonałego.
3
Podstawowe prawa fizyczne mające
zastosowanie w technice
1.
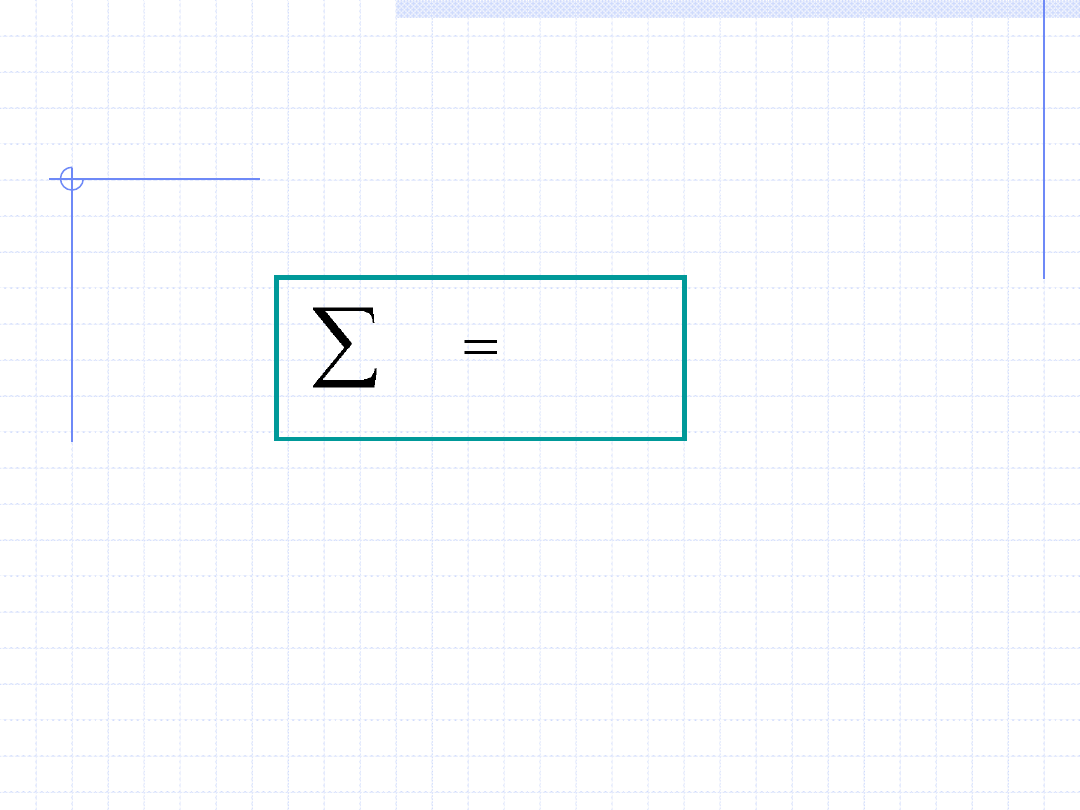
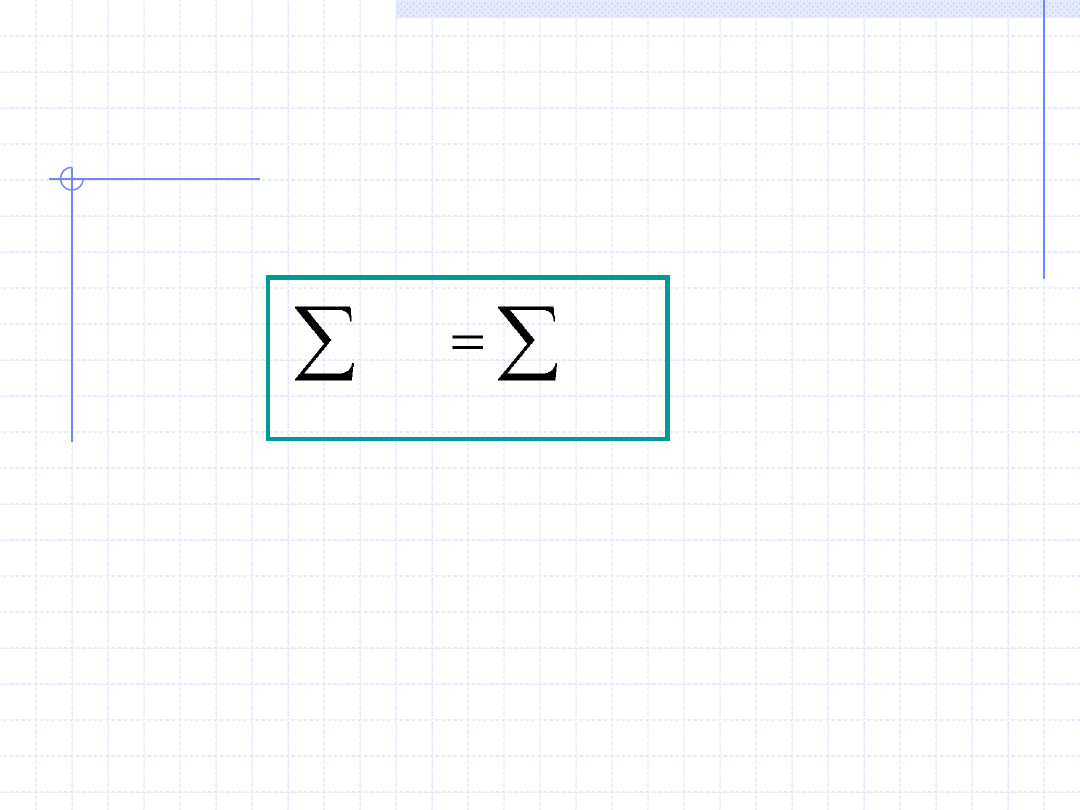
Prawo (zasada) zachowania masy:
Sumaryczna masa ciał biorących udział
w dowolnych procesach jest stała i nie
ulega zmianie.
Zasada zachowania masy została sformułowana w czasach nowożytnych
przez Lavoisiera w roku 1789 i następnie potwierdzona dla wszelkich
procesów fizycznych i chemicznych. Jedynymi wyjątkami, dla których
zasada zachowania masy nie obowiązuje są przemiany i procesy
jądrowe. Dla tychże procesów jednak obowiązuje prawo znacznie
ogólniejsze tzw. zasada zachowania materii, w której uwzględnia
się utożsamienie energii z masą zgodnie ze słynnym wzorem Einsteina.
4
Prawo zachowania masy
Matematycznie zasadę zachowania masy można zapisać za pomocą
równania:
const
m
i
i
Zasada zachowania masy jest podstawą bardzo ważnego etapu
matematycznego opisu różnego rodzaju procesów fizycznych i chemicznych
nazywanego bilansowaniem masowym (materiałowym).
5
Podstawowe prawa fizyczne mające
zastosowanie w technice – bilans masy
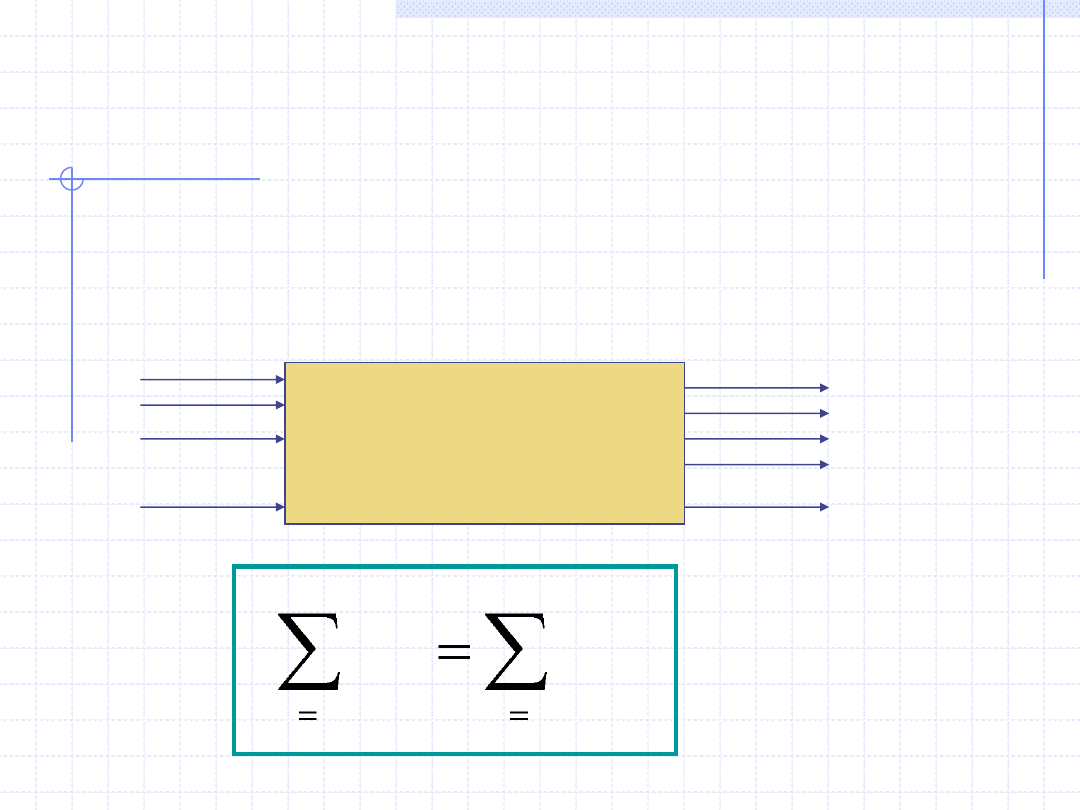
Dla procesów nieustalonych bilans masowy możemy sformułować
w następującej postaci:
i
j
jk
ip
m
m
p – oznacza początek procesu
k – oznacza koniec procesu
Zwróćmy uwagę, że sumowanie na początku odbywa się po „i”
a na końcu po „j”. Oznacza to, ze w trakcie procesu zarówno
biorące w nim udział ciała jak i substancje mogą się zmieniać.
6
Podstawowe prawa fizyczne mające
zastosowanie w technice – bilans masy
n
j
p
k
i
s
j
i
m
m
1
1
3
2
1
s
s
s
k
s
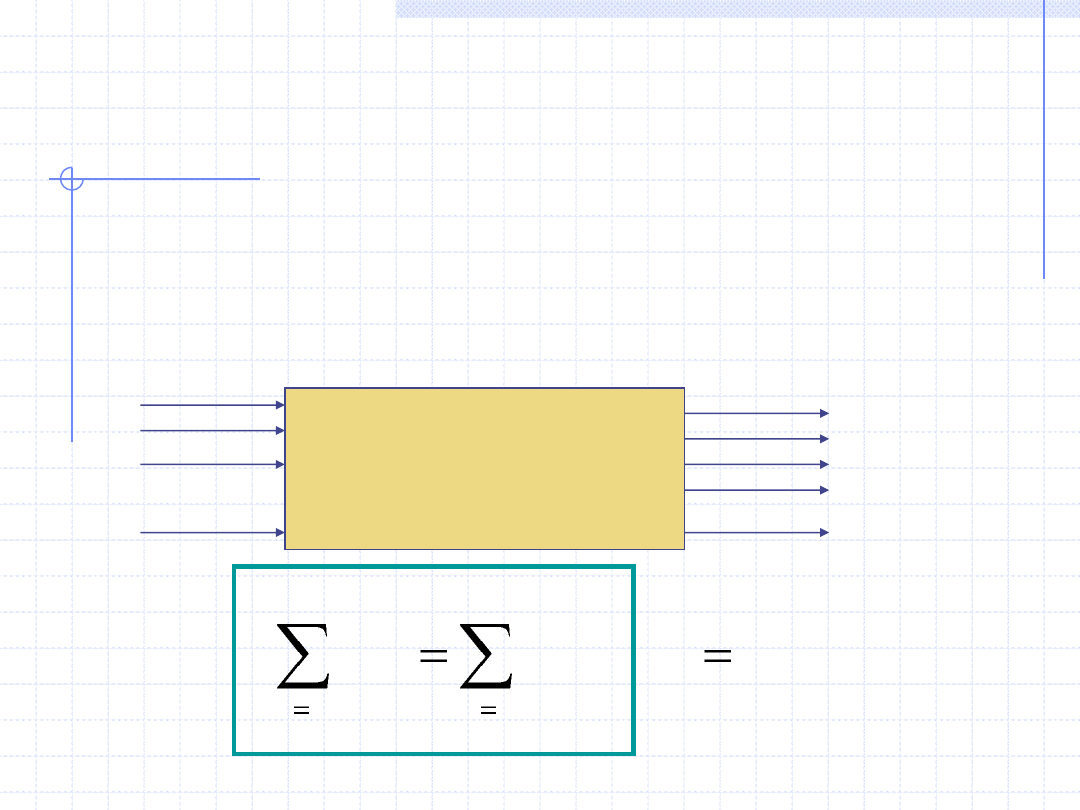
Dla procesów ustalonych bilans masowy dotyczy zazwyczaj pewnej
przestrzeni, w której odbywa się dany proces. W przestrzeni tej
określa się szereg strumieni wlotowych (substratów) i wylotowych
(produktów).
Proces
n
p
p
p
p
p
4
3
2
1
7
Podstawowe prawa fizyczne mające
zastosowanie w technice – bilans masy
N
r
n
n
n
j
r
pj
k
i
r
si
,...,
2
,
1
1
)
(
1
)
(
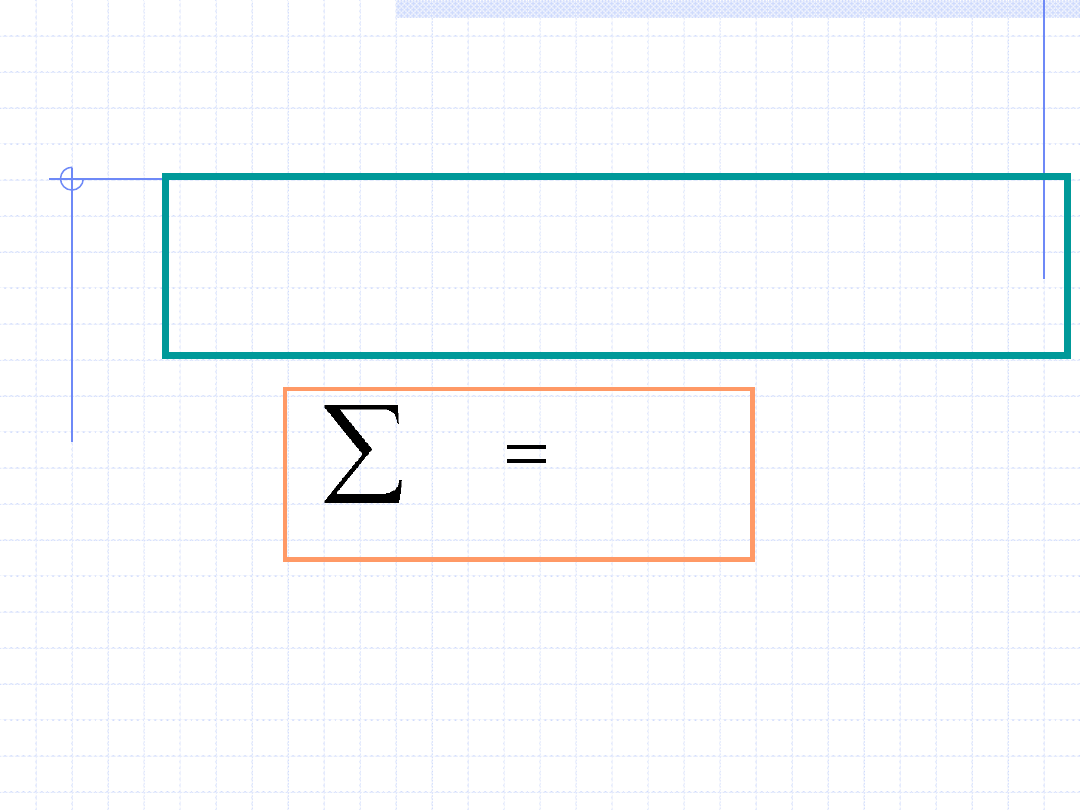
W przypadku procesów, w których nie zachodzą reakcje chemiczne
prawo zachowania masy implikuje zasadę zachowania liczności
dla wszystkich związków chemicznych (składników) biorących udział
w danym procesie. W taki przypadku bilans masowy przechodzi
w bilans molowy. Dla procesów ustalonych bilans można opisać:
3
2
1
s
s
s
k
s
Proces
n
p
p
p
p
p
4
3
2
1
8
2.
Prawo (zasada) zachowania energii:
Sumaryczna energia wszystkich ciał
biorących udział w dowolnych procesach
jest stała i nie ulega zmianie.
const
E
i
i
Zasada zachowania energii wynika bezpośrednio z II zasady dynamiki
Newtona. W głębszym i bardziej ogólnym sensie jest ona konsekwencją
„gładkości” czyli symetrii czasu. Osobom pragnącym pogłębić wiedzę
o podstawach nauki chciałbym polecić książkę wybitnego fizykochemika
Petera Atkinsa:
Palec Galileusza – Dziesięć wielkich idei nauki.
DW Rebis, Poznań 2005.

9
Podstawowe prawa fizyczne mające
zastosowanie w technice cd.
3.
Prawa dynamiki Newtona:
I) Ciała pozostają w spoczynku lub poruszają się ruchem
jednostajnym prostoliniowym wtedy i tylko wtedy gdy na
te ciała nie działają żadne siły lub gdy działające siły
wzajemnie się równoważą.
II) Jeżeli na ciało działa stała siła to ciało to porusza się
ruchem jednostajnie przyśpieszonym lub opóźnionym.
III) Każdemu działaniu towarzyszy równe mu ale
przeciwnie skierowane przeciwdziałanie.
10
Drugie prawo dynamiki Newtona:
a
m
dt
w
d
m
dt
w
m
d
F
)
(

11
Prawa gazowe
Definicja:
Gazem doskonałym nazywamy ośrodek, którego cząsteczki
posiadają zerową objętość i nie oddziaływują ze sobą.
4. Prawa gazów doskonałych:
a
) Prawo Boyle’a-Mariotta: Jeżeli temperatura gazu jest stała to iloczyn jego
ciśnienia i objętości jest wartością stałą.
b) Prawo Gay-Lussaca: Jeżeli ciśnienie gazu jest stałe, to objętość gazu jest
wprost proporcjonalna do jego temperatury absolutnej.
c) Prawo Charlesa: Jeżeli objętość gazu jest stała, to jego ciśnienie jest
wprost proporcjonalne do temperatury absolutnej.
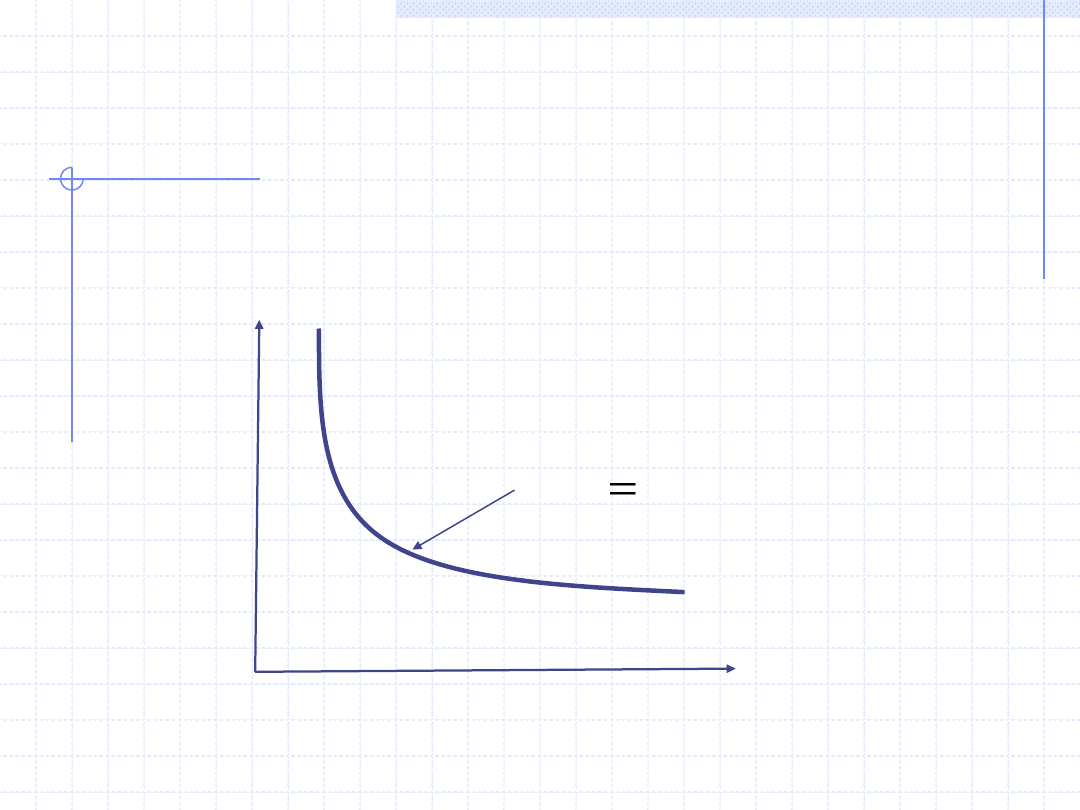
12
Graficzna ilustracja praw
gazowych
.
const
pV
p
V
T=const.
Prawo Boyle’a - Mariotta
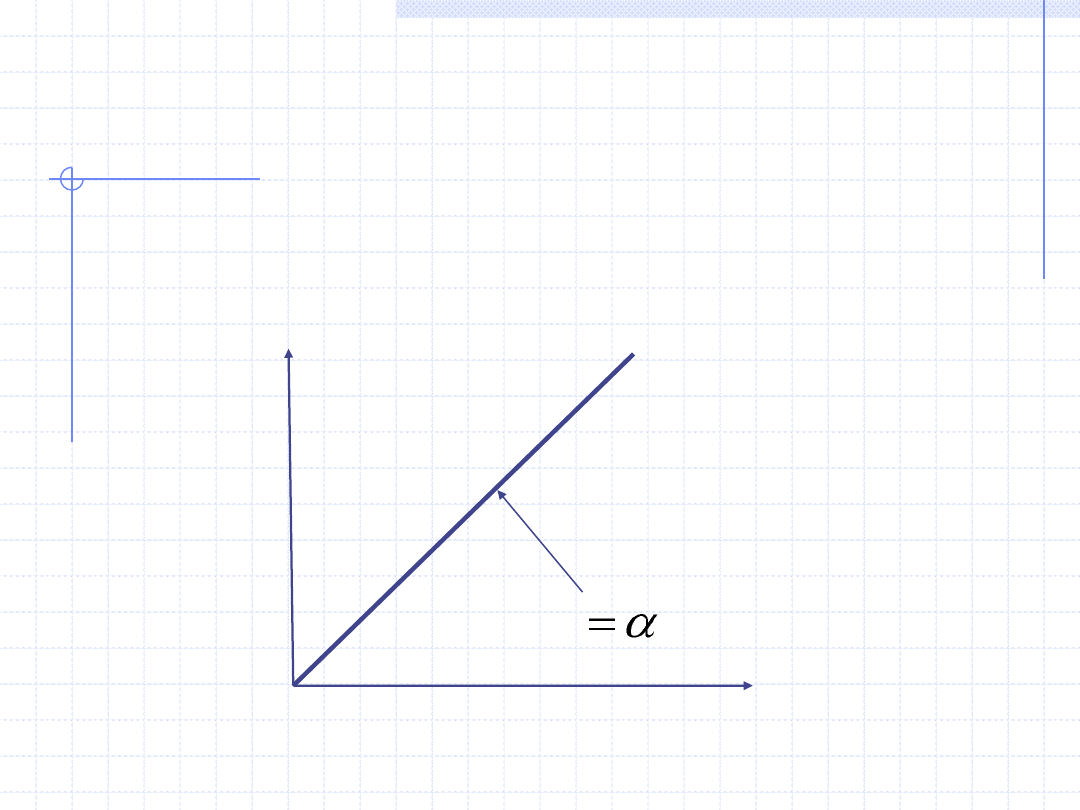
13
Graficzna ilustracja praw
gazowych
T
V
V
T
p=const.
Gay – Lussaca
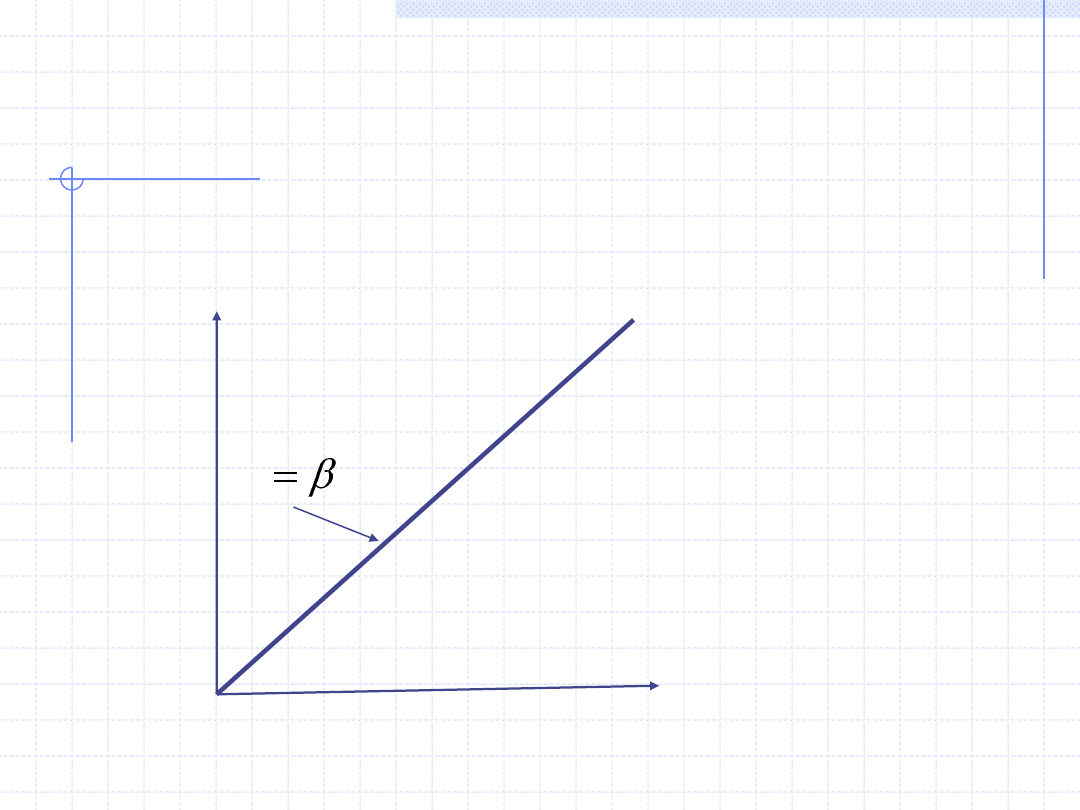
14
Graficzna ilustracja praw
gazowych
p
T
T
p
V=const.
Prawo Charlesa
15
Równanie stanu gazu
doskonałego
nRT
pV
p – ciśnienie [Pa]
V – objętość [m
3
]
n – liczność [kmol]
T – temperatura [K]
R=8314.47 J/(kmol
.
K) – uniwersalna stała gazowa
16
Ogólne definicje pojęć inżynieryjno-
technologicznych
Proces technologiczny jest to zespół zjawisk i działań
mających na celu uzyskanie jednego lub kilku produktów
z naturalnych lub częściowo przetworzonych surowców.
Proces technologiczny jest realizowany w jednej lub kilku
instalacjach.
Instalacja jest to zespół silników, maszyn i
aparatów współpracujących razem, przy pomocy
których jest realizowany dany proces technologiczny lub
jego część.

17
Podstawowe pojęcia techniczne
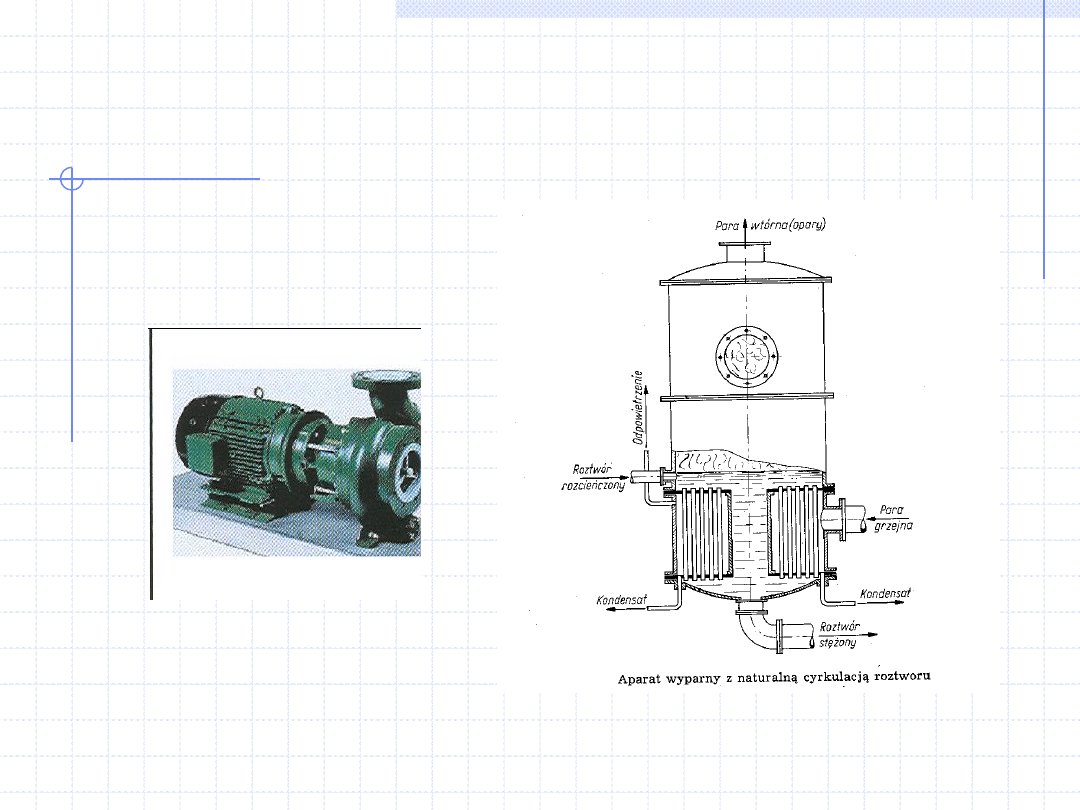
Silnikiem nazywamy urządzenie służące do zamiany
różnych rodzajów energii na pracę.
Maszyna jest to urządzenie do wykonywania ściśle
określonej pracy. Np. maszyną jest tokarka, pompa,
sprężarka itd. Maszyny na ogół posiadają elementy
ruchome.
Aparat jest to urządzenie, w którym przeprowadza
się przemianę własności fizycznych lub chemicznych
różnych substancji. Aparatami są reaktory chemiczne,
wymienniki ciepła, kolumny destylacyjne itd.
18
Podstawowe pojęcia (przykłady)
Silnik + maszyna (pompa)

19
Proces jednostkowy
Procesem jednostkowym nazywamy część procesu
technologicznego, w którym dominuje jedno
zjawisko fizykochemiczne. Proces jednostkowy
zazwyczaj zachodzi w jednym aparacie.

20
Klasyfikacja procesów jednostkowych
W zależności od rodzaju dominującego zjawiska
fizykochemicznego, procesy jednostkowe dzielimy na:
-mechaniczne (dynamiczne) takie jak np.: transport,magazynowanie,
rozdrabnianie, sortowanie, flotacja, sedymentacja, mieszanie, filtracja,
wirowanie,odpylanie itp.
-cieplne takie jak np.: ogrzewanie, chłodzenie, skraplanie, odparowywanie,
zatężanie itp.
-dyfuzyjne takie jak np.: destylacja, rektyfikacja, absorpcja, adsorpcja,
ekstrakcja, ługowanie, suszenie, nawilżanie, krystalizacja itp.
-reaktorowe (z reakcją chemiczną) takie jak np. utlenianie, estryfikacja,
sulfonowanie itp.
21
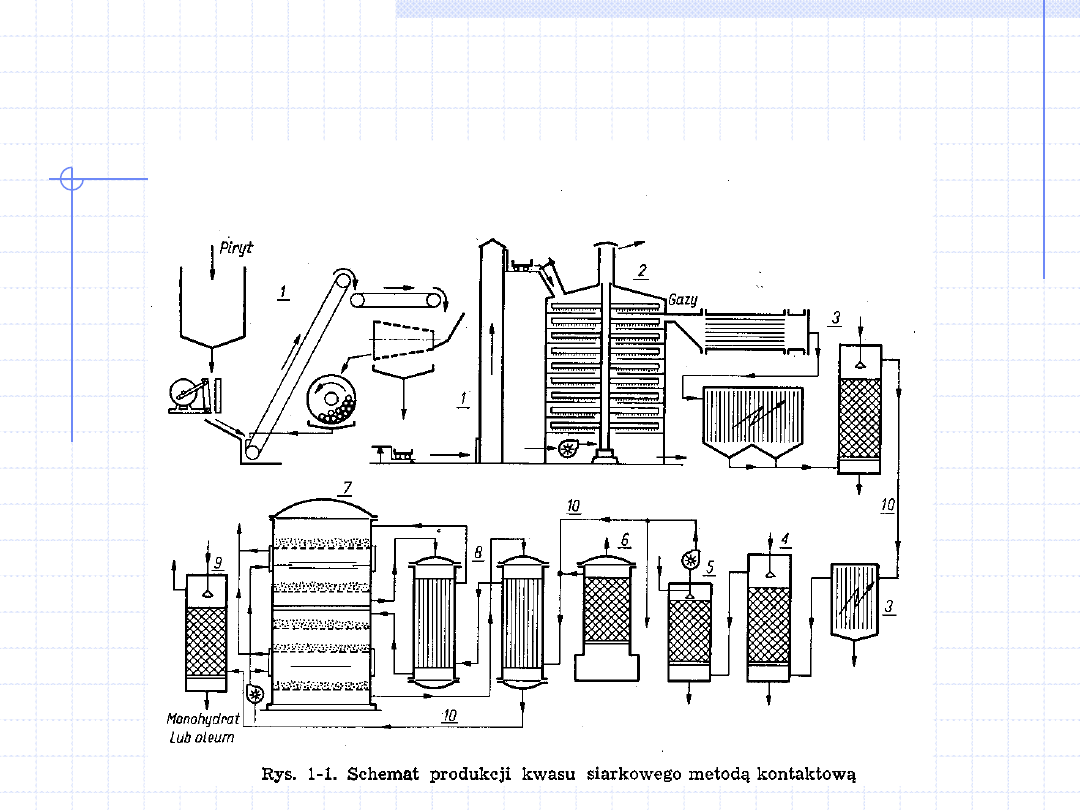
Przykładowe procesy jednostkowe występujące podczas
produkcji kwasu siarkowego

22
8. Przykładowe procesy jednostkowe występujące podczas
produkcji kwasu siarkowego
1.
Rozdrabnianie pirytu i jego transport do pieca
2.
Spalanie pirytu w piecu prażalniczym
4FeS+11O
2
=2Fe
2
O
3
+8SO
2
3.
Wstępne chłodzenie i odpylanie gazów prażalniczych
4.
Przemywanie gazów w kolumnach wypełnionych
5.
Suszenie gazów za pomocą stężonego kwasu siarkowego
6.
Usuwanie mgły kwasu siarkowego
7.
Utlenianie dwutlenku siarki do trójtlenku w piecu kontaktowym
2SO
2
+O
2
=2SO
3
8.
Wymiana ciepła między gazem wpływającym a odpływającym z pieca
9.
Absorpcja trójtlenku siarki w rozcieńczonym kwasie siarkowym
SO
3
+H
2
O=H
2
SO
4
10. Przepływ gazu i cieczy.
Wyszukiwarka
Podobne podstrony:
Ogolnotech dla Bio I WYKLAD IV
Ogolnotech dla Bio WYKLAD VI
Ogolnotech(dla Bio I) WYKLAD I
Ogolnotech(dla Bio I) WYKLAD V
Ogolnotech(dla Bio I) WYKLAD IX
Ogolnotech dla Bio I WYKLAD IV
Ogolnotech dla Bio Ir WYKLAD IX
Ogolnotech(dla Bio Ir) WYKLAD X
Ogolnotech(dla Bio Ir) WYKLAD XI
Ogolnotech dla Bio IV WYKLAD VII
Ogolnotech(dla Bio I) W VI
Ogolnotech(dla Bio I) W X
więcej podobnych podstron