

Psychrofile
W najszerszym rozumieniu są to organizmy, które żyją w
zimnych środowiskach.
Są to organizmy, które optymalny wzrost wykazują w
temperaturze niższej niż 15
C i nie rosną w temperaturze
powyżej 20
C. Są zdolne do wzrostu w temperaturze 0
C
lub niższej. Niektóre są w stanie przetrwad nawet w -60
C.
Termin ten stosuje się przede wszystkim w odniesieniu do
mikroorganizmów, jednak wielu autorów do organizmów
psychrofilnych zalicza poza prokariotami i drożdżami
także niektóre algi, owady, ryby oraz rośliny pod
warunkiem, że są one stale pod wpływem niskiej
temperatury (poniżej 5
C).

Psychrofile, psychrotrofy czy
psychrotoleranty?
W przypadku mikroorganizmów zachodzi potrzeba
rozróżnienia tych, które są w stanie żyd w niskich
temperaturach (mimo wysokiego optimum) od
prawdziwych psychrofili. I tak:
Psychrofile (psychrofile obligatoryjne) – optimum wzrostu
<15
C, maksimum 20
C,
Psychrotrofy (psychrofile fakultatywne) – mogą żyd w
temperaturze ponad 20
C, ale jednocześnie są zdolne do
podziałów w temperaturze bliskiej 0
C, preferują
środowiska zimne, jednak mają szeroki zakres tolerancji
Psychrotoleranty – mezofile, które mogą przystosowad się
do niskich temperatur

Środowisko życia
Psychrofile występują w wiecznie
zimnych środowiskach takich jak:
wody słodkie i morskie, lodowce i lód
morski, śniegi, polarne i
wysokogórskie gleby, zimne pustynie
oraz wieczne zmarzliny. Dominują tam
one liczebnie i funkcjonalnie.
W środowiskach nie permanentnie
zimnych mogą dominowad pod
warunkiem, że dostarczona jest
dostateczna ilośd materii organicznej,
co pozwoli im na szybką reprodukcję w
krótkim czasie.

Lód:
Lód wiecznej zmarzliny, lodowce,
lód morski i jeziorny, śnieg
Mikroorganizmy mogą w nim żyd
dzięki temu, że między
kryształkami lodu znajdują się
przestrzenie z wodą w stanie
płynnym. Dzieje się tak pod
warunkiem, że temperatura nie
jest zbyt niska (powyżej -5
C dla
lodowców, powyżej -35
C dla lodu
morskiego, różnica wynika z faktu
zasolenia).

W kanalikach lodu występują:
Cyanobacteria i niektóre glony
(odpowiedzialne za produkcję
materii organicznej)
bakterie heterotroficzne z
rodzajów: Octadecabacter,
Alteromonas, Colwellia,
Glaciecola, Pseudoalteromonas,
Shewanella, Cytophaga,
Flavobacterium, Gelidibacter,
Polaribacter.

Wieczna zmarzlina (permafrost):
Obejmuje 26% powierzchni gleb od 0,5m do ponad 1450m
w głąb
Są to gleby, których temperatura przez cały czas jest poniżej
0
C.
Występują w niej psychrofile takie jak: Psychrobacter fozii,
Psychrobacter maritimus, Deinococcus radiomollis, D.
claudionis, D. altitudinis, D. alpinitundrae.

Głębiny oceanów:
Wody poniżej 1000m pokrywają 60% powierzchni Ziemi.
Są to środowiska skrajne, temperatura wynosi 2-4
C, a
ciśnienie dochodzi do 110MPa, woda jest słona, panuje
ciemnośd, a substancje pokarmowe występują w skrajnie
niskich stężeniu.
W warunkach takich występują psychrofile z rodzajów:
Colwellia, Moritella, Photobacterium, Psychromonas,
Shewanella.

Szczególne adaptacje psychrofili
do środowiska
Psychrofile osiągnęły fizjologiczny i ekologiczny sukces w
zimnych środowiskach przede wszystkim dzięki unikalnym
cechom ich białek i błon.
Adaptacje do zimna składają się z wielu przystosowao na
poziomach:
biochemicznym (kinetyka enzymów, synteza
wyspecjalizowanych cząsteczek)
ponadcząsteczkowym i subkomórkowym (regulacja
płynności błon komórkowych, kanały jonowe)
fizjologicznym (szlaki metaboliczne, sezonowe obniżenie
czynności życiowych)

Największym problemem, z
którym muszą się zmierzyd
organizmy żyjące w ekstremalnie
zimnych środowiskach jest
zamarzanie wody
wewnątrzkomórkowej.
Czysta woda zamarza w
temperaturze 0
C, woda morska
zaś średnio w temperaturze od
-0,5 do -0,9
C. Zależy to od
stężenia soli, głównego czynnika
odpowiedzialnego za obniżenie
temperatury krzepnięcia wody.

Białka histerezy termicznej (thermal histeresis proteins)
Organizmy psychrofilne rozwiązały problem zamarzania
wody wewnątrzkomórkowej poprzez syntezę specjalnych
glikoprotein i peptydów, które mogą obniżyd jeszcze
bardziej temperaturę jej krzepnięcia.
Inne nazwy tych białek to antifreeze proteins (AFPs) lub ice
structuring proteins (ISPs).
Błony
Zawierają specyficzne białkowe składniki, zapewniające im
płynnośd oraz możliwośd transportu substratów w
ekstremalnie zimnych warunkach.
Enzymy
Enzymy to wielkocząsteczkowe, w większości białkowe
katalizatory przyspieszające specyficzne reakcje chemiczne.
Enzymy nie zmieniają stanu równowagi reakcji chemicznej, a
jedynie przyspieszają jego ustalenie. Następuje to wskutek
obniżenia energii aktywacji (
G*) reakcji.
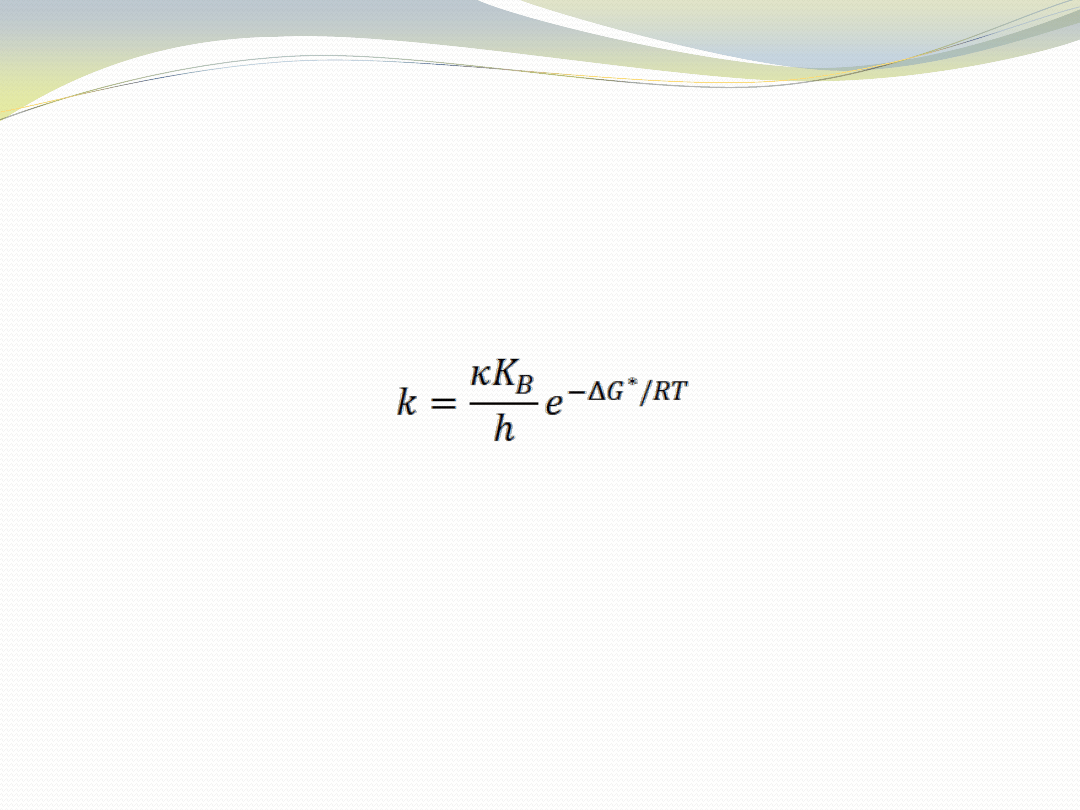
Wpływ niskiej temperatury na
enzymy mezofilne
Szybkośd reakcji chemicznej jest tym wyższa im wyższa jest
temperatura (T) i im niższa jest wartośd energii aktywacji
(
G*), co wynika z równania:
gdzie:
k – stała szybkości reakcji,
- współczynnik transmisji,
K
B
– stała Bolzmanna (1,38
10
-23
J
K
-1
),
h – stała Plancka (6,63
10
-34
J
s
-1
),
R – stała gazowa (8,31 J
K
-1
mol
-1
),
T – temperatura w Kelwinach,
G* - energia aktywacji.
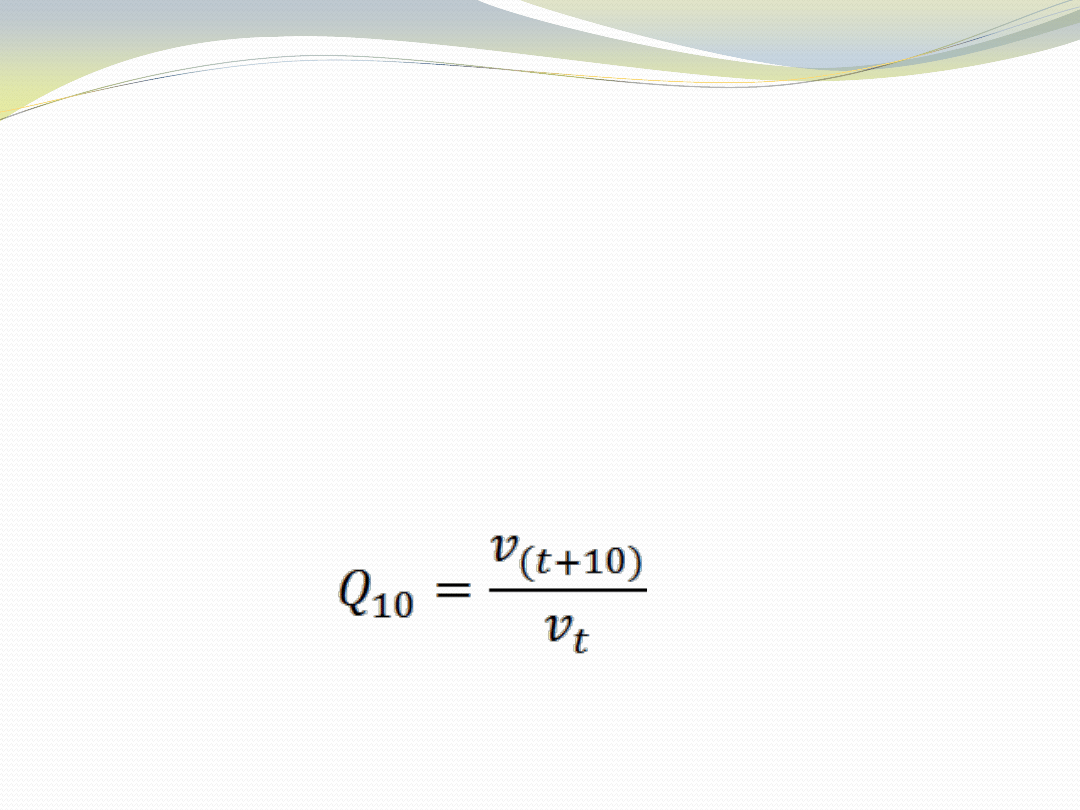
Szybkośd reakcji enzymatycznych wzrasta wraz ze
wzrostem temperatury. Wiąże się to z podwyższeniem
energii kinetycznej cząstek i większą częstotliwością ich
zderzeo.
Wielkośd wzrostu aktywności enzymatycznej w zależności
od temperatury opisuje współczynnik temperaturowy
Q
10
, określający jak zmieni się szybkośd reakcji przy
wzroście temperatury o 10 °C:

Spadek temperatury powoduje spadek szybkości reakcji.
Większośd systemów biologicznych wykazuje spadek
szybkości reakcji 2-3 razy gdy temperatura zostanie
obniżona o 10
C (Q
10
= 2 do 3).
W konsekwencji, gdy temperatura reakcji zostanie
zamieniona z 37
C do 0
C, aktywnośd enzymu
mezofilnego jest od 16 do 81 razy niższa (2
4
do 3
4
).
W związku z tym zaskakuje fakt, iż czas generacji (okres
czasu potrzebny do podwojenia się liczby komórek)
bakterii pschrofilnych w temperaturze bliskiej 0
C jest
tego samego rzędu, co czas generacji mezofili w 37
C.

Aktywnośd i adaptacje
strukturalne enzymów psychrofili
W badaniach wykazano, że enzymy psychrofilne
odznaczają się wyższą reaktywnością (k
kat
) i wyższą
wydajnością (k
kat
/K
m
) niż ich mezofilne i termofilne
odpowiedniki.
k
kat
/K
m
– odzwierciedla zarówno powinowactwo
chemiczne, jak i zdolnośd katalityczną enzymu. Stosunek
ten jest używany do porównywania różnych enzymów
względem siebie lub preferencji jednego enzymu do
różnych substratów
k
kat
– stała katalityczna, wyraża liczbowo zdolnośd enzymu
do katalizowania reakcji chemicznych (jego reaktywnośd),
szybkośd tworzenia produktu

Taka poprawa katalitycznych parametrów wywodzi się
prawdopodobnie z wysoko elastycznej struktury białek, która
zapewnia lepsze zdolności przechodzenia zmian
konformacyjnych podczas katalizy w niskich temperaturach.
Jednakże struktura trójwymiarowa enzymów psychrofilnych
bardzo często nie różni się znacznie od mezofilnych i
termofilnych odpowiedników.
Zwiększona elasycznośd enzymów przystosowanych do
zimnego środowiska może wynikad z:
zmian w wiązaniach wewnątrz cząsteczkowych
interakcji z rozpuszczalnikiem (wodą i rozpuszczonymi jonami)
interakcji między podjednostkami
zwartości rdzenia
wielkości i rozdzielenia wgłębieo

W stosunku do enzmów mezofilnych, psychrofilne mają:
więcej polarnych i mniej hydrofobowych reszt
aminokwasowych,
więcej glicyny
niższy stosunek zawartości argininy do lizyny
mniej wiązao wodorowych, oddziaływao aromatycznych i
wiązao jonowych
brak mostków solnych
dodatkowe miejsca z podwyższoną zawartością polarnych
reszt aminokwasowych lub/i obniżoną zawartością proliny
zmodyfikowane oddziaływania dipolowe w
-helisach
zredukowane oddziaływania hydrofobowe pomiędzy
podjednostkami

Cechy te nigdy nie występują wszystkie naraz w jednym
enzymie. Każdy ma swój specyficzny zestaw zmian w
stosunku do mezo- i termofilnych analogów.
Nadają one elastycznośd centrom aktywnym enzymów,
jednak kosztem aktywności w wyższych temperaturach.
To właśnie powoduje termolabilnośd, czyli termiczną
niestabilnośd, enzymów aktywnych w skrajnie niskich
temperaturach, chod są od tej reguły pewne wyjątki.
Przykłady enzymów psychrofili
Dehydrogenaza mleczanowa z Bacillus
psychrosaccharolyticus
Oksydoreduktaza katalizująca reakcję
przemiany: kwas pirogronowy <-> kwas
mlekowy.
Jest to pierwszy enzym psychrofilny,
którego gen został sklonowany i porównany
do homologicznych sekwencji z bakterii
mezofilnych i termofilnych.
Badania wykazały, że dehydrogenaza
mleczanowa psychrofilna zawiera więcej
polarnych reszt aminokwasowych, a mniej
hydrofobowych niż jej odpowiedniki.
Powoduje to zwiększenie elastyczności
enzymu.
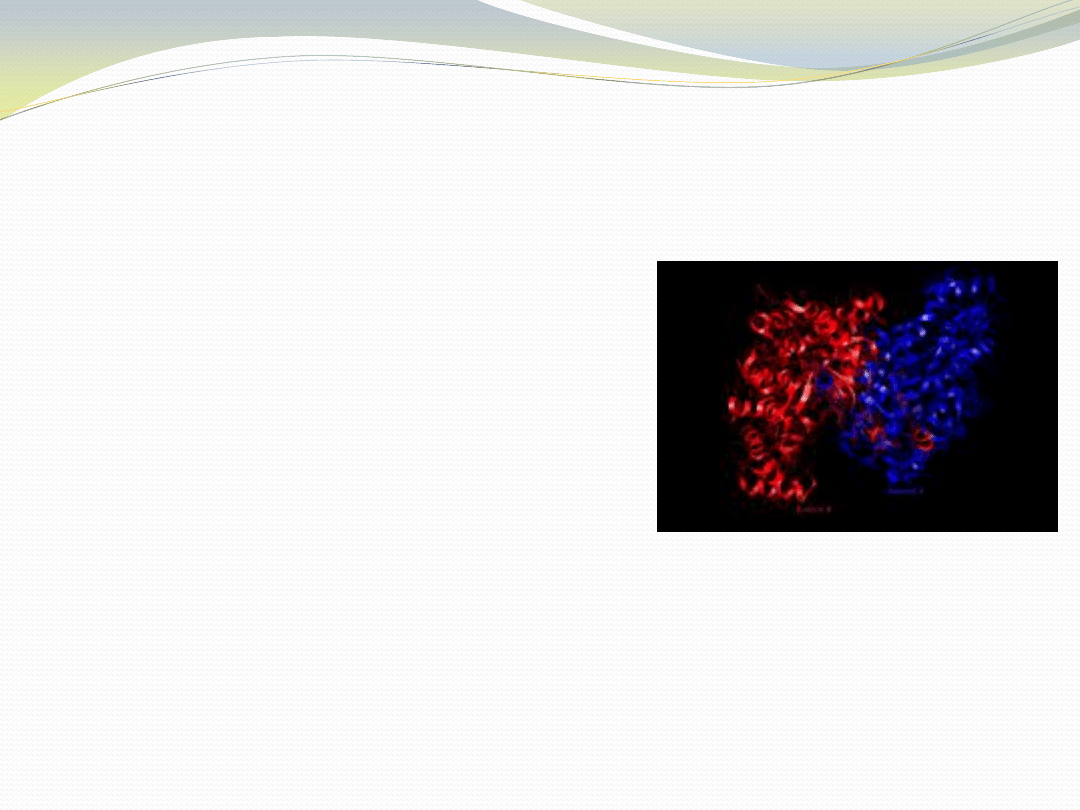
Syntaza cytrynianowa (EC 2.3.3.1) z
Arthrobacter sp. DS2-3R
Enzym cyklu Krebsa, transferaza
katalizująca reakcję włączania acetylo-CoA
do cyklu.
Została wyizolowana z wielu psychrofilnych
i psychrotolerancyjnych bakterii
antarktycznych. Optima wzrostu tych
bakterii zawierają się w przedziale 17-45
C,
mimo to wszystkie zdolne są do wzrostu w
temperaturze bliskiej 0
C.
Gen syntazy cytrynianowej z Arthrobacter
sp. DS2-3R został sklonowany i
zsekwencjonowany.
Struktura tego psychrofilnego enzymu
została porównana ze strukturą
homologicznych enzymów z mezofila
Mycobacterium smegmatis, termofilnego
archeona Thermoplasma acidophilum i
hipertermofilnego archeona Pyrococcus
furiosus.
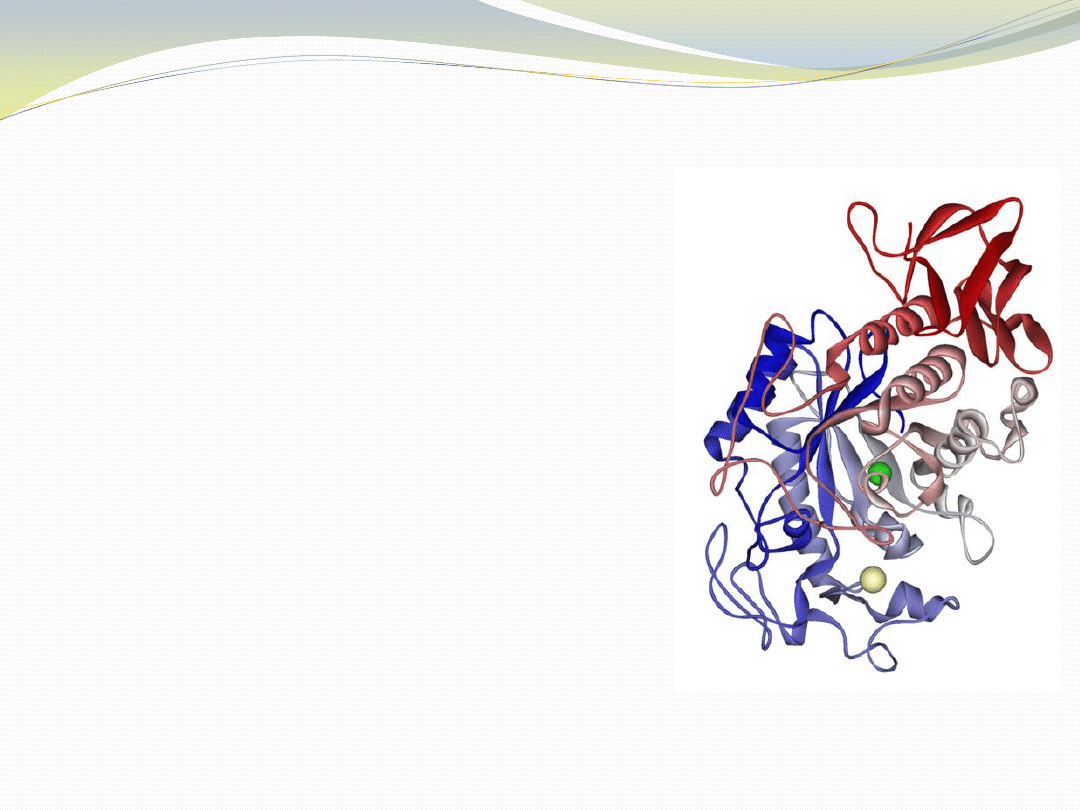
-Amylaza (EC 3.2.1.1) z Alteromonas
haloplanctis
Hydrolaza, katalizująca reakcję
endohydrolizy wiązania
-(1-4)glikozydowego w oligosacharydach
i polisacharydach.
Jest to pierwszy psychrofilny enzym, który
został wykrystalizowany, a jego struktura
porównana za pomocą rentgenografii
strukturalnej (stworzenie modelu
przestrzennego) z
-amylazą świni.
Badania wykazały, że enzym psychrofilny
wykazuje optimum działania w
temperaturze około 30
C niższej niż enzym
mezofilny (świoski). Ponadto, w
temperaturach 4
C i 25
C wykazał on
wydajnośd katalityczną (k
kat
/K
m
)
odpowiednio 6,6 i 3,7 razy wyższą.
Izomeraza triozofosfornanowa (EC
5.3.1.1) z Vibrio marinus
Enzym glikolizy, izomeraza katalizująca
reakcję: fosfodihydroksyaceton (DHAP) <->
D-aldehyd 3-fosfoglicerynowy (PGAL).
Różnica między tym psychrofilnym
enzymem, a jego mezofilnym
odpowiednikiem polega jedynie na
zastąpieniu seryny w pozycji 238 alaniną.
Już tak mała zmiana powoduje, że
izomeraza triozofosforanowa z Vibrio
marinus jest wysoko wydajna katalitycznie,
a jednocześnie bardzo niestabilna
termicznie (jej czas półtrwania w 25
C
wynosi jedynie 10min).

Dehydrogenaza jabłczanowa (EC
1.1.1.37) z Aquaspirillum arcticum
Oksydoreduktaza ostatniej reakcji
cyklu Krebsa: jabłczan ->
szczawiooctan +NADH).
Enzym ten wykazuje wysoką
wydajnośd katalityczną w niskich
temperaturach. Co ciekawe, w
temperaturze 37
C jest wciąż bardziej
wydajny (1,25x) niż jego mezofilny
odpowiednik z E. coli.

Potencjalne zastosowanie
enzymów psychrofili
Degradacja materiału antropogennego w zimnym
środowisku, bioremediacja, np. oleju napędowego,
polichlorowanych bifenyli (zawarte są w transformatorach,
kondensatorach, impregnatach, płynach hydraulicznych,
smarach, opakowaniach, farbach drukarskich, preparatach
owadobójczych, klejach, tworzywach sztucznych)
Przetwórstwo żywności (fermentacja, serowarstwo,
piekarnictwo, cukiernictwo, kruszenie mięsa)
Środki czyszczące
Obróbka skór
Przemysł tekstylny

Wielonienasycone kwasy tłuszczowe (PUFAs –
polyunsaturated fatty acids)
Należą do nich kwasy omega-3, omega-6 i omega-9.
Kwasy tłuszczowe omega-3 i omega-6 to tzw. kwasy
niezbędne, które muszą byd dostarczane do organizmu wraz
z pożywieniem.
Tradycyjnym źródłem tych kwasów są ryby (a także w
mniejszym stopniu algi).
Badania wykazały, że istnieje całkiem sporo rodzajów
bakterii, występujących w głębinach oceanicznych, które je
produkują.
Prowadzi się badania nad produkcją wielonienasyconych
kwasów tłuszczowych na skalę przemysłową przez
organizmy prokariotyczne.
Wyszukiwarka
Podobne podstrony:
2 Enzymy ekstremalnych psychrofili
enzymy
pros 4 Enzymy 1
inhibicja enzymy wykresy
ENZYMY prezentacja biochemia
Enzymy
enzymy prezentacja
kol enzymy
MOO wyklad 2 ekstrema bez ograniczen
Ekstremalna przeprawa gapowicza
enzymy
ekstrema lokalne
odpowiedzi-Habryka zagadnienia do kolosa, INZYNIERIA-BIO, ENZYMY, A Habryka Zamawiany i Aut2
pytania-enzymy, Technologia żywności UWM, enzymologia
enzymy
Enzymy
biochemia enzymy2
Enzymy podział na klasy
więcej podobnych podstron